壳寡糖及其衍生物抗烟草花叶病毒机理的初步研究
孙翠红,徐翠莲,赵铭钦*,王 莹,付培培,陈发元
(1.河南农业大学烟草学院,国家烟草栽培生理生化研究基地,郑州450002;2.河南农业大学理学院,郑州450002)
壳寡糖及其衍生物抗烟草花叶病毒机理的初步研究
孙翠红1,徐翠莲2*,赵铭钦1*,王莹1,付培培1,陈发元1
(1.河南农业大学烟草学院,国家烟草栽培生理生化研究基地,郑州450002;2.河南农业大学理学院,郑州450002)
摘要:为了开发一种低毒高效的新型抗烟草花叶病毒抑制剂,利用合成的新型寡糖希夫碱衍生物进行了抗烟草花叶病毒的药效研究。结果表明:(1)在珊西烟上,采用枯斑寄主半叶法进行抗烟草花叶病毒的药剂筛选,壳寡糖及其衍生物都能有效减少叶片感染烟草花叶病毒的枯斑数,以枯斑抑制率为66.39%的水杨醛席夫碱的预防效果最好;(2)在普通烟K326上,壳寡糖及其衍生物可降低侵染病毒烟草中的叶绿素下降幅度,还可以提高叶片中的防御酶超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)的活性,脯氨酸的含量也得到了积累。
关键词:烟草花叶病毒;壳寡糖;壳寡糖席夫碱;防御酶;脯氨酸
壳寡糖(CS)是一种聚合度在3~10之间,交联度低于5%的低聚β-(1,4)-2-脱氧-2-氨基葡萄糖[1],它是一种诱导植物产生防御反应的潜在信号[2]。Ryan[3]研究发现,寡糖、壳寡糖等功能糖具有激活植物自身免疫、提高植物抗病性的功能。国内外报道用功能糖处理小麦、烟草和水稻等不同植物,可诱导POD、CAT和PAL等防御酶活性提高[4-5],SOD、POD和PAL在活性氧的清除等主动防御反应中起着重要的作用[5]。对植物或者接种过病毒的叶片喷施CS,可以保护烟草花叶病毒(TMV)、黄瓜花叶病毒(CMC)和马铃薯X病毒(PVX)引起的植物局部或全身感染[6-7]。
烟草花叶病是烟草的主要病害之一,严重影响烟草的生长,烟草感染TMV后,品质变差,等级下降,Genger等[8]研究表明,TMV侵染烟草等寄主后,叶片不均匀褪绿黄化。目前,已经推出的主成分为壳寡糖的多种抗病毒剂,对烟草花叶病的防治效果可达到20%~40%[9],国内外又相继合成了壳寡糖的席夫碱、烷基化和磺酰化衍生物,发现其抗病效果明显提高[10-12]。本研究通过壳寡糖及其衍生物对TMV防治效果试验,分析了不同供试药剂对TMV的影响,并通过对相关生理生化指标的测定,初步了解其抗病性机理,为开发高效、环保型抗病毒药剂提供依据。
1 材料与方法
1.1试验材料
1.1.1供试植物与供试病毒珊西烟(Xanthi-NN),
TMV的枯斑寄主;普通烟(Nicotiana tabacum)K326,TMV的系统侵染寄主。烟草花叶病毒(Tobacco mosaic virus, TMV)由贵州大学提供,供试病毒TMV采用常规汁液摩擦接种的方法保存在普通烟K326上。
1.1.2供试药剂市售宁南霉素、壳寡糖、水杨醛席夫碱、壳寡糖季铵盐席夫碱。
1.2试验方法
1.2.1药剂筛选试验采用筛选体外病毒抑制物常用的方法枯斑寄主半叶法[13],在珊西烟上对供试药剂进行筛选试验,试验采用大田盆栽形式,6—7月在河南农业大学试验田进行。
预防试验:选取长势一致,具4~5片真叶的盆栽珊西烟,喷药24h后,采用常规汁液摩擦接种法接种,以清水喷洒后接种为对照,每个处理重复3次,观察发病情况,计算枯斑抑制率。
治疗试验:选取长势一致,具4~5片真叶的盆栽珊西烟,采用常规汁液摩擦接种法接种12h后喷药,以接种后喷洒清水为对照,每个处理重复3次,观察发病情况,计算枯斑抑制率。

1.2.2 药剂在感染TMV的普通烟上的抗性研究试验采用大田盆栽的形式在6月进行。选用长势一致,具7~8片真叶的盆栽K326,采用常规汁液摩擦接种法接种TMV,进行抗性试验。试验方法是先对K326喷施药剂或清水(对照)24h后接种TMV(TMV浓度为3.33 µg/mL),试验设有:CK(喷施清水后不接种TMV),T1(喷施500μg/mL的壳寡糖季铵盐衍生物后接种TMV),T2(喷施1mg/mL的水杨醛席夫碱后接种TMV),T3(喷施1mg/mL壳寡糖后接种TMV),T4(喷施稀释260倍的2%的宁南霉素后接种TMV)。在接种后1、4、7、10、13、16d分别取样装入锡箔纸袋中,做好标记,置于-80℃冰箱中保存用于检测各处理的叶绿素、SOD、POD、CAT、PAL和脯氨酸。
叶绿素的测定采用李虎林等[14]的乙醇提取法;SOD采用NBT(氮蓝四唑)显色法[15];POD、CAT和PAL参照文献[16]的方法,略有修改;脯氨酸采用邹琦[17]的方法。
1.3数据处理
采用SPSS19.0进行统计和差异性分析。
2 结果
2.1最优药剂的筛选
对5个处理的枯斑预防效果及治疗效果进行统计分析,结果如表1所示,从预防效果来看,水杨醛席夫碱的枯斑抑制率高达66.39%,比市售药剂宁南霉素高出3.53%;壳寡糖季铵盐席夫碱的预防效果最差,抑制率为55.83%。其余药剂预防效果为:宁南霉素>壳寡糖;水杨醛席夫碱处理、壳寡糖处理与2%的宁南霉素处理之间差异性不明显,壳寡糖季铵盐席夫碱处理与壳寡糖处理、宁南霉素处理之间差异性较明显,壳寡糖季铵盐席夫碱处理与水杨醛席夫碱处理之间差异性显著。从治疗效果来看,依旧是水杨醛席夫碱治疗效果最好,为30.11%,其次为市售药剂宁南霉素,最差的是壳寡糖溶液;各个处理之间差异性不明显。从综合预防与治疗效果来看,壳寡糖及其衍生物对TMV有一定的效果(图1、图2所示)。
2.2叶绿素含量的动态变化
叶绿素主要包括叶绿素a和叶绿素b,本试验对不同处理烟叶叶绿素总量的动态变化进行了研究,结果如图3所示。喷施壳寡糖及其衍生物对烟草叶片的叶绿素含量均有影响,且曲线变化趋势与对照CK不同。CK处理下,叶绿素含量整体处于稳定状态,变化不大;T1处理的第1天和第4天叶理PAL活性均低于对照,T1和T2处理酶活性曲线几乎重叠且变化较稳定,T3处理的酶活在4~7 d较高且接近于对照;4个处理与对照相比存在明显差异。由此可知,壳寡糖衍生物在一定程度上可有效的增加防御酶的活性。

测定了不同药剂处理后叶片中游离脯氨酸的含量变化,结果如图8所示,喷施壳寡糖及其衍生物对烟草叶片游离脯氨酸含量均有影响,且曲线变化趋势与对照CK相似。5个处理的游离脯氨酸含量整体表现为升高-降低-升高的趋势,且除了对照在第10天达到最大值外,其他处理均在第7天达到最大值。除了T4处理和对照之间存在显著性差异外,其他各个处理之间均存在较显著差异。由此可见,壳寡糖衍生物可有效增加被TMV侵染的烟叶中脯氨酸的含量。
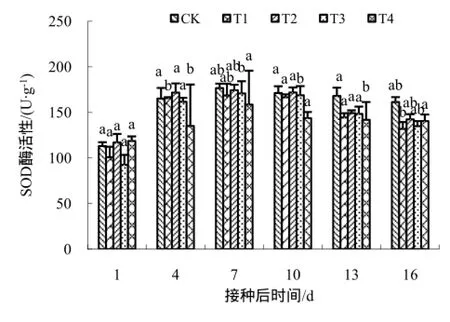
图4 不同药剂处理下SOD酶的活性变化Fig.4 The changes of the SOD activity
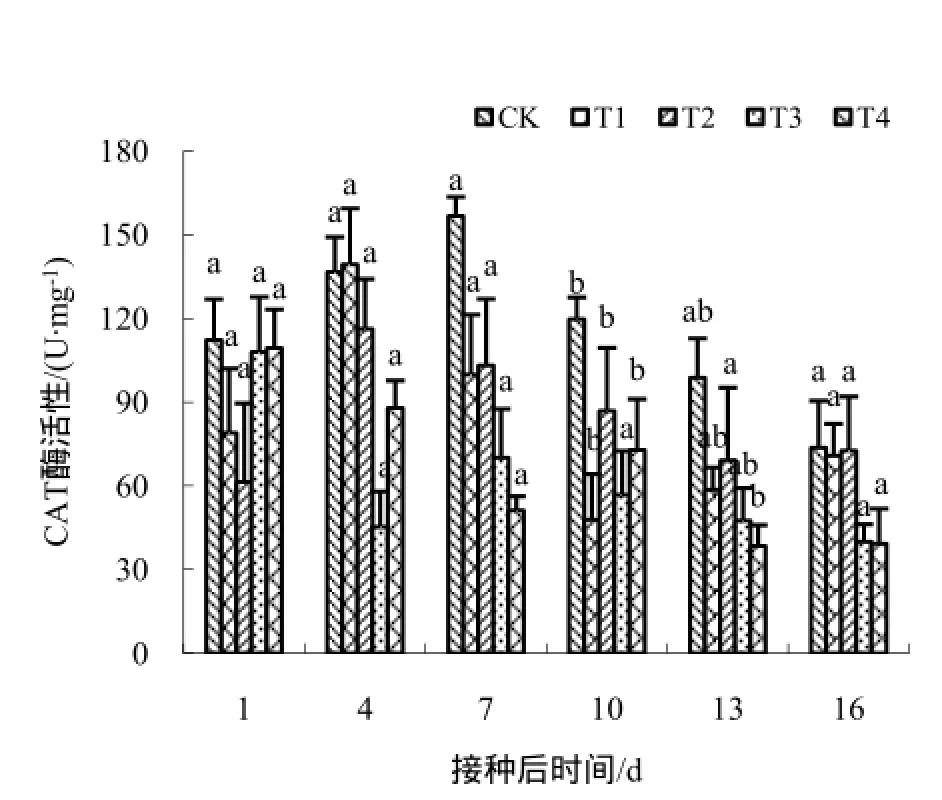
图5 不同药剂处理下CAT酶的活性变化Fig. 5 The changes of the CAT activity

图6 不同药剂处理下POD酶的活性变化Fig.6 The changes of the POD activity
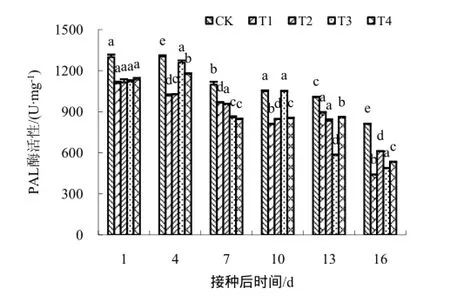
图7 不同药剂处理下PAL酶的活性变化Fig.7 The changes of the PAL activity
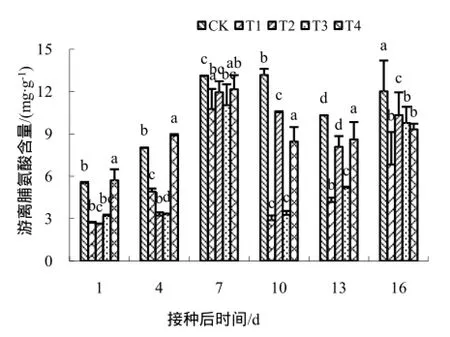
图8 不同药剂处理下脯氨酸的含量变化Fig.8 The changes of proline content
3 讨论
3.1 非系统侵染-在珊西烟上的枯斑抑制效果
采用枯斑寄主半叶法对壳寡糖以及其衍生物在珊西烟上进行抗TMV药效试验。结果表明,在以壳寡糖为原料的基础上,不同的取代基具有不同的防治效果,尤其以水杨醛席夫碱的防治效果较好,其预防效果可以达到66.39%,较市售药剂宁南霉素提高了3.53%。所有参试药剂的治疗效果均不太理想,以枯斑抑制率为30.11%的水杨醛席夫碱较好,因此对于TMV要采取预防为主的措施;叶绿素是植物进行光合作用的重要色素,通过在普通烟株上进一步研究烟草叶片中叶绿素、脯氨酸含量以及防御酶活性的变化得出,壳寡糖以及其衍生物具有一定的抗病效果。
3.2 对活性氧的清除效果
活性氧自由基的积累可导致膜脂过氧化以及影响膜的通透性。有研究表明,与活性氧清除有关的防御酶SOD、CAT、POD、PAL等起着很重要的调控作用。研究发现,壳寡糖处理过的感TMV的烟草叶片中防御酶活性提高[16,18-19],本试验也得到了类似的结果;试验得出,在一定时间内,壳寡糖及其衍生物可提高各种防御酶的活性,达到了有效清除活性氧的目的,这可能是壳寡糖衍生物与结构未修饰的壳寡糖相比,其官能团的增加对提高烟草的抗病性的有一定协同增效作用。
3.3 对游离脯氨酸的影响
作为细胞内重要的渗透调节物质之一,脯氨酸具有调节细胞渗透平衡、稳定细胞结构和阻碍氧自由基产生的作用[20],它与植物体内膜脂过氧化作用的减轻和活性氧自由基的清除有着密切的关系[21],作为植物体内重要和有效的有机渗透调节物质,几乎所有的逆境都会造成植物体内脯氨酸的积累[22]。20世纪50年代Kemple等[23]发现多年生黑麦草在逆境条件下,游离脯氨酸含量增加,而在正常条件下其含量较低,且脯氨酸含量的增加与逆境强弱以及植物抗逆性有关,因此,脯氨酸的含量高低可以反映逆境对植物的危害程度以及植物对逆境的抵抗能力[24],本试验得出的结果也符合此规律。
总的来说,壳寡糖衍生物有望开发成为一种新型、低毒的烟草花叶病毒病防治药剂。
作为一种植物生长调节物质,壳寡糖可有效的诱导植物防御酶活性的变化,也可诱导烟草对TMV的侵染产生系统抗病性,近年来人们不再仅仅关注于壳寡糖的抗病性,壳寡糖衍生物也渐渐成为了行业研究的热点。壳寡糖上连有不同的基团可产生不同的抗病效果,其作为一种绿色药剂,应用前景十分广阔。
药剂防治可在玉米吐丝盛期进行,重点喷洒果穗。每亩用25%粉锈宁可湿性粉剂100克兑水50-75公斤喷雾,一般连喷2次,间隔7-10天。
参考文献
[1] ZhangH, DuYG, YuXJ.Preparation of chitooligosaccharides from chitosan by a complex enzyme[J]. Carbohydrate Research. 1999, 320: 257-260.
[2] HadwigerLA, OgawaT, KuyamaH. Chitosan polymer sizes effective in inducing phytoalexin accumulation and fungal suppression are verified with synthesized oligomers[J].Molecular Plant- Microbe Interactions. 1994, 7: 531-533.
[3] Ryan C A. Oligosaccharide signals: from plant defense to parasite offense[J]. Proceedings of the NationalAcademy of Sciences of the United States of America, 1994, 91(1):1-2.
[4] Burkhanova G F, Yarullina L G, Maksimov IV. The control of wheat defense responses during infection with Bipolaris sorokiniana by chitooligo-saccharides[J]. Russian Journal of Plant Physiology, 2007,54(1):104-110.
[5] Chakraborty M, Karun A, Mitra A. Accumulation of phenylpropanoid derivatives in chitosan-induced cell suspension culture of cocosnucifera[J]. Journal of Plant Physiology, 2009, 166(1): 63-71.
[6] Henryk P, Sergei C, Joseph K. Induction of antiviral resistance in plants by chitosan[J]. Plant Science, 1991,79: 63-68.
[7] ChircovSN, IllinaAV, SurguchevaNA,et al. Effect of chitosan on systemic viral infection and some defense responses in potato plants[J]. Russian Journal of Plant Physiology, 2001, 48: 774-779.
[8] Genger R K, Jurkowski G I, McDowell J M, et al. Signaling pathways that regulate the enhanced disease resistance of arabidopsis“defense,no death”mutants[J]. Molecular Plant-Microbe Interactions, 2008, 21(10): 1285-1296.
[9] 郭红莲,李丹,白雪芳,等.壳寡糖对烟草TMV病毒的诱导抗性研究[J].中国烟草科学,2002,23(4):1-3.
[10]Huang J M, Chen R Y. An overview of recent advances on the synthesis and biologicalactivity of Chemistry, 2000, 11: 480-492.
[11] Miao Z W, Fu C R, Wang B, et al. Synthesis and electrospray ionization mass spectra of N-(1,3,2-dioxaphosphorinan-2-ylmethyl)thiophosphoramidates [J]. Chinese Journal Chemistry, 2007, 25(9):1344-1348.
[12] 陈茹玉,戴庆,张殿坤,等.类Mannich反应合成N-对甲苯磺酰基-α-氨基膦酸二乙酯[J].中国科学B辑:化学,1995,25(6):591-595.
[13] Hansen AJ. Antiviral chemicals for disease control[J]. CRC Critical Reviews in Plant Sciences, 1989, 8 (1):45-88.
[14] 李虎林,白青竹,姬文秀,等. 不同类型烟草叶片叶绿素和类胡萝卜素含量比较分析[J]. 延边大学农学学报,2008,30(3):153-156.
[15]刘炳辉,董晓颖,李志军,等. 硬肉桃果实成熟前后几种与果实软化相关的生理指标的变化[J]. 植物生理学通讯,2008,44(5):887-890.
[16] Chen Y F, Zhan Y, Zhao X M, et al. Functions of oligochitosan induced resistance andpathogenesis relatedprotein lcinase in tobacco mosaic virus proteins in tobacco[J]. Plant Physiology& Biochemistry, 2009, 47:724-731.
[17]邹琦. 植物生理生化实验指导[M]. 北京:中国农业出版社,1995.
[18]Zhao X M, She X P, Du Y G, et al. Induction of antiviral resistance and stimulary effect by oligochitosan intobacco[J]. Pesticide Biochemistry Physiology, 2007,87: 78-84.
[19]杜昱光,白雪芳,赵小明,等.壳寡糖对烟草防御酶活性及同工酶酶谱的影响[J].中国生物防治,2002,18(2):83-86.
[20] 彭志红,彭克勤,胡家金.渗透胁迫下植物脯氨酸积累的研究进展[J].中国农学通报,2002,18(4):80-83.
[21] Metha S K, Gaur J P.Heavy metal induced proline accumulation and its role in a meliorating metal toxicity in Chlorella vulgaris[J].New Phytologist,1999,143:253-259.
[22] 全先庆,张渝洁,单雷.高等植物脯氨酸研究进展[J].生物技术通报,2007(1):14-18.
[23] Kemple AR, Macpherson H T. Liberation of amino acid in perennial rye grass during witting[J]. Biochemistry,1954 (58): 45-49.
[24]马秀芳,沈秀瑛.不同耐旱性玉米品种对干旱的生理生化反应[J].沈阳农业大学学报,2002,33(3):167-170.
α-aminophosphonic acid derivatives[J]. Heteroatom
中图分类号:S435.72
文章编号:1007-5119(2015)02-0087-06
DOI:10.13496/j.issn.1007-5119.2015.02.016
基金项目:河南省烟草公司重点科技攻关项目(HYKJ201015、HYKJ201307)
作者简介:孙翠红,女,硕士,主要从事烟草化学研究。E-mail:13838144121@163.com
*通信作者,E-mail:xucuilian666@126.com;E-mail:zhaomingqin@126.com
收稿日期:2014-10-26修回日期:2015-02-28
The Inhibitory Effects of Chitooligosaccharides and its Derivatives on Tobacco Mosaic Virus (TMV)
SUN Cuihong1, XU Cuilian2*, ZHAO Mingqin1*, WANG Ying1,FU Peipei1, CHENFayuan1
(1. National Tobacco Cultivation&Physiology&Biochemistry Research Center, College of Tobacco,Henan AgriculturalUniversity,Zhengzhou 450002,China; 2. College of Science,Henan Agricultural University, Zhengzhou 450002, China)
Abstract:In order to develop a kind of the new inhibitor of low toxicity and high efficiency against TMV, the inhibitive effect of the new oligosaccharide Schiff base derivatives against TMV was conducted.The results showed that: (1) on Xanthi-NN, chitosan and its derivatives could all reduce the number of the dry spots infected by TMV effectively by screening potions with the dry spot host half leaf method, and the best result was obtained for salicylaldehydechitosanSchiff base giving the inhibition rate of 66.39%; (2) on Nicotiana tabacum K326, chitosan and its derivatives can lower the decrease of chlorophyll content, and increase activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), polyphenol oxidase (PPO) and phenylalanine ammonia-lyase (PAL)in inoculated leaves, at the same time the content of proline had also accumulated.
Keywords:TMV; chitooligosaccharides; oligosaccharide schiff base; defense enzymes; proline

