脯氨酸与重金属耐性和富集的研究进展
徐 超
(广东智环创新环境科技有限公司,广州 510045)
研究发现,植物生长于重金属污染的环境中,植物体内游离氨基酸中的羧基、氨基、巯基和酚基等功能团能与金属离子结合,形成稳定的螯合物,对有毒重金属具有钝化和解毒作用;游离氨基酸中的脯氨酸、谷氨酸、半胱氨酸还是植物螯合肽合成前体,而植物螯合肽被认为对植物重金属耐性起重要作用[1-2]。对重金属胁迫下各种植物和微生物的研究发现,其体内各种有机小分子在其重金属耐性和富集中发挥重要作用,这些有机小分子包括有机酸、氨基酸、植物螯合肽等[3-4]。本文拟对目前国内外有关脯氨酸以及植物和微生物重金属耐性和富集的研究进行综述,重点阐述脯氨酸在各种植物和微生物中的重金属耐性研究进展。
1 脯氨酸与重金属耐性
很多植物和藻类对有毒重金属作出响应和解毒的一种机理就是合成脯氨酸[5-9]。而有研究指出,同一物种下不同金属耐性生态型的植物,其体内脯氨酸的含量差别显著:Armeria maritima中Cu耐性的生态型根部脯氨酸含量明显高于非金属耐性生态型;Deschampsia cespitosa中Zn耐性生态型根部脯氨酸含量是非金属耐性的4倍。与前两者不同,Silene vulgaris中金属耐性生态型的脯氨酸含量是非金属耐性生态型的5~6倍,但高含量的脯氨酸却定位于叶[4]。Bačkor等对地衣共生藻Trebouxia erici研究发现,脯氨酸在细胞中基于重金属处理时间、处理浓度和株型差异的积累与先前在自由生活的藻类中观察到的结果相近,金属耐性株系细胞中脯氨酸的含量基本高于非耐性株系[10]。Wu CT等在一些藻类中发现,对Cu耐性较高的品种同时在细胞内积累更多的脯氨酸[11]。一些植物在重金属胁迫下积累脯氨酸的研究统计结果如表1、表2所示。
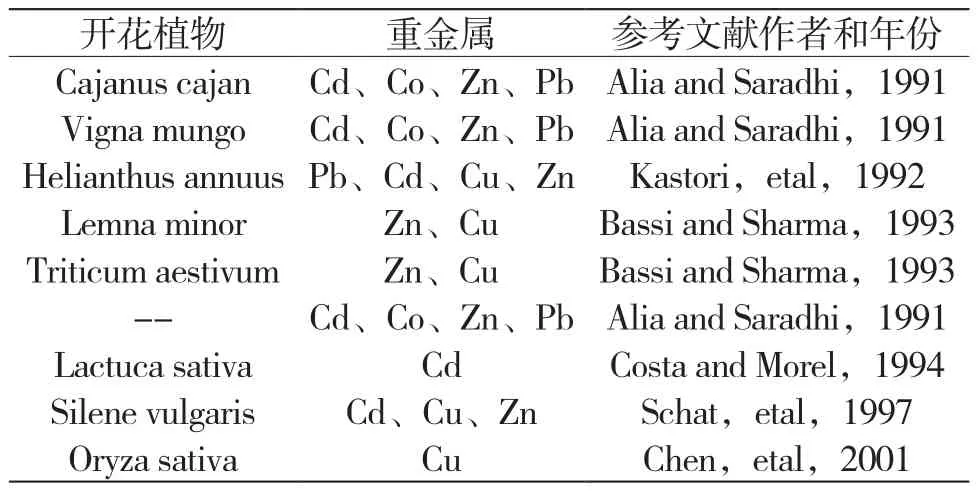
表1 重金属诱导脯氨酸积累研究统计结果(一)
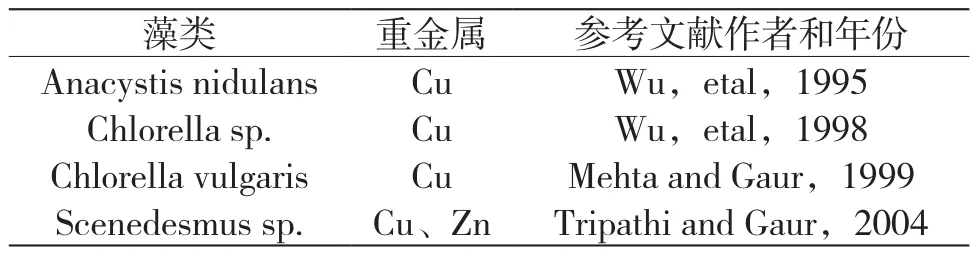
表2 重金属诱导脯氨酸积累研究统计结果(二)
Siripornadulsil等利用转基因的方法提高Chlamydomonas reinhardtii脯氨酸含量,以研究脯氨酸与重金属耐性,发现在非胁迫环境下,增强合成脯氨酸对C.reinhardtii的生长有轻微的促进作用;而在100 μmol/L Cd处理下,转基因型的生长速率是野生型的1.5倍,同时转基因型的叶绿素含量亦显著多于野生型,转基因型最高时能在胞内积累比野生型多3.2倍的Cd,但是转基因型的Cd耐性只比野生型稍强[12]。转基因型胞内脯氨酸含量比野生型多80%,但50 μmol Cd处理并没有引起转基因型或是野生型脯氨酸含量的增加。支立峰等以烟草细胞为试验材料也获得相近的结果[13]。
Tripathi和Gaur研究了外源添加脯氨酸对Scenedesmus sp.重金属耐性的影响,发现该藻类在添加外源脯氨酸的情况下比对照吸收了更多的Cu和Zn,同时重金属对细胞的毒害也减轻[14]。这一研究结果与Bačkor等对地衣共生藻Trebouxia erici的研究结果接近:当Cu与脯氨酸一起添加到培养基中,Cu耐性的T.erici的生长得到明显促进,其叶绿素a、叶绿素b、叶绿素a+b以及胡萝卜素的含量显著上升,而野生型光合系统Ⅱ的产量也显著增加[10]。
2 脯氨酸的作用
Sharma等的研究显示,在离体情况下,脯氨酸能有效保护酶活性免受重金属的影响[15]。脯氨酸对葡萄糖-6-磷酸脱氢酶的保护是通过与Cd形成无毒的Cd-脯氨酸复合物实现的,而这个结论同样适用于脯氨酸在Zn胁迫下对该酶的保护。
然而,脯氨酸与重金属形成复合物并不是重金属诱导所积累的脯氨酸的主要功能,或者说脯氨酸并不是主要通过与重金属形成螯合物来缓解重金属的毒性的[15]。因为金属-脯氨酸复合物的稳定常数太低,不太可能防止重金属与酶的结合[16]。即使脯氨酸的浓度积累至1 mol/L,像Cd和Cu等亲硫金属在细胞质环境中仍主要与硫醇结合,而Cd和Cu能强烈诱导植物螯合肽的合成[17-18]。对Silene vulgaris的研究发现,即便在重金属胁迫诱导合成大量脯氨酸的情况下[6],植物螯合肽在施加重金属处理的较短时间里结合了95 %以上的水溶态Cd[19-20]。在Cu胁迫下的情况也一样[15]。另外,与硫亲和性较低的金属,如Zn,在细胞质pH条件下被认为主要与苹果酸、柠檬酸等羧酸结合[17]。Siripornadulsil等利用扩展的X射线精细结构(EXAFS)研究了转基因和野生型C.reinhardtii细胞内Cd的配位情况,发现在转基因型中,Cd被植物螯合肽螯合而不是脯氨酸,野生型中Cd从四个方向被两个氧原子和两个硫原子配位[12]。Sharma等认为,重金属诱导积累的脯氨酸主要在渗透调节和避免酶脱水方面起作用,而不是螯合重金属[15]。
在重金属胁迫中脯氨酸的作用是多方面的,但主要是抗氧化胁迫方面的作用。Mehta和Gaur报道外源脯氨酸能降低Cu、Cr、Ni和Zn处理下Chlorella vulgaris的脂质过氧化和K+流失[8]。Siripornadulsil等也报道,Cd胁迫下野生型C.reinhardtii细胞内MDA(丙二醛,脂质过氧化产物)含量比转基因型高70%,而转基因型胞质中MDA含量较对照没有变化(50 μmol/L Cd胁迫);同时野生型GSSG含量较对照增加了3倍而转基因型中较对照没有增加,野生型的GSH:0.5GSSG比值较转基因型下降了4倍,说明在Cd胁迫下,转基因型的胞质比野生型处于一个更还原的状态[12]。由于转基因型本身胞质中脯氨酸水平比野生型高80%,因此可以推测,脯氨酸直接作为一种抗氧化剂保护细胞免受重金属胁迫而产生自由基的毒害。Tripathi和Gaur的研究也支持这一观点:抗坏血酸和苯甲酸钠的分别预处理减少了重金属处理下Scenedesmus sp.细胞中MDA的含量,同时也减少了脯氨酸的积累,如图1所示[14]。抗坏血酸是一种抗氧化剂,而苯甲酸钠是一种自由基清除剂,因此可以认为在金属胁迫下的脯氨酸积累,其主要作用是抗氧化。
另外,受胁迫植物对脯氨酸的积累是与减少生物膜和蛋白的损伤相互关联的[21]。脯氨酸的合成亦被指能缓解细胞质酸化,维持细胞内NADP+/NADPH比例在新陈代谢的正常水平[22]。脯氨酸的快速代谢能给线粒体中进行的氧化磷酸化提供支持,产生ATP(腺嘌呤核苷三磷酸)用以修复胁迫引起的损伤。
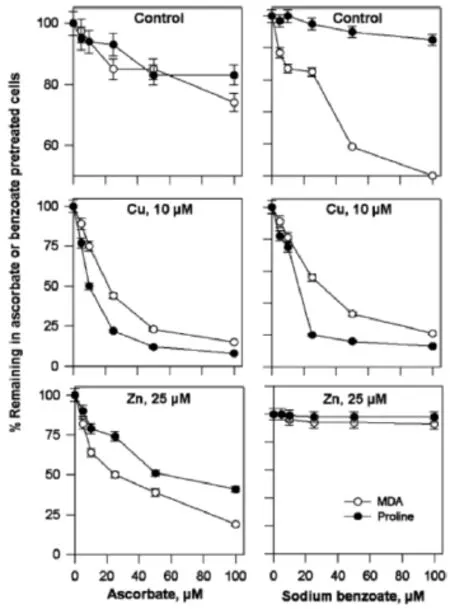
图1 抗坏血酸(Ascorbate)和苯甲酸钠(Sodium benzoate)预处理减少重金属胁迫下Scenedesmus sp.细胞中MDA和脯氨酸的积累
3 结语
植物在重金属胁迫下加强体内脯氨酸的合成是一个普遍的现象。植物的金属耐性生态型一般比非金属耐性的生态型合成更多的脯氨酸,具有更高的体内脯氨酸水平。利用转基因的分子技术提高脯氨酸的含量,能加强植物的重金属耐性,外源添加脯氨酸能显著减轻重金属对植物的毒害作用。
脯氨酸主要是通过自身的抗氧化特性,增强胞质环境的还原性来缓解重金属毒害,而不是与重金属离子形成复合物。脯氨酸能显著缓解重金属胁迫导致的脂质过氧化,抑制K+流失,促进谷胱甘肽的合成从而有利于合成植物螯合肽。
相对于单个氨基酸分子,蛋白质或多肽具有更复杂的空间结构,在与重金属的结合、解毒方面具有更高的稳定性。此外,氨基酸的各种衍生物也可能在各种重金属的耐性和富集中发挥作用。
1 Leopold I,GuÈnther D,Schmidt J,etal.Phytochelatins and heavy metal tolerance[J].Phytochemistry,1999,(50):1323-1328.
2 Christopher SC.Phytochelatin biosynthesis and function in heavy-metal detoxification[J].Current Opinion in Plant Biology,2000,(3):211-216.
3 Callahan DL,Baker AJM,Kolev SD,etal.Metal ion ligands in hyperaccumulating plants[J].Journal of Biological Inorganic Chemistry,2006,(11):2-12.
4 Sharma SS,Dietz KJ.The significance of amino acids and amino acid-derived molecules in plant responses and adaptation to heavy metal stress[J].Journal of Experimental Botany,2006,57(4):711-726.
5 Delauney AJ,Verma,DPS.Proline biosynthesis and osmoregulation in plants[J].Plant Journal,1993,(4):215-223.
6 Schat H,Sharma SS,Vooijs R.Heavy metalinduced accumulation of free proline in a metaltolerant and a nontolerant ecotype of Silene vulgaris[J].Physiologia Plantarum,1997,(101):477-482.
7 Shah K,Dubey RS.Effect of cadmium on proline accumulation and ribonuclease activity in rice seedlings:Role of proline as a possible enzyme protectant[J].Biologia Plantarum,1998,(40):121-130.
8 Mehta SK,Gaur JP.Heavy-metal-induced proline accumulation and its role in ameliorating metal toxicity in Chlorella vulgaris[J].New Phytologist,1999,(143):253-259.
9 Verma DPS.Osmotic stress tolerance in plants:Role of proline and sulfur metabolisms[J].The Plant Cell,1999,(8):153-168.
10 Bačkor M,Fahselt D,Wu CT.Free proline content is positively correlated with copper tolerance of the lichen photobiont Trebouxia erici (Chlorophyta)[J].Plant Science,2004,(167):151-157.
11 Wu JT,Chang SJ,Chou TL.Intracellular proline accumulation in some algae exposed to copper and cadmium[J].Botanical Bulletin of Academia Sinica,1995,(36):89-93.
12 Siripornadulsil S,Traina S,Verma DPS,etal.Molecular mechanisms of proline-mediated tolerance to toxic heavy metals in transgenic microalgae[J].The Plant Cell,2002,(14):2837-2847.
13 支立峰,余 涛,朱英国,等.过量表达脯氨酸的转基因烟草细胞对毒性重金属的抗性增强[J].湖北师范学院学报(自然科学版),2006,26(2):14-19.
14 Tripathi BN,Gaur JP.Relationship between copperand zinc-induced oxidative stress and proline accumulation in Scenedesmus sp[J].Planta,2004,(219):397-404.
15 Sharma SS,Schat H,Vooijs R.In vitro alleviation of heavy metal-induced enzyme inhibition by proline[J].Phytochemistry,1998,(49):1531-1535.
16 Perrin DD.Stability Constants of Metal-Ion Complexes:Part B[M].Organic Ligands:Pergamon Press,1979.
17 Martell AE,Smith RM.Critical Stability Constants[M].New York:Plenum Press,1982.
18 Grill E,Winnacker EL,Zenk MH.Proceedings of the National Academy of Sciences of the United States of America[J].National Academy of Sciences,1915,39(3):135-138.
19 DeKnecht JA,VanBaren N,TenBookum WM,etal.Synthesis and degradation of phytochelatins in cadmium-sensitive and cadmium-tolerant Silene vulgaris[J].Plant Science,1995,106(1):9-18.
20 DeKnecht JA,VanDillen M,Koevoets PLM,etal.Phytochelatins in cadmium-sensitive and cadmiumtolerant Silene vulgaris[J].Plant Physiology 1994,104:255-261.
21 Alia,Saradhi PP,Mohanty P.Involvement of proline in protecting thylakoid membranes against free radical-induced photodamage[J].Journal of Photochemistry and Photobiology B-Biology,1997,(38):253-257.
22 Hare PD,Cress WA.Metabolic implications of stress-induced proline accumulation in plants[J].Plant Growth Regulation,1997,(21):79-102.

