湖北地区烟草青枯菌系统发育分析
刘海龙,黎妍妍,,郑 露,李锡宏,黄俊斌*
(1.华中农业大学植物科技学院,湖北省作物病害监测和安全控制重点实验室,武汉 430070;2.湖北省烟草科学研究院,武汉 430030)
湖北地区烟草青枯菌系统发育分析
刘海龙1,黎妍妍1,2,郑露1,李锡宏2,黄俊斌1*
(1.华中农业大学植物科技学院,湖北省作物病害监测和安全控制重点实验室,武汉 430070;2.湖北省烟草科学研究院,武汉 430030)
摘要:本研究采用青枯菌演化型分类框架,对来源于湖北烟区的48个烟草青枯菌进行系统发育学分析并进行序列变种鉴定,以明确该地区烟草青枯菌的菌系分化。基于青枯菌内切葡聚糖酶基因(egl)和DNA蛋白修复基因(mutS)的系统发育学分析结果表明,48个供试菌株属于青枯菌亚洲分支(演化型Ⅰ)的3个序列变种,分别为序列变种15、17和44,未发现我国已报道的烟草青枯菌序列变种34。其中序列变种17和44为优势菌系,且均来源于恩施地区;序列变种15只包含来源于十堰地区的3个菌株。本研究表明湖北地区烟草上的青枯菌存在一定程度的遗传分化。
关键词:烟草;青枯菌;序列变种;内切葡聚糖酶基因;DNA修复蛋白基因
烟草青枯病是由青枯雷尔氏菌(Ralstonia solanacearum)引起的危害世界烟叶生产的重要土传病害,1864年在印度尼西亚首次报道了青枯菌对烟草的毁灭性危害[1]。1940年前后,该病在美国的北卡罗来纳州猖獗危害,此后,又逐渐成为日本、澳大利亚、韩国等许多产烟国家烟草上重要病害[2]。烟草青枯病在我国长江流域及其以南烟区普遍发生,其中尤以福建、贵州、云南、湖南及广西烟区危害最为严重[3]。近年来,该病逐渐向北方烟区扩展蔓延,辽宁、河南及陕西等省均有该病发生的报道[4-5]。
传统的分类框架是根据青枯菌的寄主范围或对3种双糖和3种己醇的利用能力将其划分为5个生理小种(race1,2,3,4和5)或6个生化型(biovarⅠ,ⅡA ,ⅡT,Ⅲ,Ⅳ和Ⅴ)[6-7]。2005年,Fegan等[8]提出了新的青枯菌划分框架,将青枯菌依次划分为种(Species)、演化型(Phylotype)、序列变种(Sequevar)和克隆(Clone)4个分类水平,并分别建立了与之相对应的鉴定方法。其中演化型的划分与青枯菌地理起源紧密相关,即演化型Ⅰ、Ⅱ、Ⅲ和Ⅳ。基于青枯菌内切葡聚糖酶基因(egl)和DNA修复蛋白基因(mutS),每一个演化型又可划分为不同的序列变种,目前青枯菌已划分出53个序列变种[9-10]。
我国对烟草青枯病菌菌系的研究大多以传统的生理小种和生化型测定为主,而应用最新的演化型分类框架对烟草青枯菌的菌系分化研究较少。郑向华等[11]采用RAPD法对广东省烟草青枯病菌的遗传多样性进行了研究;Xu等[12]和潘哲超等[13]采用演化型分类框架对福建及贵州等地的62个烟草青枯菌菌株进行了系统发育分析。近年来,随着湖北烟草生产的不断发展,烟草青枯病的发生也日趋严重,本研究在湖北恩施地区的烟草青枯菌进行了生理分化研究的基础上[14],采用国际最新的青枯菌演化型分类框架,对湖北省青枯病危害较重烟区的烟草青枯菌进行系统发育学分析并进行序列变种鉴定,为湖北地区青枯病的防控工作及烟草的抗青枯病育种提供理论基础。
1 材料与方法
1.1 供试菌株
2013年和2014年分别从湖北省恩施州和十堰市的12个种烟乡镇采集分离烟草青枯菌株,共获得48个烟草青枯菌株。供试菌株和参考菌株见表1。
1.2供试菌株egl基因的扩增
选用MiniBEST Bacterial Genomic DNA Extraction试剂盒(ver3.0,大连宝生物工程有限公司)提取48个供试菌株基因组DNA,以此DNA为模板,对供试菌株的egl基因进行PCR扩增。
用于扩增内切葡聚糖酶(egl)基因的引物为:Endo-F(5'-ATGCATGCCGCTGGTCGCCGC-3)和Endo-R(5'-GCGTTGCCCGGCACGAACACC-3')[15]。PCR扩增采用25 μL反应体系,其中包括2×Es Taq MasterMix 12.5 μL,引物Endo-F和Endo-R各1 μL,DNA 50ng,RNase-Free水补足25 μL。反应程序为96 ℃ 9 min;95 ℃ 1 min,64 ℃ 1 min和72 ℃2 min,30个循环;最后72 ℃延伸10 min,4℃保存。PCR扩增产物回收后交由武汉擎科创新生物科技有限公司测序。
1.3供试菌株mutS基因的扩增
用于扩增青枯菌DNA修复蛋白(mutS)基因的引物为:mutS-RsF.1570(5'-ACAGCGCCTTGAG CCGGTACA-3')和mutS-RsR.19265'-GCTGA TCACCGGCCCGAACAT -3')[16]。PCR扩增采用25μL反应体系,其中包括2×Es Taq MasterMix 12.5μL,引物mutS-RsF.1570水补足25μL。反应程序为96℃ 9min;95℃30 s,60 ℃30 s和72℃1 min,35个循环;最后72℃延伸10min,4 ℃保存。PCR扩增产物回收后交由武汉擎科创新生物科技有限公司测序。
1.4 供试菌株的序列分析
将测序获得的48个菌株的egl和mutS基因序列经BioEdit7.2.5软件[13]编辑后,提交给GenBank数据库,获得登录号见表1。然后应用Clustal W软件对序列进行比对,用MEGA6.0.5(http://www.megasoftware.net/)软件进行系统发育分析,采用邻接法(NJ)构建发育树,自举分析为1000次重复抽样检验得到的自举置信度。从GenBank选取17个已确定序列变种归属的参考菌株序列作为参考,以确定供试菌株在系统发育树中的位置。
2 结果
2.1青枯菌egl基因系统发育分析结果
对来源于湖北地区烟草青枯病菌的egl基因部分序列进行系统发育分析。结果表明,所有48个参试菌株分布于亚洲分支(演化性Ⅰ)下的3个亚组内(图1)。采用GenBank数据库中已知序列变种的标准菌株序列作为参照,3个亚组分别被鉴定为序列变种15、17和44。其中序列变种15以我国台湾的番茄青枯菌菌株Pss358为参考,该序列变种仅包括3个来源于十堰烟区的分离菌株,寄主品种为‘云烟87’;以来源于广西花生青枯菌菌株P11作为标准菌株的序列边变种17,包括19个菌株,分别来源于恩施烟区的宣恩、利川、咸丰、鹤峰、建始5县,寄主品种为‘毕纳1号’、‘云烟87’、‘K326’以及‘鄂烟1号’;序列变种44的标准菌株为我国广东油橄榄青枯菌菌株O3,该序列变种包括26个菌株,分别来源于恩施烟区的宣恩、利川、咸丰、建始、来凤、恩施6个县市,分离寄主品种为‘云烟87’、‘毕纳1号’和‘鄂烟1号’。
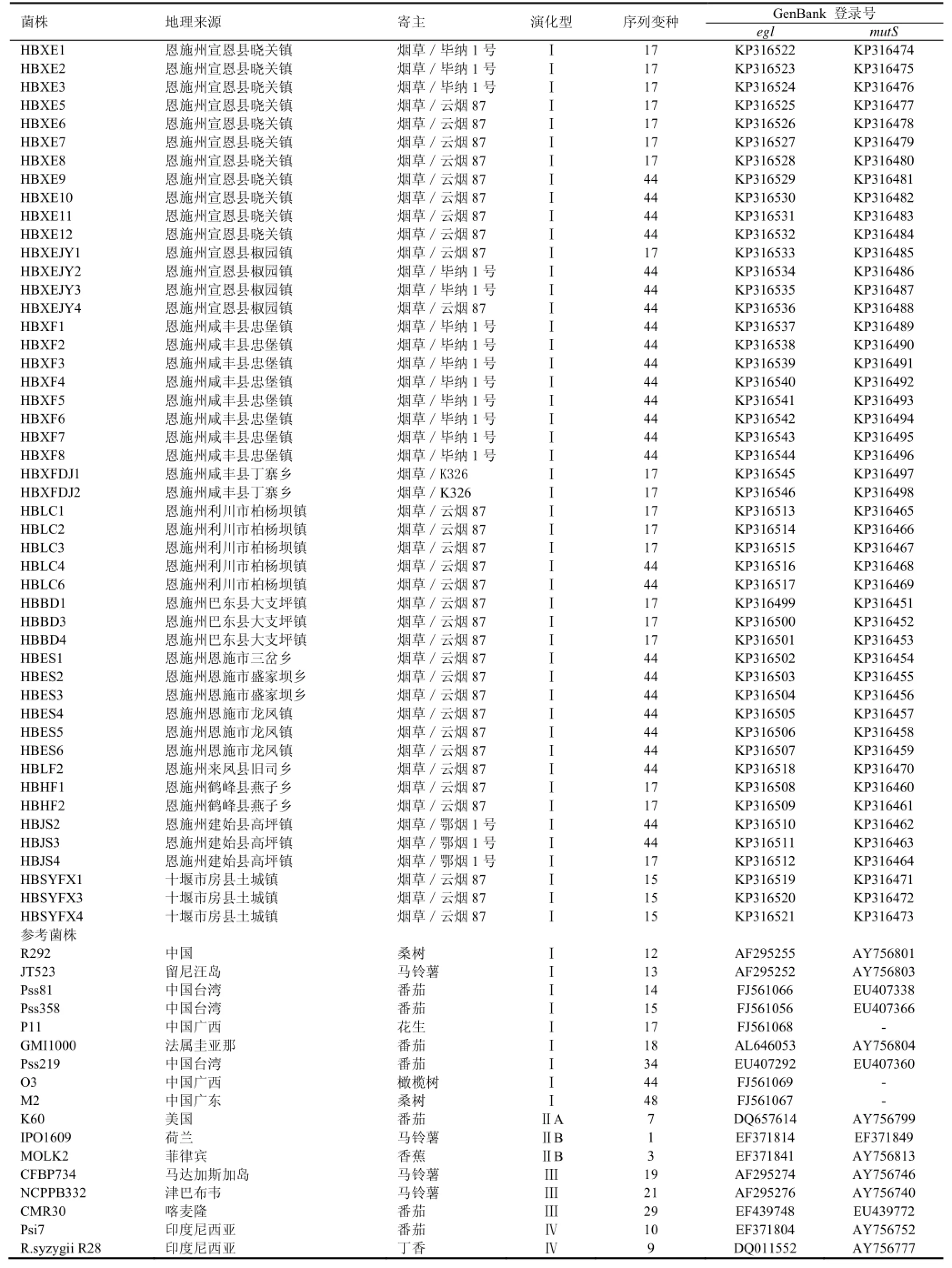
表1 供试烟草青枯菌及上传到基因数据库的基因序列Table1 Ralstonia solanacearum strains used in this study and gene sequences deposited in GenBank
2.2青枯菌mutS基因系统发育分析结果
通过对48个参试菌株的mutS基因部分序列系统发育结果表明,所有菌株分布于亚洲分支(演化性Ⅰ)下的2个亚组内(图2)。其中亚组1包含的菌株相当于由egl基因划分的序列变种44,而亚组2包含的菌株相当于由egl基因的序列变种15和序列变种17。
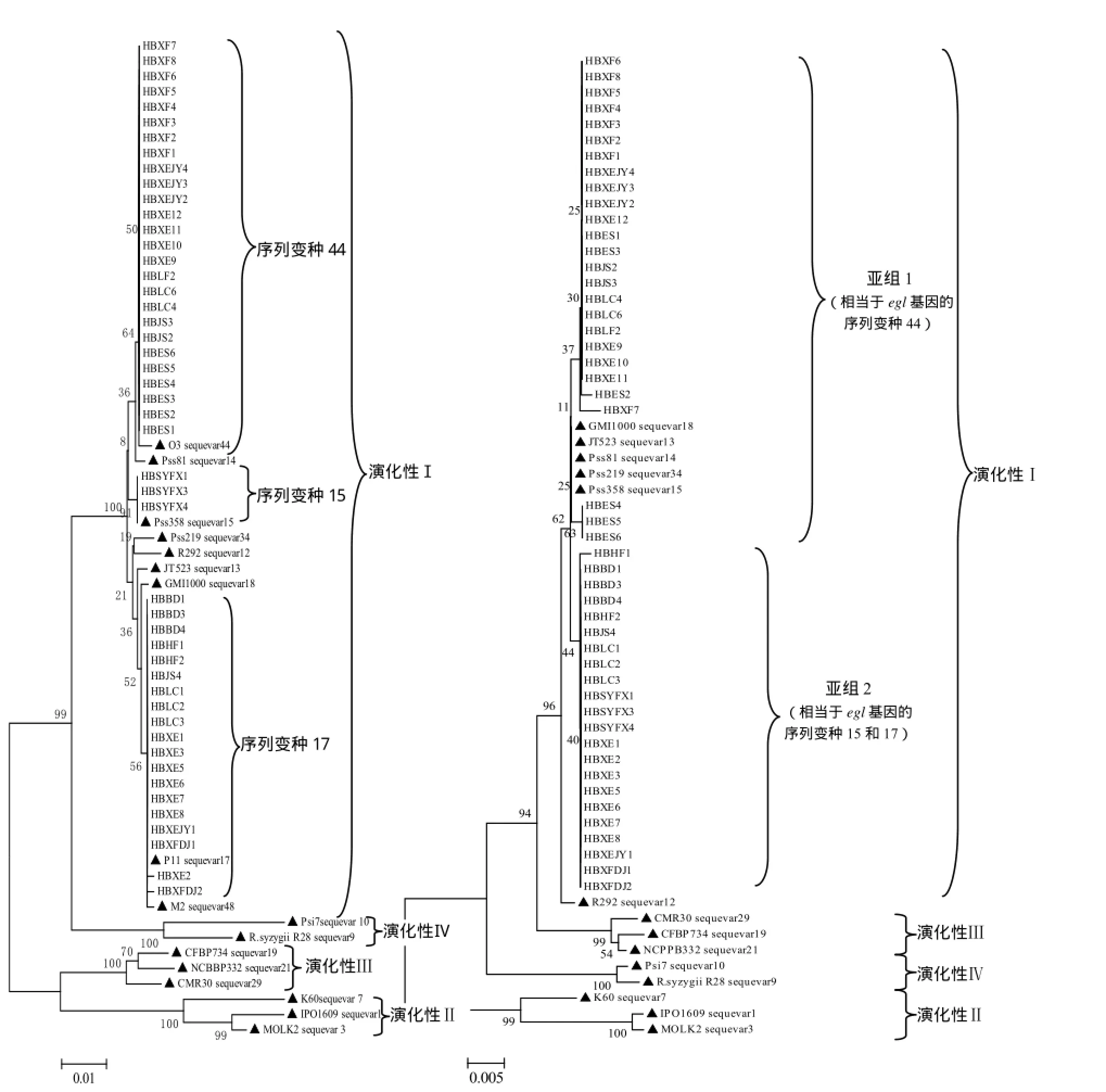
图1 基于青枯菌egl基因部分序列构建系统发育树图2基于mutS基因部分序列构建系统发育树Fig.1 Phylogenetic tree on partial sequences of Fig.2Phylogenetic tree on partial sequences of endoglucanase (egl) gene from Ralstonia solanacearummutSgene from Ralstonia solanacearum
3 讨论
青枯菌寄主范围广泛,能够侵染超过50个科的450种植物,不同地理来源的青枯菌在与其寄主长期演化过程中,表现出明显的生理分化和遗传多样性[12]。
烟草青枯病是美国东南部地区烟草生产上的主要病害,Hong等[17]基于Fegan和Prior提出的演化型分类框架,对该地区的烟草青枯菌进行了遗传多样性研究,结果表明,该地区烟草青枯菌属于美洲分支(演化性Ⅱ)的序列变种7。目前我国有22个植烟区,烟草青枯病在其中16个主要产烟区普遍发生,潘哲超等[13]采用演化型分类框架,首次对来自我国福建、贵州、广东和广西地区的烟草青枯菌进行了研究,结果表明,我国烟草青枯菌存在演化性Ⅰ的4个序列变种,即序列变种15,17,34和44,其中来源于福建的菌株属于序列变种34,而来源于贵州的菌株均属于序列变种17。在此基础上,本研究采用该分类框架,对分离自湖北省恩施和十堰烟区的48个烟草青枯菌,基于其egl基因的部分序列进行了系统发育分析和序列变种鉴定。鉴定结果表明,48个供试菌株全部属于演化性Ⅰ中的3个序列变种,即序列变种15、17和44,尚未发现在我国已报道的烟草青枯菌序列变种34。其中序列变种17和44无一例外全部来自恩施烟区,而且分离自同一县市不同乡镇的烟草青枯菌也可能分属于不同的序列变种,如宣恩县、咸丰县、利川市和建始县既存在烟草青枯菌序列变种17又有序列变种44,而分离自十堰烟区的菌株则均属于序列变种15。但由于本研究采集的菌株数目有限,因此,在湖北烟区除了序列变种15、17和44,是否还存在其他序列变种,十堰烟区除了序列变种15是否还有其他序列变种,还需进一步研究;而分布于我国的烟草青枯菌,除了已报到的4个序列变种,是否还存在其他序列变种,以及各序列变种与国内省份或地区之间的对应关系,也需要进一步的研究验证。另外,本研究还采用青枯菌mutS基因的部分序列对48个供试菌株进行了系统发育分析,结果表明,48个菌株被划分为亚洲分支下的2个亚组,其中亚组1相当于egl基因的序列变种44,包括26个菌株,其均来自于恩施烟区;而亚组2相当于egl基因的序列变种15和序列变种17,包括3个来源于十堰烟区和19个来源于恩施烟区的菌株。
4 结论
本研究采用Fegan和Prior提出的青枯菌演化型分类框架,对来源于湖北烟区的48个烟草青枯菌,进行了系统发育分析和序列变种鉴定。鉴定结果表明,分布于湖北烟区的烟草青枯菌属于3个序列变种,即序列变种15、17和44。其中序列变种17和44为优势变种,且均来源于恩施烟区;序列变种15均来源于十堰烟区。选育抗病品种是防治烟草青枯病的重要措施,但由于青枯菌群体高度适应性和极强的变异性,使得抗青枯病烟草品种的选育和利用变得更为复杂困难。因此,弄清湖北省烟草青枯菌的序列变种及其地理分布,有利于从现有的烟草品种中筛选出抗青枯病品种,为该省抗病品种合理布局服务。
参考文献
[1] Hayward AC. Biology and epidemiology of bacterial wiltcaused byPseudomonas solanacearum[J]. Annual Review of Phytopathology,1991, 29:65-87.
[2] 朱贤朝,王彦亭,王智发. 中国烟草病害[M]. 北京:中国农业出版社,2002.
[3]孔凡玉. 烟草青枯病的综合防治[J]. 烟草科技,2003(4):42-43.
[4]陈瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997,18(4):1-7.
[5]成巨龙,罗晶,邹航,等. 陕西烟草青枯病的发生与病原鉴定[J]. 中国烟草学报,2014,20(5):87-92.
[6]He L Y, SequeiraL, KelmanA. Characteristics ofstrains ofPseudomonas solanacearum[J]. Plant Disease, 1983,67:1357-1361.
[7]Hayward AC . Characteristics ofPseudomonas solanacearum[J].Journal ofApplied Bacteriology,1964,27:265-277.

中图分类号:S572.08
文章编号:1007-5119(2015)02-0081-06
DOI:10.13496/j.issn.1007-5119.2015.02.015
基金项目:中国烟草总公司湖北省公司重点项目(027Y2013-002)
作者简介:刘海龙,男,硕士生,从事植物细菌病害研究。E-mail:gsndliuhailong@126.com。*通信作者,E-mail:junbinhuang@mail.hzau.edu.cn
收稿日期:2015-01-05修回日期:2015-01-29
Phylogenetic Analysisof Tobacco Ralstonia solanacearum strains from Hubei Province
LIU Hailong1, LI Yanyan1,2, ZHENG Lu1, LI Xihong2, HUANG Junbin1*
(1. Key Laboratory of Plant Pathology of Hubei Province, College of Plant Science and Technology, Huazhong Agricultural University, Wuhan 430070, China; 2. Tobacco Research Academy of Hubei Province, Wuhan 430030, China)
Abstract:For further details physiological specialization of Ralstonia solanacearum strains isolated from Hubei Province,48R.solanacearum strains of tobacco were analyzed using the phylotype classification schemes. Phylogenetic analysis of endoglucanase gene(egl) and DNA mismatch repair protein gene(mutS) sequences showed that all isolates belonged to phylotypeⅠ,including 3 different sequevars15,17 and 44. 19 strains were belonged to sequevar 17 and 26 strains were belonged to sequevar 44,Only 3 strains were identified as sequevar15. R.solanacearum strains of tobacco from Hubei Province had genentic differentiation of sequevar level.
Keywords:tobacco; Ralstonia solanacearum; sequevar; egl; mutS

