冠心病患者外周血单核细胞PTX-3与血清MMP-9和hs-CRP的相关性研究
张卫,姚震,王天松,马丽辉,何喜民,马瑞莲
(三亚市人民医院药物临床试验机构1、心内科2、血液科3,海南三亚572000)
冠心病患者外周血单核细胞PTX-3与血清MMP-9和hs-CRP的相关性研究
张卫1,姚震2,王天松2,马丽辉3,何喜民2,马瑞莲2
(三亚市人民医院药物临床试验机构1、心内科2、血液科3,海南三亚572000)
目的探讨冠状动脉粥样硬化性心脏病(CHD)患者外周血单核细胞五聚蛋白-3(PTX-3)的表达及其与血清基质金属蛋白酶-9(MMP-9)、超敏C反应蛋白(hs-CRP)的相关性。方法选择CHD患者132例,其中不稳定型心绞痛(UAP)47例(UAP组),急性心肌梗死(AMI)43例(AMI组),稳定型心绞痛(SAP)42例(SAP组);另选同期相匹配的健康体检者33例作为对照组。采用酶联免疫吸附法(ELISA)分别测定各组受试者外周血单核细胞PTX-3及血清MMP-9水平,采用免疫比浊法测定hs-CRP水平,并采用pearson相关性分析法分析外周血单核细胞PTX-3、血清MMP-9水平及hs-CRP三者之间的相关性。结果UAP组和AMI组外周血单核细胞PTX-3和血清MMP-9、hs-CRP水平均高于SAP组和对照组,差异均具有统计学意义(P<0.05),且AMI组中3种炎症因子水平均高于UAP组,差异均具有统计学意义(P<0.05);SAP组与对照组3种炎症因子水平比较,差异均无统计学意义(P>0.05)。Pearson相关性分析显示,外周血单核细胞PTX-3与血清MMP-9、hs-CRP及血清MMP-9与hs-CRP之间呈正相关[r=0.427(P<0.01),0.244(P<0.05),0.197(P<0.05)]。结论CHD受试者和健康受试者外周血单核细胞均可检测出PTX-3的存在,并且随着病情凶险程度的增加PTX-3和MMP-9、hs-CRP的水平逐渐升高;3种炎症因子之间呈正相关性,3种炎症因子水平可以作为预测CHD严重程度的指标。
冠心病;单核细胞;五聚蛋白-3;基质金属蛋白-9;超敏C反应蛋白
冠状动脉粥样硬化性心脏病(Coronary heart disease,CHD)简称为冠心病,其发生、发展与冠状动脉粥样硬化(Atherosclerosis,AS)有很大关系。目前被学者们广泛接受的关于动脉粥样硬化的发病机制是Ross[1]的“炎症学说”。五聚蛋白-3(Pentraxin 3,PTX-3)与超敏C反应蛋白(High-sensitivity C reactive protein,hs-CRP)同属于五聚素家族。CRP是我们熟知的炎症因子,但是CRP可被多种非心脏相关的疾病触发,因此其特异性受到了质疑[2]。PTX-3已被证实参与多种心血管疾病的发生、发展,PTX-3可能从不同方面参与心血管疾病的发病机制[3]。炎症反应可使大量单核细胞/巨噬细胞聚集在斑块内,这些细胞分泌金属蛋白酶(Matrix metallo preteinases,MMPs),MMPs是溶解斑块的纤维成分,使得斑块的纤维帽变薄、易于破裂,最终导致血栓的形成。血清基质金属蛋白酶-9(Matrix metallo preteinases 9,MMP-9)作为MMPs的主要成员在不稳定斑块易发生破裂的肩部活性增加,致斑块的不稳定和急性心血管事件的发生[4]。本研究主要通过测定CHD患者外周血单核细胞PTX-3、血清MMP-9及hs-CRP的水平,探讨此3种炎症因子的相关性及其对CHD严重程度的预测作用。
1 资料与方法
1.1 一般资料连续入选我院2011-2013年经冠状动脉造影证实为CHD患者132例,年龄44~88岁。其中不稳定型心绞痛(Ustable angina pectoris,UAP)组47例,平均年龄(65.87±9.55)岁,男性22例,女性25例;急性心肌梗死(Acute myocardial infarction,AMI)组43例,平均年龄(61.84±12.45)岁,男性32例,女性11例;稳定型心绞痛(Stable angina pectoris, SAP)组42例,平均年龄(66.90±10.75)岁,男性23例,女性19例;选取同期条件相匹配的健康体检人员且经冠脉造影或冠脉CTA提示冠脉正常者33例作为健康对照组,年龄44~88岁,平均年龄(61.85±11.77)岁,男性18例,女性15例。UAP的诊断标准:入院前48 h内发生静息或自发性心绞痛发作至少一次,但无心肌坏死的心肌酶谱改变,同时伴心电图ST段压低或T波的改变。AMI的诊断标准:持续典型的胸痛30min以上,典型的心电图动态演变,心肌酶谱(肌酸激酶同工酶和肌钙蛋白)动态变化;具有以上任何两项即确诊。SAP诊断标准:胸痛发作程度、频度、性质及诱发因素在数周内无显著变化的患者。所有受试者均排除急、慢性炎症性疾病;严重外伤;自身免疫性疾病;恶性肿瘤和风湿性疾病者;先天性心脏病、瓣膜性心脏病、心肌病;肝肾功能不全;周围血管疾病或周围血管栓塞性疾病者;甲状腺疾病及血液病;妊娠、哺乳期患者;NYHA心功能Ⅳ级;以及排除入院前3个月内服用过任何他汀类降脂药或抗血小板类药物者。本研究课题经我院伦理委员会批准通过,并与入组人员及其家属签署知情同意书。
1.2 方法受试者发病8h内,禁食12h后(健康对照组亦禁食12 h),清晨空腹采肘静脉血8 ml,5 ml血样储存于经肝素抗凝试管中,3 ml储存于真空管中,将血样放低速离心机内,以2 000 r/min离心20 min,分别分离血清(真空管)及下层沉淀细胞(肝素抗凝),将血清吸出1 ml于EP管内,保存于-80℃冰箱,采用ELISA法测定血清MMP-9,免疫比浊发测定血清hs-CRP;下层沉淀于2 h内应用密度梯度离心法提取单核细胞,采用ELISA法测定外周血单核细胞PTX-3浓度(试剂盒均购自上海裕平生物科技有限公司)。
1.3 统计学方法应用SPSS18.0统计软件进行数据分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way,ANOVA),计数资料组间比较采用χ2检验,3种炎症因子之间的相关性采用Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料比较SAP组、UAP组和AMI组的年龄、性别、血糖、收缩压、舒张压、TC、TG、HDL-C、LDL-C分别与对照组进行比较,差异均无统计学意义(P>0.05),见表1。
表1 一般临床资料比较±s)
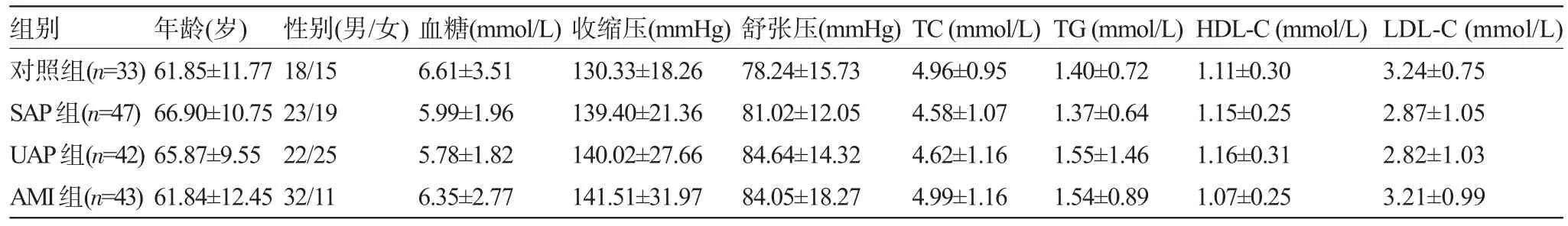
表1 一般临床资料比较±s)
注:1 mmHg=0.133 kPa。
组别对照组(n=33) SAP组(n=47) UAP组(n=42) AMI组(n=43)年龄(岁) 61.85±11.77 66.90±10.75 65.87±9.55 61.84±12.45性别(男/女) 18/15 23/19 22/25 32/11血糖(mmol/L) 6.61±3.51 5.99±1.96 5.78±1.82 6.35±2.77收缩压(mmHg) 130.33±18.26 139.40±21.36 140.02±27.66 141.51±31.97舒张压(mmHg) 78.24±15.73 81.02±12.05 84.64±14.32 84.05±18.27 TC(mmol/L) 4.96±0.95 4.58±1.07 4.62±1.16 4.99±1.16 TG(mmol/L) 1.40±0.72 1.37±0.64 1.55±1.46 1.54±0.89 HDL-C(mmol/L) 1.11±0.30 1.15±0.25 1.16±0.31 1.07±0.25 LDL-C(mmol/L) 3.24±0.75 2.87±1.05 2.82±1.03 3.21±0.99
2.2 炎症因子浓度测定结果UAP组、AMI组PTX-3、MMP-9、hs-CRP水平均高于SAP组和对照组,差异均有统计学意义(P<0.05);且AMI组中3种炎症因子水平均明显高于UAP组,差异均有统计学意义(P<0.01);SAP组和对照组3种炎症因子水平比较,差异均无统计学意义(P>0.05),见表2。
表23 种炎症因子水平比较(±s)

表23 种炎症因子水平比较(±s)
注:a与对照组比较,P<0.01;b与对照组比较,P<0.05;c与SAP组比较,P<0.01;d与SAP组比较,P<0.05;e与UAP组比较,P<0.01;f与UAP组比较,P<0.05。
组别对照组(n=33) SAP组(n=42) UAP组(n=47) AMI组(n=43) PTX-3(μg/L) 3.69±3.02 4.28±1.70 5.37±1.83ad8.32±2.79aceMMP-9(μg/L) 7.33±1.146 7.06±1.44 10.19±2.97ac11.23±3.28acfhs-CRP(mg/L) 2.44±1.98 3.63±3.11 12.48±8.47bd20.29±17.54ace
2.33 种炎症因子间的相关性分析3种炎症因子间的Pearson相关性分析显示,外周血单核细胞PTX-3与血清MMP-9、血清hs-CRP之间及MMP-9与hs-CRP之间均呈正相关,r值分别为0.427(P<0.01),0.244(P<0.05),0.197(P<0.05)。
3 讨论
五聚体结构蛋白20世纪末被发现,并依据相对分子质量的大小将该五聚体结构蛋白分为长链五聚体和短链五聚体[5-7]。既往人们研究的CRP和血清淀粉样蛋白A(Serum amyloid P-component,SPA)属于短链五聚体结构蛋白,PTX-3蛋白属长链五聚体蛋白。PTX-3是由包括17个氨基酸信号肽在内的381个氨基酸残基组成,分子量约为40 165 kD,且表观分子量相当于十聚体。人PTX-3基因位于第三号染色体q25区,该基因含有三个外显子,第一个外显子含有197个核苷酸,第二个外显子覆盖198~599位核苷酸,第三个外显子从第600位核苷酸直到3'末端。PTX-3蛋白包含一个N末端区域(含178个氨基酸残疾)和一个C-末端(含有203个氨基酸残基),PTX-3之所以较CRP和SAP长主要在于它的NH2的终点部分[8]。PTX-3不同于短链五聚体主要在于基因结构、染色体位置、细胞来源、刺激来源及识别配体[9]。PTX-3基因较CRP基因稳定,在动物与人属进化过程中几乎无变化[10]。PTX-3为可溶性模式识别受体,它在先天性免疫反应中具有重要作用,与机体免疫功能、感染性疾病和CHD等密切相关[11]。
ACS发生的病理学基础主要是因为斑块的破裂和附壁血栓的动态变化,多项研究证实该变化与多种炎性因子相关,其导致单核细胞和巨噬细胞聚集在斑块内,这些细胞可溶解斑块的纤维成分,使斑块的纤维帽变薄,斑块易于破裂,最终导致血栓的形成,发生心血管事件。从生物力学角度来看,斑块纤维帽承受最大的应力作用,使血液与斑块中强致血栓形成的脂核分隔。因此,纤维帽的厚度、强度及胶原组织含量的多少对防止斑块破裂十分重要。胶原是细胞外基质(Extracellular matrix,ECM)的主要成分,ECM又是纤维帽的主要组成,MMPs在动脉粥样硬化斑块脂核边缘和肩部高表达,使该部位的ECM降解大于合成,促使斑块破裂。MMP-9作为MMPs的主要成员在不稳定斑块易发生破裂的肩部活性增加,致斑块的不稳定和ACS的发生[4]。Inokubo等[12]发现ACS比SAP和对照组的主动脉内及冠状动脉循环内的血浆MMP-9水平明显增高。Kai等[13]对ACS与正常对照的研究亦发现ACS患者外周血中MMP-9的水平明显增高。这些研究均提示MMP-9与斑块的不稳定性有关。本研究提示AMI、UAP组患者单核细胞PTX-3与血清MMP-9水平明显高于SAP组和对照组,提示单核细胞PTX-3可能参与了ACS发病机制。
研究已证实血清hs-CRP水平可作为预测ACS危险分层的参考指标之一[14]。炎症导致的冠状动脉粥样硬化斑块不稳定是诱发急性冠脉综合征的重要因素。hs-CRP水平可反应粥样硬化斑块不稳定性,与ACS的发生和发展密切相关[15]。Kostner等[16]研究证实,在动脉壁粥样硬化过程中存在单核细胞/巨噬细胞的大量浸润,若渗入斑块表面,可使斑块不稳定而破裂,而炎症细胞分泌的细胞因子可引起hs-CRP增加。我们的研究结果亦显示CHD患者随着病情凶险程度的增加单核细胞PTX-3和hs-CRP的水平是逐渐升高的,且二者之间呈正相关性,提示在炎症反应中单核细胞PTX-3和hs-CRP存在某种联系,其反应机制需进一步研究证实。故检测CHD患者外周血额单核细胞PTX-3、血清hs-CRP及MMP-9水平均有助于预测CHD病情严重程度,对ACS的临床诊治具有重要意义。
[1]Ross R.Atherosclerosis-an inflammatory disease[J].N Eng J Med, 1999,340(2)∶115-126.
[2]Bassi N,ZampieS,GhirardelloA,et al.Pentraxins,anti-pentraxin antibodies,and atherosclerosis[J].Clin Rev Allergy Immunol,2009, 37(1)∶36-43.
[3]贺兆发,马显华,金梅花,等.冠心病患者血浆正五聚蛋白-3、血清超敏C-反应蛋白与血脂的相关性[J].心血管康复医学杂志, 2010,19(2)∶145-147
[4]Matsui S,Ishii J,Kitagawa F,et a1.Pentraxin3 in unstable angina and non-ST-segment elevation myocardial infarction[J].Atherosclerosis,2010,210(1)∶220-225.
[5]Breviario F,d'Aniello EM,Golay J,et a1.Interleukin-1-inducible genes in endothelial cells.cloning of a new gene related to C-reactive protein and serum amyloid P component[J].J Biol Chem, 1992,267(31)∶22190-22197.
[6]Montovani A,Garlanda C,Otero K,et al.Membrane and soluble pattern recognition receptors∶unique functions of the long pentraxin PTX3[J].Clin ExpAll Rev,2004,2(4)∶S150-154.
[7]秦海斌,刘启明,印茂峰,等.长正五聚蛋白-3与高敏C反应蛋白在急性冠脉综合征得变化及意义[J].临床心血管病杂志,2011,27 (7)∶491-493.
[8]Introna M,Alles VV,Castellano M,et al.Cloning of mouse ptx3,a new member of the pentraxin gene family expressed at extrahepatic sites[J].Blood,1996,87(5)∶1862-1872.
[9]马彩娜.血浆PTX3与冠心病的相关性研究[D].延安∶延安大学, 2013.
[10]Bottazzi B,Garlanda C,Cotena A,et al,The long pentraxinPTX3 as aprototypic humoral pattern recognition receptor∶interplay with cellular innate immunity[J].Immunol Rev,2009,227(1)∶9-18.
[11]谢京,张静波,正五聚蛋白3在炎症及自身免疫中的作用[J].中国病理生理学杂志,2013,29(4)∶752-756.
[12]Inokubo Y,Hanada H,Ishizaka H,et al.Plasma levels of matrix metalloproteinase 9 and tissue inhibitor of metalloproteinase 1 are increased in the coronary circulation in patients with acute coronary syndrome[J].Am Heart J,2001,141(2)∶211-217.
[13]Kai H,Ikeda H,Yasukawa H,et al.Peripheral blood levels of matrix metalloprotienases-2 and matrix metalloprotienases-9 are elevated in patients with acute coronary sydromes[J].J Am Coll Cardial,1998,32(2)∶368-372.
[14]金纪伟,葛冰磊,方利红,等.超敏C反应蛋白在急性冠脉综合征中的临床意义[J].国际检验医学杂志,2012,33(18)∶2285-2286.
[15]童廉琦,张荣林.超敏C反应蛋白水平与急性冠脉综合征关系的新进展[J].心脏杂志,2010,2(2)∶289-292,301.
[16]Kostner KM,Fathi B,Case C,et al.Inflammation,complement activation and endothelial function in stable and unstable coronary artery disease[J].Clinica ChimicaActa,2006,365(12)∶129-134.
Correlation between peripheral blood mononuclear cell PTX-3 and serum MMP-9 and hs-CRP in patients with coronary heart disease.
ZHANG Wei1,YAO Zhen2,WANG Tian-song2,MA Li-hui3,HE Xi-min2,MA Rui-lian2. Drug Clinical Trial Institution1,Department of Cardiology2,Department of Hematology3,the People's Hospital of Sanya, Sanya 572000,Hainan,CHINA
ObjectiveTo observe the levels of peripheral blood mononuclear cell(PBMC)Pentraxin 3 (PTX-3)expression,and to study the relationship among PBMC PTX-3 expression levels,serum matrix metallo preteinases 9(MMP-9)and serum high-sensitivity C-reactive protein(hs-CRP)levels in the patients with coronary heart disease.MethodsA total of 132 patients of CHD were selected as experimental group,including 47 cases of unstable angina pectioris(UAP group),42 cases of stable angina pectoris(SAP group)and 43 cases of acute myocardial infarction (AMI group).Besides,33 healthy individuals for physical examination were selected as the healthy control group.The levels of peripheral blood mononuclear cells PTX-3 and serum MMP-9 were detected by ELISA.The levels of serum hs-CRP were detected by immunoturbidimetric assay.The correlations of the three were analyzed by using pearson correlation analysis.ResultsThe levels of PBMC PTX-3,serum MMP-9 and serum hs-CRP in UAP group and AMI group were significantly higher than SAP group and control group(P<0.05).The levels of PBMC PTX-3,serum MMP-9 and serum hs-CRP in AMI group were significantly higher than those in UAP group(P<0.05).PBMC PTX-3, serum MMP-9 and serum hs-CRP in SAP group and control group showed no statistically significant difference(P>0.05).There were positive correlations of PBMC PTX-3 with serum MMP-9,serum hs-CRP and serum MMP-9 with hs-CRP(r=0.427,P<0.01;r=0.244,P<0.05;r=0.197,P<0.05,respectively).ConclusionThe levels of PBMCPTX-3, serum MMP-9 and serum hs-CRP increased as the deterioration of the disease.There is a positive correlation between the three kinds of inflammatory factors,and their levels can be used as a prediction index for the severity of CHD.
Coronary heart disease(CHD);Mononuclear cell;Pentraxin 3(PTX-3);Matrix metallo preteinases 9(MMP-9);High-sensitivity C reactive protein(hs-CRP)
R541.4
A
1003—6350(2015)12—1725—04
2014-11-18)
海南省卫生厅2013年度医学科研资助课题(编号:琼卫2013资助-018号)
马瑞莲。E-mail:carrie1644@126.com
doi∶10.3969/j.issn.1003-6350.2015.12.0619

