基于响应曲面法的芦荟大黄素制备工艺研究
钟桂芳,樊 攀,毛多斌
(1.郑州轻工业学院,河南郑州450002;2.江苏九旭药业有限公司,江苏徐州221200)
芦荟的主要活性成分是芦荟大黄素,该成分具有抗肿瘤、抗菌、免疫抑制和泻下作用,还具有降脂减肥和去屑光泽头发等功效[1]。该化合物是制备治疗关节炎药物双醋瑞因的重要原料[2]。芦荟苷是C-C糖苷键,非常稳定,是所有糖苷键中最难水解的,这一特性制约了芦荟苷转化为芦荟大黄素,成为世界性难题。国际上通常采用化学法来断裂该键,这些方法的缺陷是使用了金属试剂,或其他有害或有毒物质,并且需要复杂的纯化工艺,以去除上述的残留物[3-6]。
河南省为芦荟种植大省,但目前芦荟加工产品依然停留在芦荟原汁和干粉上,产品的附加值较低。本研究采用生物酶法有效地水解芦荟苷C-C糖苷键,制备芦荟大黄素,为芦荟大黄素的大规模的生物法制备奠定基础。
1 试验材料与方法
1.1 试验材料
芦荟苷及芦荟大黄素标准品,购买自SIGMA公司;芦荟大黄素样品1mg实验室制备;葡萄糖苷酶,郑州轻工业学院生物催化与转化实验室制备;Waters高效液相色谱系统;XTerra MS C18色谱柱(4.6 mm×250 mm,5 μm);Waters 1525型紫外检测器;Waters 2487型高压恒流泵;检测波长254 nm;流动相:V(甲醇)∶V(0.1%乙酸水溶液)=80∶20;进样量10 μL;流速:0.8 mL·min-1;柱温:30 ℃。
1.2 试验方法
1.2.1 芦荟大黄素标准曲线 精确称取芦荟大黄素标准品50.0 mg,加入适量乙酸乙酯,超声10 min促使溶解,冷却后,以甲醇定容至50 mL,配制成1 g·L-1的标准溶液。然后配制成质量浓度分别为0.1、0.2、0.4、0.6、0.8 g·L-1的梯度标准溶液。
1.2.2 重组葡萄糖糖苷酶水解芦荟苷合成芦荟大黄素 称取芦荟苷5 g,放入500 mL圆底烧瓶内,依次加入65 mL醋酸缓冲液(20 mmol·L-1,pH值5.2),30 mL叔丁醇和5 mL重组葡萄糖苷酶粗酶液,在50℃、150 r·min-1条件下反应4 h。反应液经用HPLC和TLC检测。芦荟大黄素转化率计算公式如下:
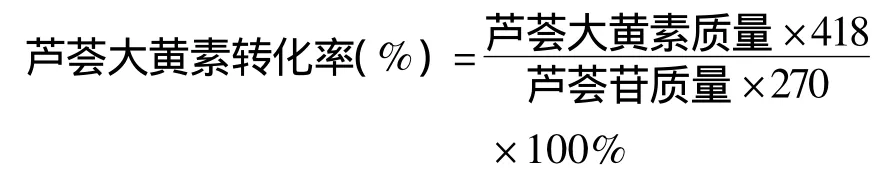
1.2.3 芦荟大黄素的分离纯化 反应液在60℃条件下真空干燥,经索氏提取后,5℃放置结晶,抽滤后,滤饼以10 mL甲苯洗涤2次,该洗涤液60℃真空干燥得芦荟大黄素粗品。将浓缩的芦荟大黄素甲苯溶液加入硅胶柱中,乙酸乙酯洗脱。将含有芦荟大黄素的洗脱液合并后,减压浓缩得棕黄色的残渣。用薄层层析和高效液相色谱等检测芦荟大黄素纯度。
1.2.4 各试验因素对芦荟大黄素转化的影响 根据芦荟大黄素的合成方法,分别在 1、2、4、6、8、10、12 h时间取样检测,考察反应时间对芦荟大黄素转化的影响;调整加酶量,分别在体积酶活性为40、45、50、55、60 U·mL-1条件下进行合成试验,考察体积酶活性对芦荟大黄素转化的影响;调整底物质量浓度,分别在芦荟苷质量浓度为50、75、100、125、150 g·L-1时合成试验,考察芦荟苷质量浓度对芦荟大黄素转化的影响;考察叔丁醇与水的体积比对芦荟大黄素转化的影响,分别在叔丁醇和水的体积比为 1∶9、3∶7、5∶5、7∶3、9∶1 条件下进行合成试验;考察反应温度对芦荟大黄素转化的影响,分别在30、40、50、60、70 ℃等下进行合成试验;考察pH值对芦荟大黄素转化的影响,分别在pH值为 3.6、4.2、5.2、6.2、7.2、8.0 时进行试验。
1.2.5 响应曲面试验 根据单因素试验结果,采用Box-Behnken模型,以芦荟大黄素的质量百分浓度为响应值,以反应时间(X1)、叔丁醇体积分数(X2)、反应温度(X3)作为影响类芦荟大黄素合成的主要因素,通过响应面分析进行进一步优化,水平编码见表1。

表1 因素水平表Table 1 Factors and levels
2 结果与分析
2.1 反应时间对芦荟大黄素合成的影响
由图1可知,反应时间对芦荟大黄素的合成有很大影响。在前4 h内,随着时间的延长,芦荟大黄素转化率呈增加的趋势,最高转化率达84.58%;当反应时间超过4 h之后,芦荟大黄素转化率基本维持在80%左右。因此,为保证芦荟大黄素的产量和工作效率,选择4 h作为最适反应时间。
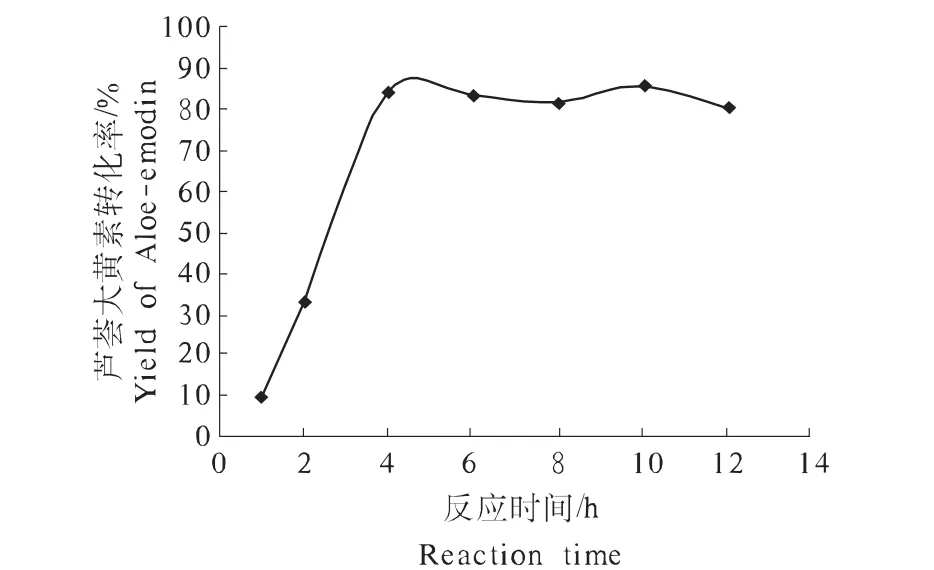
图1 反应时间对芦荟大黄素合成的影响Fig.1 Effects of reaction time on the synthesize of Aloe-emodin
2.2 酶浓度对芦荟大黄素合成的影响
由图2可知,在一定范围内,芦荟大黄素转化率与重组葡萄糖苷酶体积酶活性呈正相关关系。随着体积酶活性的增加,芦荟大黄素转化率不断增大,芦荟大黄素的最大转化率为86.21%,当体积酶活性大于50 U·mL-1时,芦荟大黄素转化率变化不大。
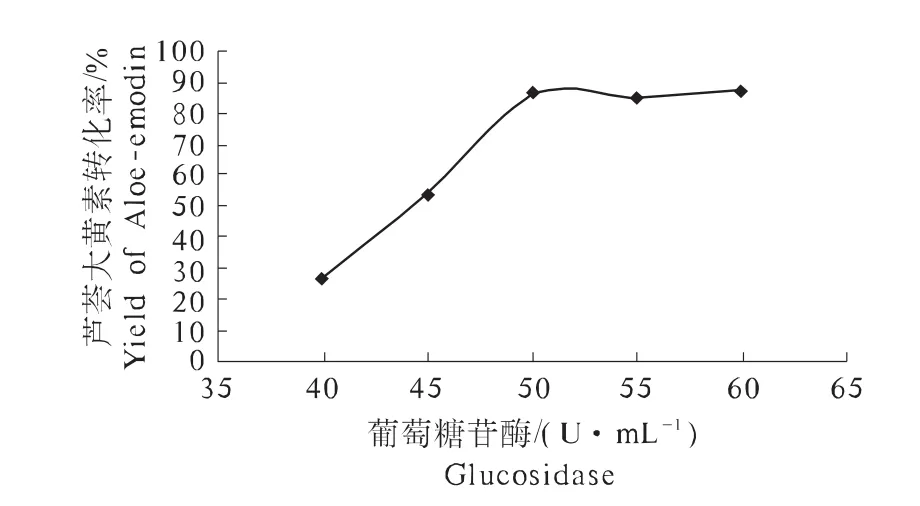
图2 酶浓度对芦荟大黄素合成的影响Fig.2 Effects of enzyme's concentration on the synthesize of Aloe-emodin
2.3 芦荟苷质量浓度对芦荟大黄素合成的影响
由图3可知,当芦荟苷质量浓度较低时,即低于100 g·L-1时,芦荟大黄素转化率变化不大,基本在80%左右。芦荟苷在低质量浓度下,芦荟大黄素转化率较高,这是由于底物浓度低,葡萄糖苷酶水解速率较快,所以转化率偏高;当芦荟苷质量浓度高于100 g·L-1时,芦荟大黄素转化率迅速下降,由于葡萄糖苷酶的量有限,且达到最大水解速率,底物虽然增加,但芦荟大黄素的产量不会随之增加,因此呈下降趋势。考虑到实际生产意义,选择芦荟苷质量浓度为100 g·L-1作为最适底物质量浓度。
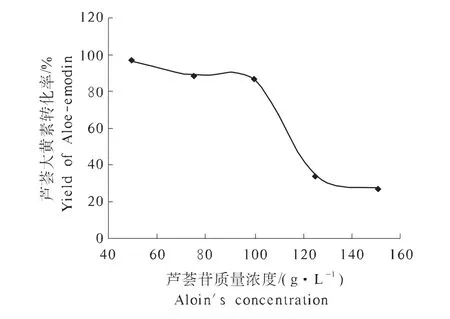
图3 芦荟苷质量浓度对芦荟大黄素合成的影响Fig.3 Effects of Aloin's concentration on the synthesize of Aloe-emodin
2.4 叔丁醇与水的体积比对芦荟大黄素合成的影响
由图4可知,叔丁醇对葡萄糖苷酶水解芦荟苷影响较大,可能是由于叔丁醇和水以一定比例混合时,芦荟苷的溶解性较好,有利于芦荟苷的水解。当V(叔丁醇)∶V(水)=5∶5时,芦荟大黄素转化率最高,为84.09%。当叔丁醇含量降低时,由于芦荟苷溶解度下降,芦荟大黄素转化率降低;当叔丁醇含量较高时,叔丁醇会影响葡萄糖苷酶活力,使其活力降低,导致芦荟大黄素转化率降低。
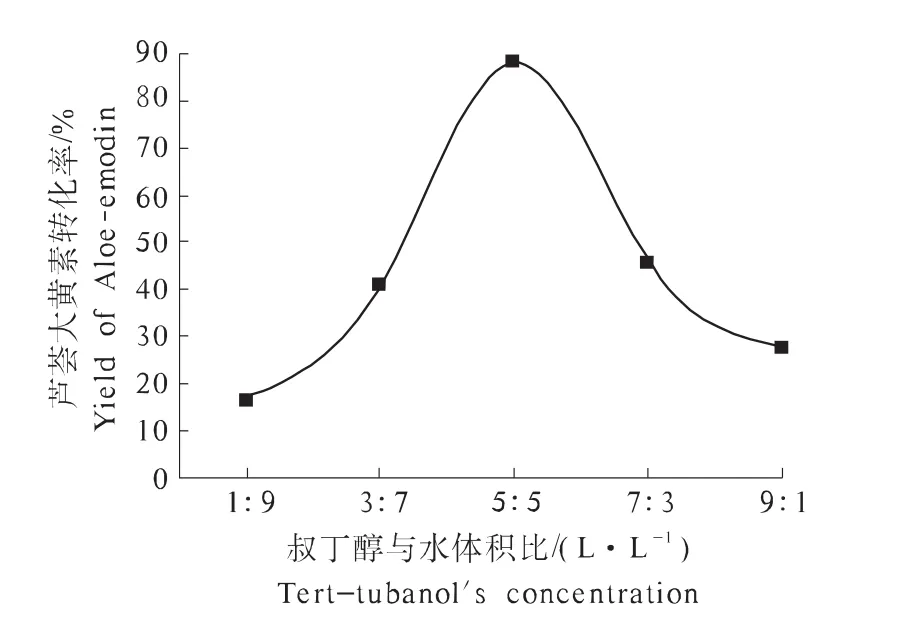
图4 叔丁醇浓度对芦荟大黄素合成的影响Fig.4 Effects of tert-butanol's concentration on the synthesize of Aloe-emodin
2.5 温度对芦荟大黄素合成的影响
由图5可知,在一定范围内,当反应温度低于50℃时,芦荟大黄素转化率随着温度的增高而增大。反应温度为50℃时,芦荟大黄素转化率最大,为85.78%,当反应温度大于50℃时,芦荟大黄素转化率迅速降低。可能的原因是,一方面,由于反应温度较高,酶蛋白发生变性,导致酶活力丧失,影响芦荟苷的水解,从而使芦荟大黄素转化率下降。
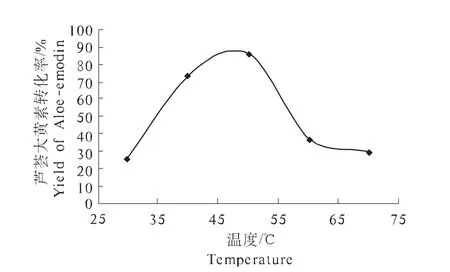
图5 温度对芦荟大黄素合成的影响Fig.5 Effects of reaction temperature on the synthesize of Aloe-emodin
2.6 pH值对芦荟大黄素合成的影响
由图6可知,当 pH 值在3.6~5.2,芦荟大黄素转化率逐渐增大,说明该葡萄糖苷酶不耐酸,在强酸条件下,该酶蛋白发生变性,致使芦荟大黄素转化率较低;当pH值为5.2时,芦荟大黄素转化率最大,为 85.08%,当 pH 值在 5.2 ~8.0,芦荟大黄素转化率变化不大,说明该重组葡萄糖苷酶适宜在弱酸和弱碱性条件下反应,具有广泛的pH值适应性。

图6 pH值对芦荟大黄素合成的影响Fig.6 Effects of pH on the synthesis of Aloe-emodin
2.7 响应曲面试验
利用Design Expert 7.1软件对试验因素和水平进行设计,并通过试验得到各自的芦荟大黄素转化率,结果如表2。通过Design Expert 7.1软件进行回归分析,得到芦荟大黄素转化率和各影响因素之间的回归方程。拟合后得到反应时间(X1)、叔丁醇与水的体积比(X2)、反应温度(X3)的二次回归模型为:
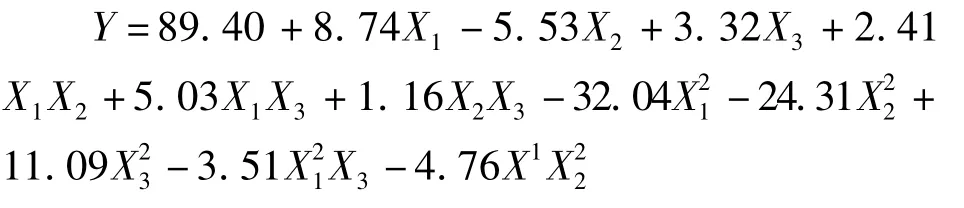
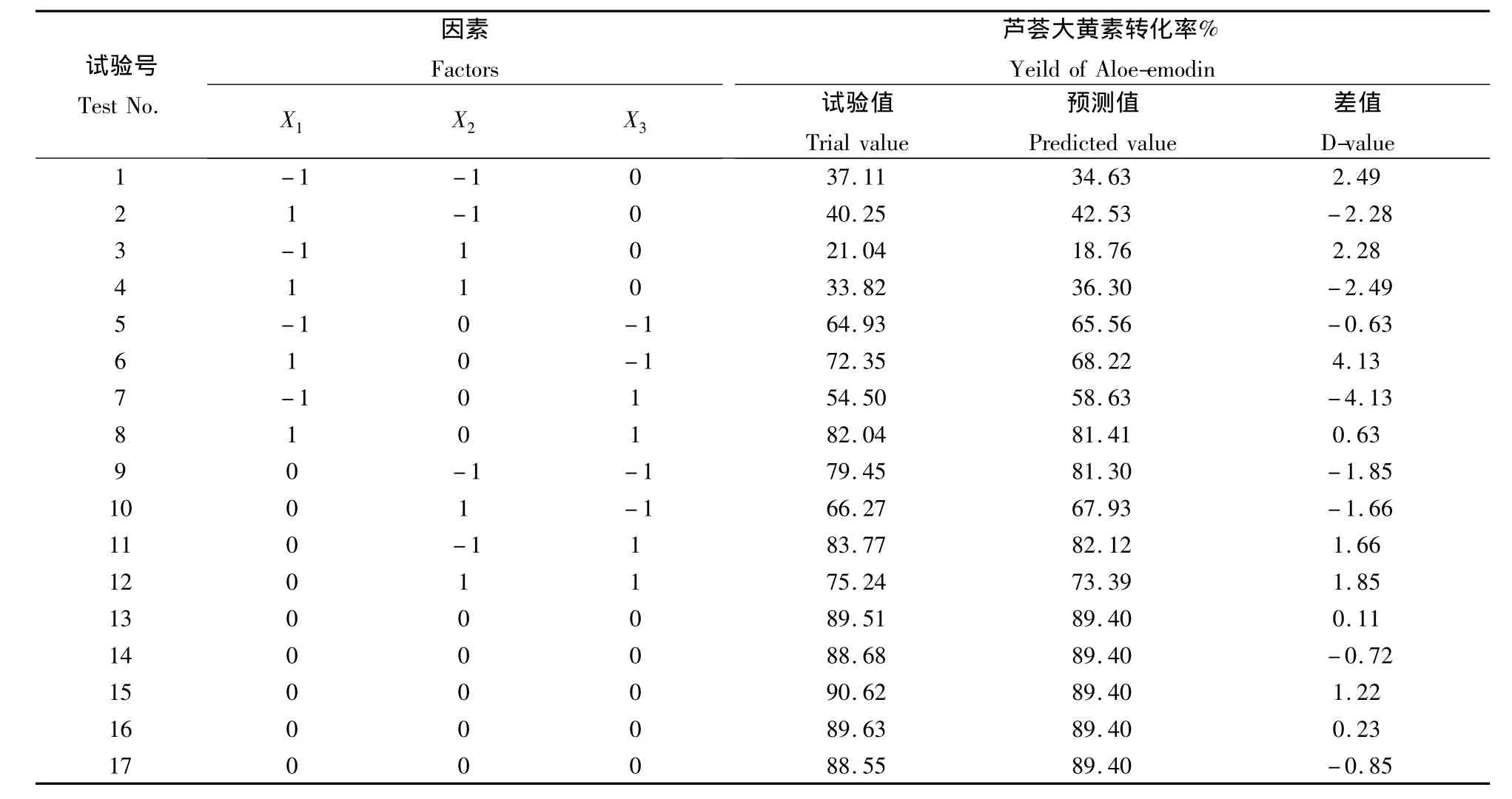
表2 响应面设计方案与试验结果Table 2 The design of response surface methodology and the results of test
由试验因素与水平设计,共进行了17次试验,可分为析因子和零点,其中析因子共有12个,零点为区域中心,共有5个,用来估计试验误差。
由回归分析方差表3可知,模型决定系数R2为0.999 6,F 值为1 302.38(P <0.000 1),说明此模型极显著,反应时间(X1)、叔丁醇与水的体积比(X2)、反应温度(X3)对芦荟苷水解效应显著。Lack of Fit值为0.11,即方程拟合度很高。信噪比Adeq Precision的值很高(为107.19),即该模型可用于预测,说明回归方程可以较好地描述各因素与响应值之间的真实关系,可以利用该回归方程确定最佳糖苷合成条件。CV值 (即Y的变异系数)表示试验的精确度,CV值越高,则试验的可靠性越低,本试验中CV值为1.11%,比较低,表明试验操作可靠。因此,该回归方程可确定芦荟大黄素的最佳合成工艺条件。回归模型方差分析(表4)中一次项 X1,X2,X3,二次项和交互项 X1X2,对模型均影响显著,说明各因素对糖苷合成不是简单的线性关系。
由回归方程可分别得出反应时间(X1)、叔丁醇浓度(X2)、反应温度(X3)3因素与芦荟大黄素转化率之间的响应面图,如图7所示。由图7可知反应时间(X1)、叔丁醇与水体积比(X2)对芦荟大黄素的合成影响较显著,且各因素之间交互作用明显,与方差分析结果一致。
运用Design Expert 7.1软件,通过回归方程得到芦荟大黄素最佳合成工艺条件是:反应时间为4 h,V(叔丁醇)∶V(水)=3.5∶6.5,反应温度为 43℃,芦荟大黄素转化率90.80%。
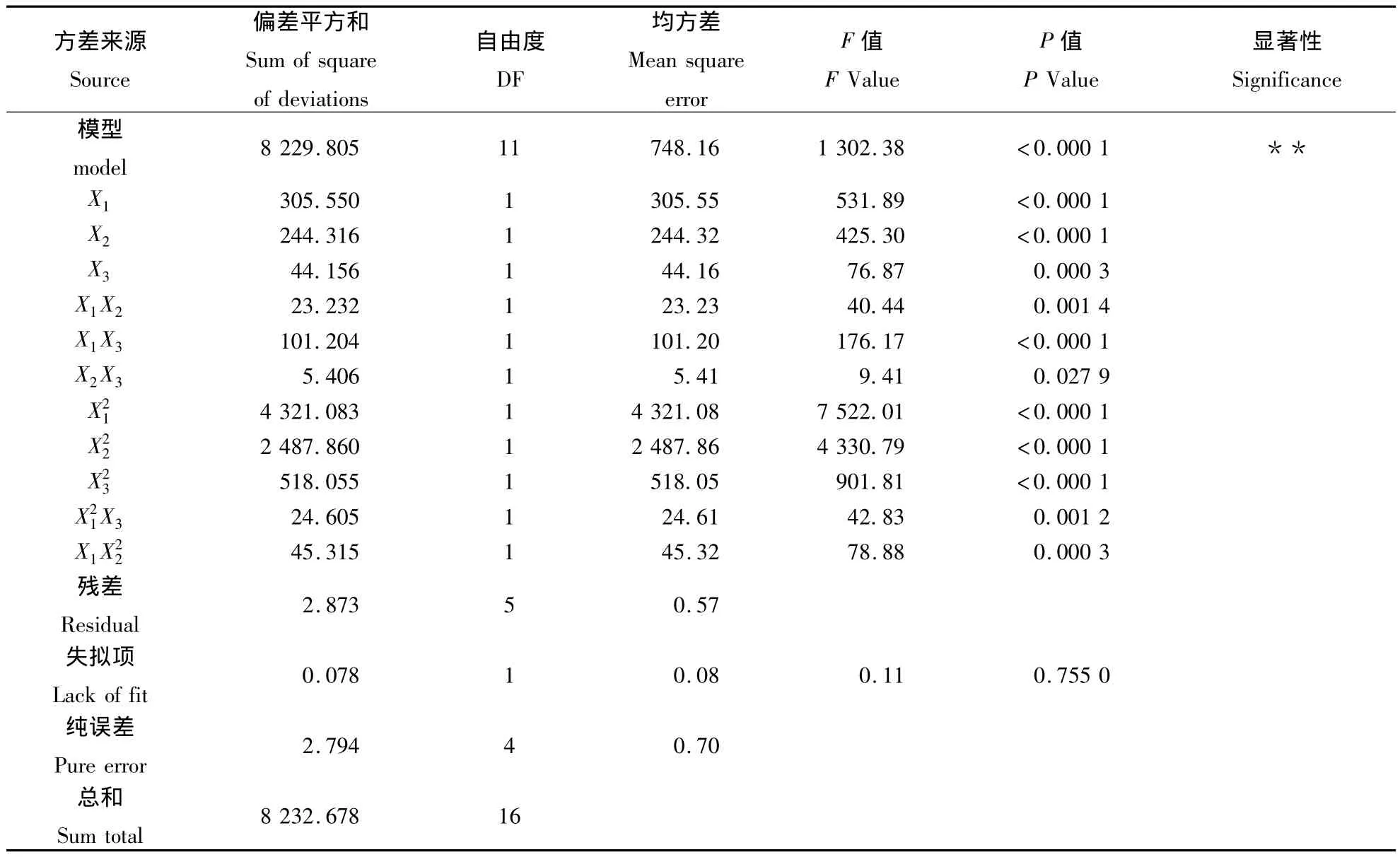
表3 回归模型方差分析Table 3 Regression analysis of variance
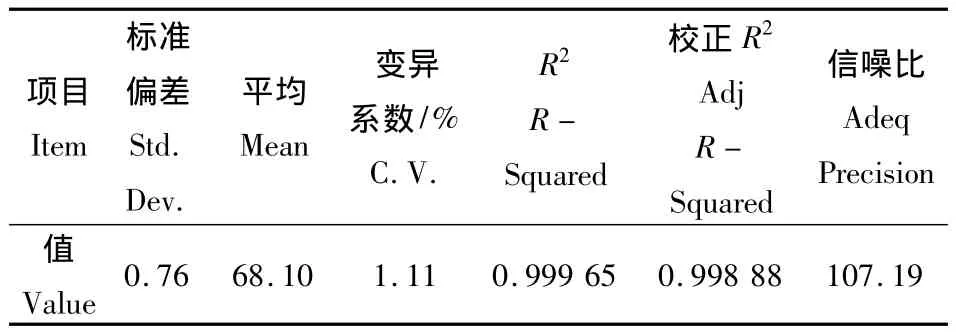
表4 回归分析方差表Table 4 Table of regression analysis of variance
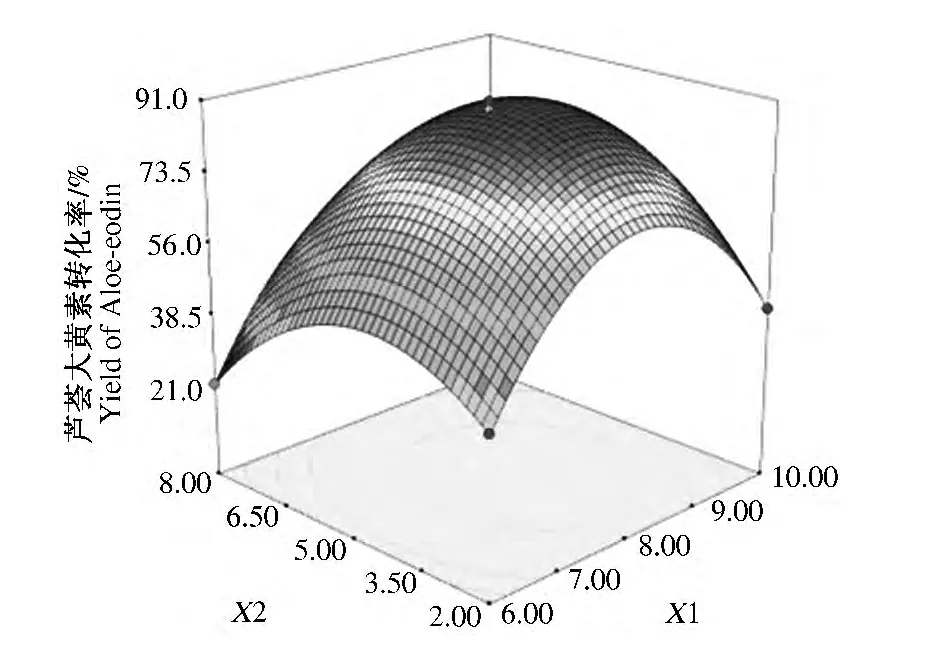
图7 反应时间和叔丁醇与水体积比对芦荟大黄素转化率的影响Fig.7 The interaction effection of reaction time tert-butanol’s concentration
3 验证试验及其结果
称取芦荟苷10 g放入500 mL圆底烧瓶内,依次加65 mL乙酸缓冲液(20 mmol·L-1,pH值5.2),35 mL叔丁醇和5 mL β-葡萄糖苷酶粗酶液(50 μ·mL-1),在 43 ℃,100 r·min-1条件下反应4 h,重复2次。反应结束后,经高效液相色谱法测得芦荟大黄素转化率分别为89.06%,89.42%,91.63%。3次试验的芦荟大黄素平均值为90.04%,与理论值90.80%相差0.6%。因此,该模型能较好地反映芦荟大黄素最佳合成工艺条件,从而证明了响应面分析设计方法在确定芦荟大黄素最佳合成工艺条件的可行性。
4 结论
本研究采用响应曲面法分析了β-葡萄糖苷酶催化合成芦荟大黄素的工艺。通过分析及试验证明,当叔丁醇与水的体积比为3.5∶6.5,β-葡萄糖苷酶的体积酶活性为50 μ·mL-1,在43℃,100 r·min-1条件下反应 4 h,芦荟大黄素的得率为90.04%。
[1] 廖志华,谈 锋.芦荟的药理作用[J].国外医药:植物药分册,1999,14(4):184-185.
[2] 国家药典委员会.中华人民共和国药典[M].北京:化学工业从出版社,2000:129.
[3] VITTORI N,COLLINS M.Production of rhein and rhein derivatives:US,5652265[p].1997
[4] CARLINO,STEFANO,DI NAPOLI et al.Process for preparing aloe-emodin:US,7453004[p].2005
[5] S.卡里诺,G.迪纳伯利.制备芦荟大黄素的方法:CN,101104583A[p].2007
[6] 李建生,梁生旺,郑晓珂,等.大黄素、芦荟大黄素提取方法及其应用:CN,1887837[P].2007

