太行山南段刺槐林地土壤酶活性季节变化特征
田丽青,王风芹,付晨青,宋安东,张劲松,高 俊,桑玉强
(1.河南农业大学生命科学学院,农业部农业微生物酶工程重点实验室,河南郑州450002;2.中国林业科学研究院林业研究所,国家林业局林木培育重点实验室,北京100091;3.河南农业大学林学院,河南 郑州450002)
土壤酶主要来源于土壤中植物根系及其残体、土壤动物及其遗骸与微生物[1],土壤酶活性与土壤中潜在养分和土壤胶体吸附性离子的有效程度高度相关,而后者又与土壤的供肥能力息息相关[2]。有研究表明[3-6],不同的植被恢复模式均可显著或极显著提高土壤酶活性,因此土壤酶可作为评判不同植被对土壤生物活性恢复效果的重要依据。
太行山南段作为中国林业生态建设的重点区域,因强烈的人为干扰,严重的水土流失,致使该区生态环境日趋恶劣,裸山现象十分严重,加上该区是石质山区,土壤肥力不佳,故而人地矛盾尖锐、土地退化严重,已成为困扰该区可持续发展的主要因素。据统计,该区主要的退耕还林树种是刺槐,栓皮栎和构树等其它树种,有研究表明[7-8],在众多的植被恢复模式中,以刺槐林的生态效应最为明显,因而它对土壤的改良效果将直接影响该区生态建设的好坏。此外,由于植物的季节性生长以及大量枯枝落叶等物质的季节性回归,使得土壤酶活性的变化规律也存在着较大的季节性差异[9]。本研究以农田为对照,研究了太行山南段退耕还林刺槐林地土壤酶活性的季节变化规律及其影响因素,以期揭示该区退耕还林刺槐林地生态恢复的生物学机制,并为该区退耕还林工程顺利实施提供重要的建设依据。
1 研究区概况与研究方法
1.1 研究区概况
试验地位于黄河小浪底森林生态系统定位研究站(35°01'N,112°28'E)内。该站隶属于中国森林生态系统定位研究网络(CFERN),地处河南省济源市境内的太行山南段与黄河流域的交接处,定位站中心地区海拔410 m。属暖温带大陆性季风气候,年均气温12.4 ~14.3 ℃,年日照时数2 367.7 h,年均降水量641.7 mm,年平均蒸发量为1 611.2 mm,无霜期历年平均213.2 d,试验区林分以人工林为主,刺槐为代表性树种之一。本研究选取的样地均为半阳坡中部的退耕还林地,土壤以石灰岩风化母质淋溶性褐土为主,土层厚度为50~80 cm,因原是农田,石砾含量很少,样地基本情况见表1。其中,农田四季轮作作物为小麦-绿豆;刺槐树龄分别是10 a和43 a。
1.2 土样采集
分别从农田(Farm Land,FL),10 a刺槐(R.pseudoacacia 10 a,RP10)和43 a刺槐(R.pseudoacacia 43 a,RP43)3种样地取样,每种样地设置3个样方作为重复,每个样方面积为100 m2。每个样方按S型布设9个样点,使所选样点具有典型性、代表性和一致性。每个样点挖取土壤剖面0~5 cm土层,自上而下分别取等量的土壤混合均匀,剔除石砾,植物残根等,迅速带回实验室过孔径为2 mm筛后4℃冰箱保存备用。于2012年的春(3月)、夏(7月)、秋(10月)、冬(12月)四季取样,共4次。取样时天气晴朗,取样前几天也均无雨或雪。
1.3 土壤酶活性测定
1.3.1 纤维素酶 纤维素酶活性的测定采用硝基水杨酸比色法,以10 g土样在37℃和pH值5.5条件下,4 d水解羧甲基纤维素产生1 mg葡萄糖为1 个酶活力单位,用 mg·g-1·d-1表示[10]。
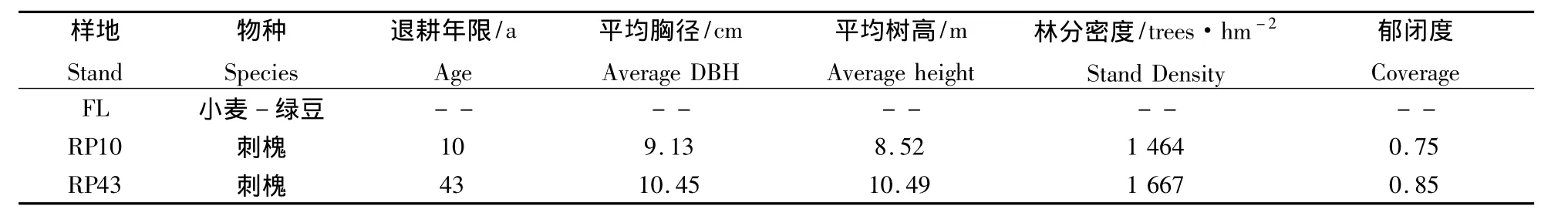
表1 样地基本情况Table 1 The basic status of measured plots
1.3.2 蔗糖酶 蔗糖酶活性的测定采用3,5-二硝基水杨酸比色法,以1 g土样在37℃和pH值5.5条件下,24 h水解蔗糖产生1 mg葡萄糖为1个酶活力单位,用 mg·g-1·d-1表示[10]。
1.3.3 脲酶 脲酶活性的测定采用苯酚-次氯酸钠比色法,以1 g土样在37℃和pH值6.7条件下,24 h水解尿素产生1 μg NH3-N为1个酶活力单位,用 μg·g-1·d-1表示[10]。
1.3.4 磷酸酶 磷酸酶活性的测定采用磷酸苯二钠比色法,以1 g土样在28℃和pH值10.0条件下,3 h水解磷酸苯二钠产生1 μg酚为1个酶活力单位,用 μg·g-1·h-1表示[10]。
1.3.5 过氧化氢酶 过氧化氢酶活性的测定采用高锰酸钾滴定法,以1 g土样消耗0.02 mol·L-1KMnO4毫升数为1个酶活力单位,用mL·g-1·h-1表示[2]。
1.4 土壤化学性质的测定
土壤化学性质的测定采用常规化学分析方法测定[11]。
1.5 土壤酶指数
本研究采用加权和法计算出土壤酶指数。由于土壤因子变化具有连续性,故各酶活性指标采用具有连续性质的隶属度函数,并从主成分因子负荷量值的正负性确定隶属度函数分布的升降性,本研究全部采用升型分布函数。
土壤酶评价指数计算公式:
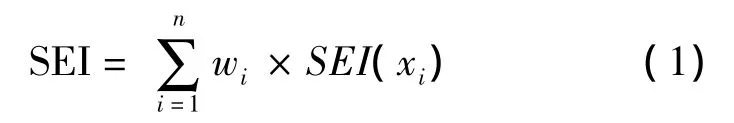
式中:SEI(xi)表示土壤酶隶属度值,wi表示土壤酶(i)的权重。
升型分布函数计算公式:
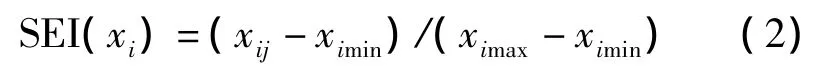
式中:xij表示土壤酶活性值,ximax和ximin分别表示各样品所测酶(i)活性的最大值和最小值。
由于土壤质量的各个因子的状况与重要性通常不同,所以通常用权重系数来表示各个因子的重要性程度。本研究土壤酶权重计算公式如下:

式中:Ci为公因子方差,C为公因子方差之和。
1.6 数据统计分析
数据用WPS2013和DPS7.05统计软件进行处理和分析,采用LSD法进行不同处理间差异显著性检验。
2 结果与分析
2.1 土壤酶活性季节变化特征
2.1.1 纤维素酶 纤维素酶可将土壤中复杂的纤维素大分子分解成动植物和微生物易于吸收利用的小分子葡萄糖,它与土壤中有机质的分解、腐殖质的形成和碳素的营养释放密切相关[12-14]。农田和10 a刺槐纤维素酶酶活性在春季达到高峰,然后缓慢下降,而43 a刺槐纤维素酶酶活性在夏季达到酶活性高峰期,3者纤维素酶酶活性四季增幅变化分别为 0.006 ~0.096、0.059 ~0.184 和 0.083 ~0.442 mg·g-1·d-1。10 a和43 a刺槐四季平均纤维素酶酶活性分别是农田的2.09和3.58倍;43 a刺槐的酶活性是10 a刺槐的1.72倍(图1)。
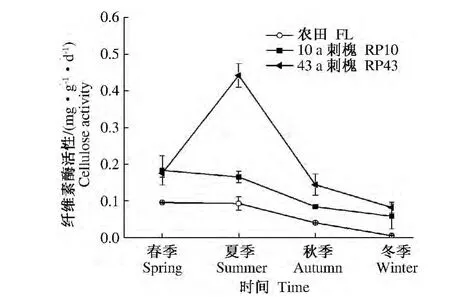
图1 不同林龄刺槐和农田土壤纤维素酶活性季节演变特征Fig.1 Seasonal dynamic changes of soil cellulase activity in Robinia pseudoacacia forest’s land with different tree-age and farmland
2.1.2 蔗糖酶 蔗糖酶在碳素转化过程中起重要作用,其活性高低可引起根圈微生物种群、土壤呼吸速率等生物或非生物化学活性的变化[15-16],常用来表征土壤熟化程度和肥力水平的高低[17]。农田、10 a和43 a刺槐蔗糖酶酶活性分别在秋季、冬季和夏季达到高峰,四季增幅变化分别为1.28~2.80、1.41 ~ 2.10 和 2.02 ~ 3.28 mg·g-1·d-1。10 a和43 a刺槐四季平均蔗糖酶酶活性分别是农田的0.94和1.52倍;43 a刺槐的酶活性是10 a刺槐的1.62 倍(图2)。
2.1.3 脲酶 脲酶的产物氨是林木生长氮素营养的直接来源,它对提高氮素的利用率和促进土壤氮素循环具有重要意义[18]。农田脲酶活性四季变化不明显,而10和43 a刺槐脲酶活性在夏季达到酶活性最高值,3者的四季增幅变化分别为17.35~25.81、4.85 ~27.90 和 13.01 ~71.95 μg·g-1·d-1。10 a和43 a刺槐四季平均脲酶酶活性分别是农田的0.72和2.08倍;43 a刺槐的酶活性是10 a刺槐酶活性的2.88倍(图3)。
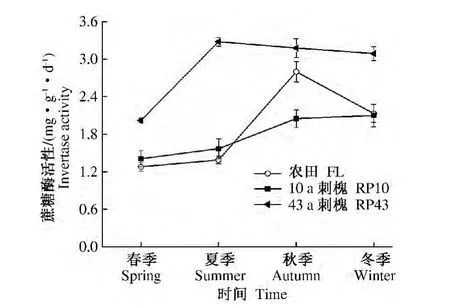
图2 不同林龄刺槐和农田土壤蔗糖酶活性季节演变特征Fig.2 Seasonal dynamic changes of soil invertase activity in Robinia pseudoacacia forest’s land with different tree-age and farmland
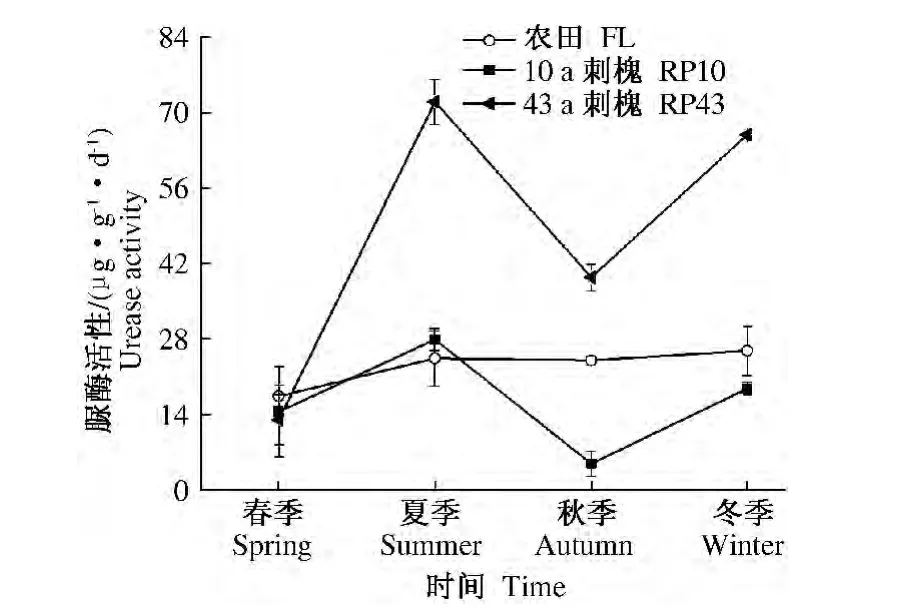
图3 不同林龄刺槐和农田土壤脲酶活性季节演变特征Fig.3 Seasonal dynamic changes of soilurease activity in Robinia pseudoacacia forest’s land with different tree-age and farmland
2.1.4 磷酸酶 磷酸酶能够加速有机磷的解磷速度,提高土壤磷素的有效性[12]。农田磷酸酶在秋季达到酶活性最高值,而10 a和43 a刺槐磷酸酶酶活性在夏季达到酶活性最高值,四季增幅变化分别为1.56 ~3.74、2.33 ~4.74 和 4.7 ~7.35 μg·g-1·h-1。10 a和43 a刺槐四季平均磷酸酶酶活性分别是农田的1.27和1.83倍;43 a刺槐的酶活性是10 a刺槐酶活性的1.44倍(图4)。
2.1.5 过氧化氢酶 过氧化氢酶在微生物呼吸和有机质转化过程中形成,它能合成腐殖质并能减轻或解除过氧化氢对生物体的毒害,其强度可表征土壤腐殖化强度大小和有机质积累程度的高低[19-20]。农田、10 a和43 a刺槐过氧化氢酶酶活性四季变化呈“V”字形趋势,均于冬季达到酶活性高峰期,四季增幅变化分别为 1.82 ~2.34、1.88 ~2.54 和2.04 ~2.68 mL·g-1·h-1。10 a和 43 a刺槐四季平均过氧化氢酶酶活性分别是农田的1.05和1.10倍;43 a刺槐的酶活性是10 a刺槐酶活性的1.04倍(图5)。
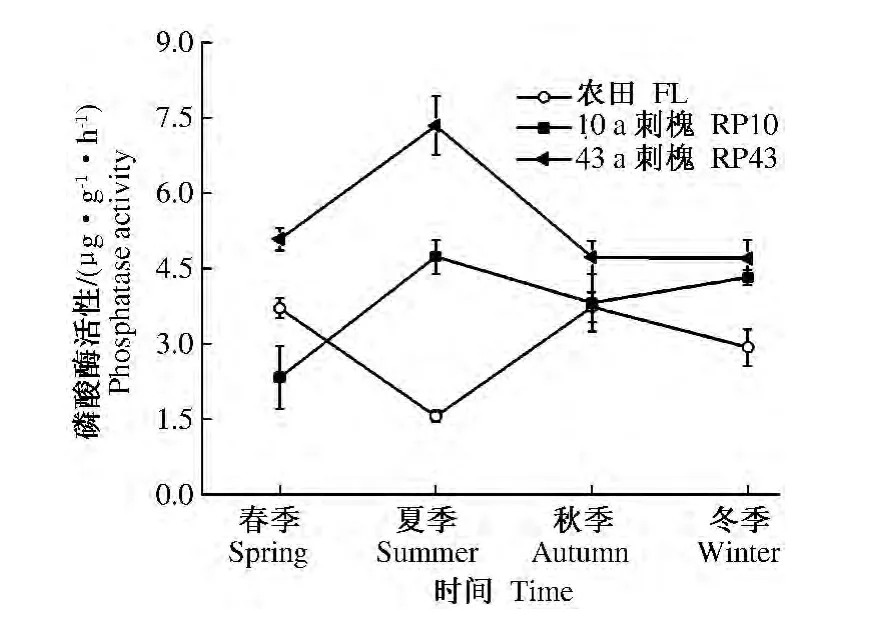
图4 不同林龄刺槐和农田土壤磷酸酶活性季节演变特征Fig.4 Seasonal dynamic changes of soil phosphatase activity in Robinia pseudoacacia forest’s land with different tree-age and farmland
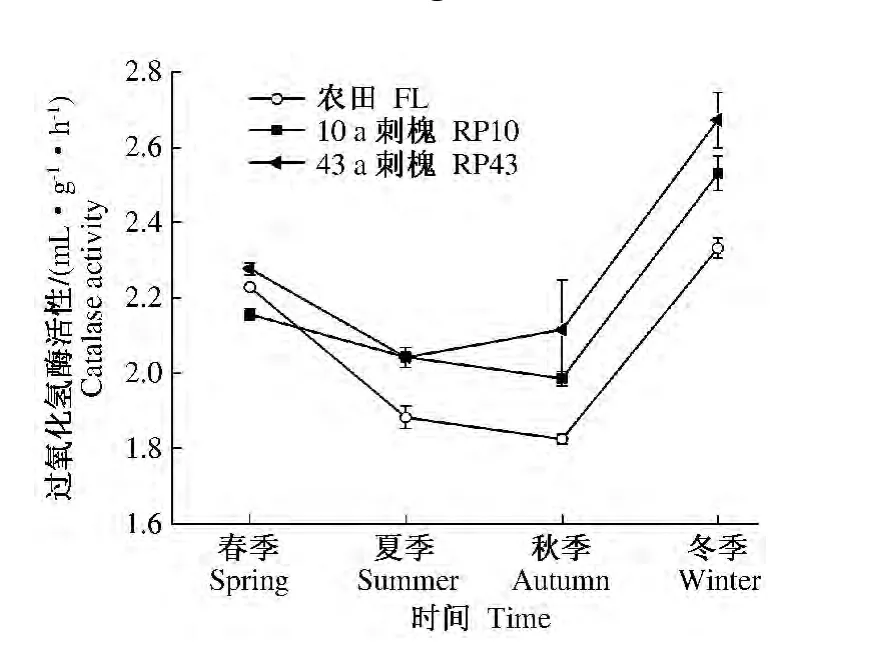
图5 不同林龄刺槐和农田土壤过氧化氢酶活性季节演变特征Fig.5 Seasonal dynamic changes of soil catalase activity in Robinia pseudoacacia forest’s land with different tree-age and farmland
2.2 不同林龄刺槐和农田土壤酶指数
土壤酶种类繁多,作用各异,有的酶相互之间信息重叠,为了克服单一酶指标在反映土壤性质方面的局限,本研究采用土壤酶指数(Soil enzymes index,SEI)反映各酶因子的综合作用,从而更加全面、客观地揭示不同林龄刺槐土壤酶活性的变化规律[21]。由图6可知,与农田相比,10 a和43 a刺槐土壤酶指数季节均值分别提高75.37%和127.80%,其中,43 a刺槐比10 a刺槐四季土壤酶指数均值提高了29.90%。

图6 不同林龄刺槐和农田的土壤酶指数季节变化均值Fig.6 Seasonal mean soil enzyme index in Robinia pseudoacacia forest’s land with different tree-age and farmland
2.3 土壤酶活性与土壤化学成分的相关性分析
由相关性分析可知(表2),纤维素酶与全氮、速效钾、蔗糖酶、脲酶和磷酸酶均为显著或极显著正相关;蔗糖酶与硝态氮、全氮、有机质、速效钾、脲酶和磷酸酶均为显著或极显著正相关;脲酶与速效磷和磷酸酶均为显著或极显著正相关;磷酸酶与速效钾为显著正相关;过氧化氢酶与有机质为显著正相关。为了更好地说明土壤酶活性与各化学性质之间的关系,本研究采用逐步回归法拟合土壤酶活性与土壤化学性质的数学模型,如下:
土壤纤维素酶活性的回归方程:

式中:Y1为纤维素酶,A1为速效钾。速效钾对纤维素酶的偏相关系数为0.871 4**,达到了极显著水平,说明速效钾是影响纤维素酶活性的主要因子。
土壤蔗糖酶活性的回归方程:
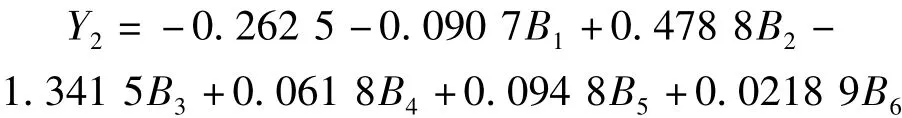
式中:Y2为蔗糖酶,B1为硝态氮,B2为铵态氮,B3为全氮,B4为有机质,B5为速效磷,B6为速效钾。速效钾、速效磷、硝态氮、有机质、铵态氮和全氮对磷酸酶的偏相关系数分别为 0.993 4**,0.981 3**,-0.978 2**,0.966 9**,0.946 2**,-0.936 8**,绝对值依次递减,与速效钾含量有关的偏相关系数最大,而与全氮有关的回归系数是回归模型中的最大值,说明土壤中速效钾和全氮的含量均是影响蔗糖酶活性的第一位重要因子。
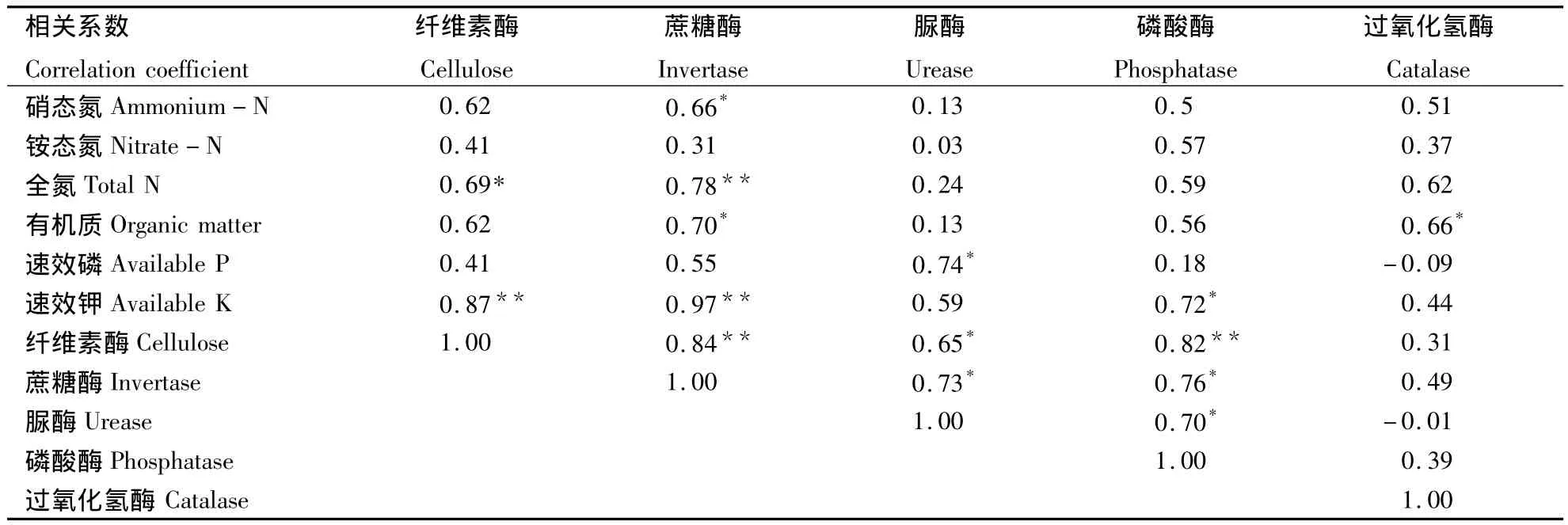
表2 春季土壤酶与土壤化学性质的相关性分析Table 2 Correlation analysis between chemical properties and soil enzymes in spring
土壤脲酶活性的回归方程:

式中:Y3为脲酶,C1为速效磷。速效磷对脲酶的偏相关系数分别为0.737 6*,说明速效磷的含量是影响脲酶活性的第一位重要因子。
土壤磷酸酶活性的回归方程:
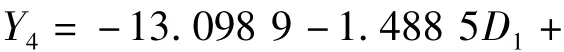
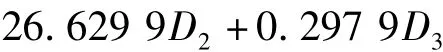
式中:Y4为磷酸酶,D1为硝态氮,D2为铵态氮,D3为速效钾。速效钾、铵态氮和硝态氮对磷酸酶的偏相关系数分别为 0.947 1**,0.923 9**和 -0.906 0**,绝对值依次递减,铵态氮的回归系数最大,但其偏相关系数仅略小于速效钾而位居第二,说明铵态氮和速效钾同是影响磷酸酶活性的主要因子。
土壤过氧化氢酶活性的回归方程:

式中:Y5为过氧化氢酶,E1为硝态氮,E2为有机质。有机质和硝态氮对过氧化氢酶的偏相关系数分别为0.877 8**和 -0.835 1**,硝态氮的回归系数最大,有机质的偏相关系数最大,说明硝态氮和有机质同是影响过氧化氢酶活性的主要因子。
总体而言,纤维素酶和脲酶的主要化学影响因子分别是速效钾和速效磷,蔗糖酶的主要化学影响因子是速效钾和全氮,磷酸酶的主要化学影响因子是速效钾和铵态氮,而过氧化氢酶的主要化学影响因子则是硝态氮和有机质。
3 结论与讨论
退耕还林种植刺槐后土壤中纤维素酶、蔗糖酶、脲酶、磷酸酶和过氧化氢酶等的活性显著高于农田,但10 a刺槐的蔗糖酶和脲酶活性除外,其四季均值均略低于农田。各样地季节动态变化差异显著,10 a和43 a刺槐林地的四季土壤酶指数均值较农田分别提高了75.37%和127.80%,43 a刺槐林地四季土壤酶指数均值较10 a刺槐林地提高了29.90%。表明退耕还林种植刺槐能够显著提高土壤的生物活性,且植被恢复时间越长,效果越显著。逐步回归分析表明,纤维素酶和脲酶的主要化学影响因子分别是速效钾和速效磷,蔗糖酶的主要化学影响因子是速效钾和全氮,磷酸酶的主要化学影响因子是速效钾和铵态氮,过氧化氢酶的主要化学影响因子是硝态氮和有机质。
土壤酶是土壤生态系统代谢的重要动力,与有机物质分解、能量转移、营养物质循环、环境质量等密切相关[22],其活性不仅能反映土壤各生化过程的强度和方向,而且能表征土壤综合肥力特征和土壤养分转化能力的强弱,可作为衡量生态系统中土壤质量变化的预警和敏感指标[20-23]。但由于不同林龄刺槐和农田下的枯枝落叶的种类、数量及根系分泌物不同,再加上林内小气候的影响,致使5种酶活性季节变化各异,且酶活性峰值出现的时间也并不相同。农田各酶活性中除了蔗糖酶和脲酶活性略高于10 a刺槐外,其余酶活性均低于10 a和43 a刺槐,且43 a刺槐林地各酶活性均显著高于10 a刺槐。纤维素酶和过氧化氢酶与腐殖质的形成密切相关[12,19],刺槐林地中每年积累的枯枝落叶较为丰富,农田中的作物常年被人为挪出,故而刺槐林中纤维素酶和过氧化氢酶活性自然较农田高。蔗糖酶在碳素转化过程中起重要作用[15-16],脲酶的产物氨是植物氮素营养的直接来源[18],因农田每年人为施加碳铵和尿素以增加土壤肥力,故而10 a刺槐的蔗糖酶和脲酶的活性略低于农田,而43 a刺槐却比农田酶活高出许多,这更是说明了人工林对于改善土壤质量具有积极的正效应,但植被恢复是一个缓慢的过程,要想通过该法达到改良土壤的目的,就必须大面积、长时间地进行植树造林。
土壤酶指数克服了单一酶指标反映土壤酶活性的片面性和局限性,能更加全面客观地反映土壤酶活性随植被恢复的演变特征。10 a和43 a刺槐的四季土壤酶指数均值比农田分别提高了75.37%和127.80%,43 a刺槐的四季土壤酶指数均值比10 a刺槐提高了29.90%。这些结果均表明退耕还林种植刺槐可显著提高土壤酶活性,且植被恢复时间越长,土壤酶活性越高。
植被种类、水热条件以及营养丰缺等都可能会对土壤酶活性产生各种影响,故而土壤酶与土壤养分因子的相关性都会存在一定的差异。有学者认为,土壤酶活性与土壤化学性质之间并不存在密切的相关性[24-26]。张笑培等[25]通过对黄土高原南部植被恢复情况进行研究发现,该区脲酶、过氧化氢酶和碱性磷酸酶与全磷、速效磷、速效氮、速效钾均未达到显著相关。高雪峰等[26]研究短花针茅草原土壤时也发现脲酶和蔗糖酶与土壤化学性质之间相关性并不显著。但也有学者证实,土壤酶活性与土壤中的主要化学因子均有较好的相关性[7,12],如陆梅等[27]研究表明土壤酶活性和土壤养分密切相关。本研究结果也表明,土壤化学性质和5种酶活性之间的相关性较好,其中纤维素酶与全氮和速效钾均为显著或极显著正相关;蔗糖酶与硝态氮、全氮、有机质和速效钾均为显著或极显著正相关;脲酶与速效磷,磷酸酶与速效钾,过氧化氢酶与有机质均为显著正相关,但各酶活性与铵态氮并未达显著水平。这与前人研究结果基本一致,充分说明研究区域不同,研究对象不同,土壤中各种成分相互作用表现出的形式各异,故而各种成分之间的耦合关系也不尽相同,进而说明土壤酶与土壤化学性质之间的关系仍较为复杂,还需进一步研究。
[1] 宋 日,吴春胜,牟金明.玉米根茬留田对土壤微生物量碳和酶活性动态变化特征的影响[J].应用生态学报,2002,13(3):303-306.
[2] 杨鹏鸣,周俊国.不同肥料对土壤蔗糖酶和过氧化氢酶活性的影响[J].广东农业科学,2011,38(11):78-80.
[3] 王海英,宫渊波,陈林武.嘉陵江上游不同植被恢复模式土壤微生物及土壤酶活性的研究[J].水土保持学报,2008,22(3):172-177.
[4] 王 兵,刘国彬,薛 萐,等.黄土丘陵区撂荒地对土壤酶活性的影响[J].草地学报,2009,17(3):282-287.
[5] 戴全厚,刘国彬,姜 峻,等.黄土丘陵区不同植被恢复模式对土壤酶活性的影响[J].中国农学通报,2008,24(9):429-434.
[6] 鹿士杨,彭晚霞,宋同清,等.喀斯特峰丛洼地不同退耕还林还草模式的土壤微生物特性[J].生态学报,2012,32(8):2390-2399.
[7] 张笑培,杨改河,王和洲,等.黄土沟壑区植被恢复中土壤生物学特性的响应及其评价[J].中国农学通报,2010,26(15):323-327.
[8] 张 杨,梁爱华,王 平,等.黄土丘陵区不同植被恢复模式土壤养分效应[J].西北农业学报.2010,19(9):114-118.
[9] 杨万勤,钟章成,陶建平,等.缙云山森林土壤酶活性与植物多样性的关系[J].林业科学,2001,37(4):124-128.
[10] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[11] 杜 森,高祥照.土壤分析技术规范[M].北京:中国农业出版社,2006.
[12] 张 超,刘国彬,薛 萐,等.黄土丘陵区不同林龄人工刺槐林土壤酶演变特征[J].林业科学,2010,46(12):23-29.
[13] DIAMANTIDIS G,EFFOSSE A,POTIER P,et al.Purification and characterization of the first bacteriallaecase in the rhizospheric bacterium Azospirillum lipoferum[J].Soil Biology& Biochemistry,2000,32(7):919-927.
[14] KORNER C,ARNONE III J A.Responses to elevated carbon dioxide in artificial tropical ecosystems[J].Science,1992,257:1672-1675.
[15] 杨万勤,王开运.土壤酶研究动态与展望[J].应用与环境生物学报,2002,8(5):564-570.
[16] 张咏梅,周国逸,吴 宁.土壤酶学的研究进展[J].热带亚热带植物学报,2004,12(1):83-90.
[17] 曹 慧,孙 辉,杨 浩,等.土壤酶活性及其对土壤质量的指示研究进展[J].应用与环境生物学报,2003,9(1):105-109.
[18] 李冬坡,武志杰.长期培肥黑土脲酶活性动态变化及其影响因素[J].应用生态学报,2003,14(12):2208-2212.
[19] 包耀贤.黄土高原坝地和梯田土壤质量特征及评价[D].杨凌:西北农林科技大学,2008.
[20] 周礼恺.土壤酶学[M].北京:科学出版社,1987.
[21] 许明样,刘国彬,赵允格.黄土丘陵区土壤质量评价指标研究[J].应用生态学报,2005,16(10):1843-1848.
[22] XIAO HUA Y,MIN H,ZHEN HUA L,et al.Influence of acetamiprid on soil enzymatic activities and respiration[J].Eur.J.Soil Biol.,2006,42:120-126.
[23] 南京土壤所主编.土壤微牛物研究法[M],北京:科学出版社,1985.
[24] 马 朋,李昌晓,雷 明,等.三峡库区岸坡消落带草地、弃耕地和耕地土壤微生物及酶活性特征[J].生态学报,2014,34(4):1010-1020.
[25] 张笑培,杨改河,任广鑫,等.黄土高原南部植被恢复对土壤理化性状与土壤酶活性的影响[J].干旱地区农业研究,2010,28(6):64-68.
[26] 高雪峰,张 功,卢 萍.短花针茅草原土壤的酶活性及其生态因子的季节动态变化研究[J].内蒙古师范大学学报,2006,35(2):226-237.
[27] 陆 梅,田 昆,陈玉惠,等.高原湿地纳帕海退化土壤养分与酶活性研究[J].西南林学院学报,2004,24(1):34-37.

