家蚕生长阻遏肽结合蛋白与杆状病毒P13蛋白互作关系的研究
邓培渊,王国霞,王 辉,李玉华,李长看
(1.郑州师范学院,河南郑州450044;2.河南中医学院第一附属医院,河南 郑州450000)
核型多角体病毒(Nucleopolyhedro viruses,NPVs)是一类广泛用于害虫生物防治的杆状病毒。根据其分子亲缘关系和是否含有包膜糖蛋白GP64,分为I型和 II型2个组[1]。其中鳞翅目昆虫的核型多角体病毒属于II型杆状病毒,在这类病毒的基因组中普遍存在一种P13基因[2-5],不仅在病毒侵染昆虫细胞的过程中持续表达,而且对下游基因的表达也有负调控作用[6]。研究还发现,P13蛋白是一类与病毒杀虫活性相关的蛋白,但对其杀虫作用的分子机理尚不明确[7]。生长阻遏肽(Growth blocking peptide,GBP)是存在于昆虫血淋巴中的一类多肽,已从黏虫Mythimna(Leucania)separata、甘蓝夜蛾Mamestra brassicae和斜纹夜蛾Spodoptera litura等多种鳞翅目昆虫中分离鉴定出来[8-11]。GBP主要参与幼虫的生长调节、细胞增殖和免疫细胞的调节[12],但高浓度的GBP也会阻碍幼虫的生长[13-14],且GBP结合蛋白(GBP-binding protein,GBPBP)对 GBP 也有抑制活性[15]。既然P13蛋白和GBP结合蛋白在鳞翅目昆虫幼虫中同时出现,它们与核型多角体病毒的杀虫机理是否有关。本研究以模式昆虫家蚕Bombyx mori Linnaeus为试验材料,在克隆家蚕GBPBP的基础上,测定了其与P13蛋白之间是否存在互作关系,为深入研究GBPBP蛋白的功能和作用机制提供依据。
1 材料与方法
1.1 材料和试剂
家蚕品系为大造P50,由西南大学惠赠;Trizol提取试剂盒购自Gibco公司;病毒基因组提取试剂盒和His,GST标签融合蛋白杂交试剂盒购自天根生化科技有限公司;cDNA反转录试剂盒购自Promega公司;限制性内切酶购自NEB公司;pfu DNA聚合酶、T4 ligase酶和PageRular Prestained Protein Ladder购自 Ferments公司;pMD18-T购自 Takara公司;黏虫核型多角体病毒(LsNPV)、表达载体pET-32a(+),pGEX-6P1,菌株 DH10B、菌株 BL21(DE3)为郑州市生物物种资源研究重点实验室保存;GST和His亲和柱材料为Whatman产品。
1.2 P13相互作用肽的筛选及序列分析
通过筛选噬菌体十五肽文库,获得与黏虫核型多角体病毒P13蛋白(LsP13)相互作用的十五肽序列,并在NCBI上比对查找与其同源性较高的昆虫蛋白序列。
1.3 RNA提取及基因克隆
取3~5龄的家蚕幼虫,用无菌针头刺破腹足,吸取约10 μL血淋巴液,加入到100 μL Trizol中;总RNA的提取及cDNA第1条链的合成依据试剂盒说明书进行。
通过在GenBank查找家蚕生长阻遏肽结合蛋白(BmGBPBP,DQ306881)和 LsP13(U30303)基因的CDS区,两端加酶切位点和保护碱基,设计引物CAGTCATTC-3';BmGBP2(-):5'-AATGTCGACTG CCACGGCTGGATTATGA-3';LsP13(+):5'-GG-
GAATTCATGTTCGCGTTCGTAACT-3';LsP13(-):下划线代表酶切位点序列,酶切位点前端为保护碱基。
1.4 融合表达载体的构建
取提取的家蚕RNA 1 μg,按照Sigma cDNA反转录试剂盒说明书合成第1条cDNA链,扩增BmGBPBP。由于病毒的基因组中不存在内含子,所以LsP13的序列直接从LsNPV的基因组中进行扩增,病毒基因组的提取用天根病毒核酸提取试剂盒,方法按说明书进行。扩增的基因纯化后与pMD18-T连接,经测序鉴定后双酶切,并与经同样双酶切的表达载体pET-32a(+)和pGEX-6P1连接,分别构建 pET/32a-BmGBPBP/His和 pGEX-6P1-LsP13/GST融合表达载体,经蓝白斑筛选后送北京奥科鼎盛生物技术有限公司测序。
1.5 融合蛋白的诱导表达和预处理
将鉴定正确的pET/32a-BmGBBP和pGEX-6P1-LsP13质粒转化入BL21(DE3)感受态中,扩大培养至OD值为0.6,加入 IPTG至终浓度为0.4 mmol·L-1,于30℃诱导表达;诱导3 h后依次进行如下处理:1)5 000 r·min-1离心5 min,收集菌体;使用PBS(pH7.4)(含1%的Triton X-100和蛋白酶抑制剂)重悬;2)超声破碎后离心取上清,将上清通过0.45 μm的针头滤器,加入亲和层析柱,使其在室温下缓慢通过;3)再用5倍层析柱体积的PBS溶液洗涤柱子,重复3次;4)加入洗脱液(PBS+150 mmol·L-1咪唑)孵育。
1.6 GST Pull down
将诱导后的LsP13/GST融合蛋白的上清液与GST亲和层析柱孵育后,用5倍柱体积的PBS溶液洗涤5次,取3 μL柱材料作为对照1,用于检测LsP13/GST融合蛋白与柱子的结合;将BmGBPBP/His融合蛋白的上清加入到结合LsP13/GST融合蛋白的亲和层析柱中孵育1 h,同时向空白的GST亲和层析柱中加入等量的BmGBPBP/His融合蛋白上清液作为对照。孵育结束后加入5倍柱子体积的PBS溶液清洗柱子,洗涤结束后取3 μL柱材料,与对照1共同进行SDS-PAGE电泳和Western Blot检测。
1.7 Western免疫印迹检测
待检测样品从SDS-PAGE胶上电转至NC膜上,PBST+5%脱脂牛奶封闭1 h;加GST或His一抗(稀释度1∶1 000)孵育1 h,PBST洗膜3次;加入AP(碱性磷酸酶)标记的羊抗兔IgG二抗(稀释度1∶2 500),室温孵育1.5 h,PBST洗膜3次;最后将NC膜置于BCIP/NBT显色液中至条带显色清晰,ddH2O终止显色。
2 结果与分析
2.1 家蚕BmGBPBP基因和LsNPV P13基因的克隆
以家蚕总RNA为模板进行一步法反转录PCR,PCR后通过琼脂糖凝胶鉴定,得到单一条带(图1)。切胶回收后与pMD18-T载体连接,挑取白色单克隆测序。
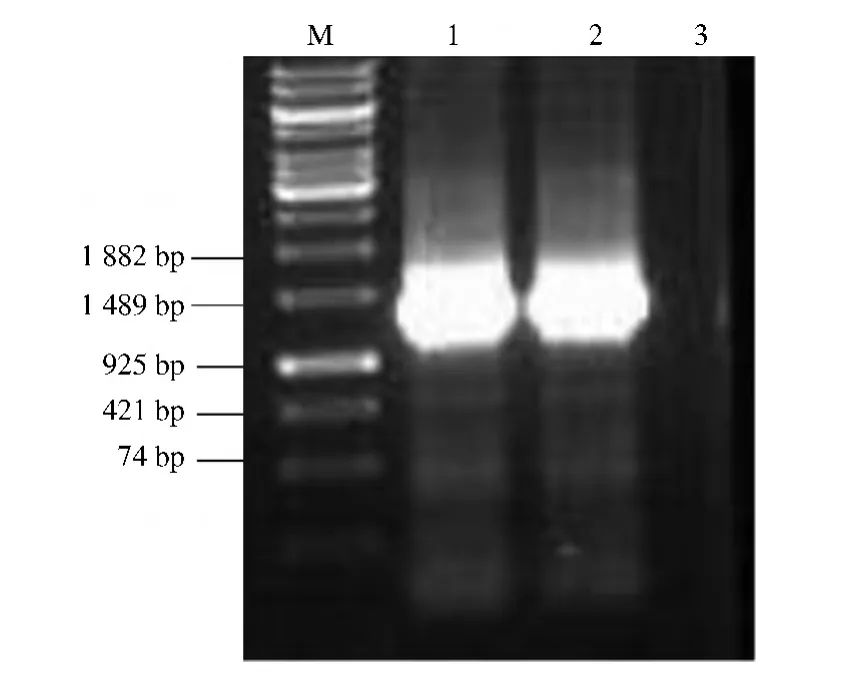
图1 BmGBPBP基因的反转录RT-PCR结果Fig.1 Reverse transcription PCR product of BmGBPBP gene
选择测序正确的克隆提取质粒,用BamHI和SalI酶切后回收,得到约1.2 kb的目的条带;原核表达载体pET32a(+)用同样的酶进行酶切后回收,用T4连接酶连接后4℃过夜。
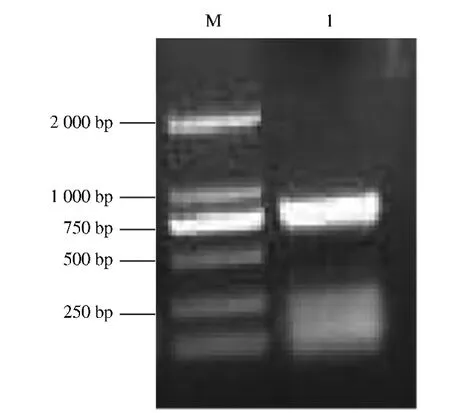
图2 LsP13基因反转录RT-PCR结果Fig.2 Result of reverse transcription PCR product of LsP13gene
LsP13以LsNPV的基因组为模板进行扩增,得到约900 bp片段,如图2所示。从图3可以看出,得到P13基因的全长后连接到pMD18-T,双酶切EcoRI和XhoI位点连接到原核表达载体pGEX-6P1的相同位点,说明测序验证正确。
2.2 LsP13/GST和BmGBPBP/His融合蛋白的表达分析
取未诱导的pGEX-6P1-LsP13的BL21(DE3)菌液作为对照,以及IPTG诱导的全菌和超声波破碎后的上清进行SDS-PAGE检测,结果如图3所示。从图3可以看出,重组载体经IPTG诱导后产生1条55 kD左右的特异性条带,而未经诱导的重组载体则无此条带,且目的蛋白存在于超声破碎后的上清液中。

图3 pGEX-6P1-LsP13表达产物的SDS-PAGE分析Fig.3 SDS-PAGE analysis of expressed pGEX-6P1-LsP13
2.3 BmGBPBP/His融合蛋白的表达
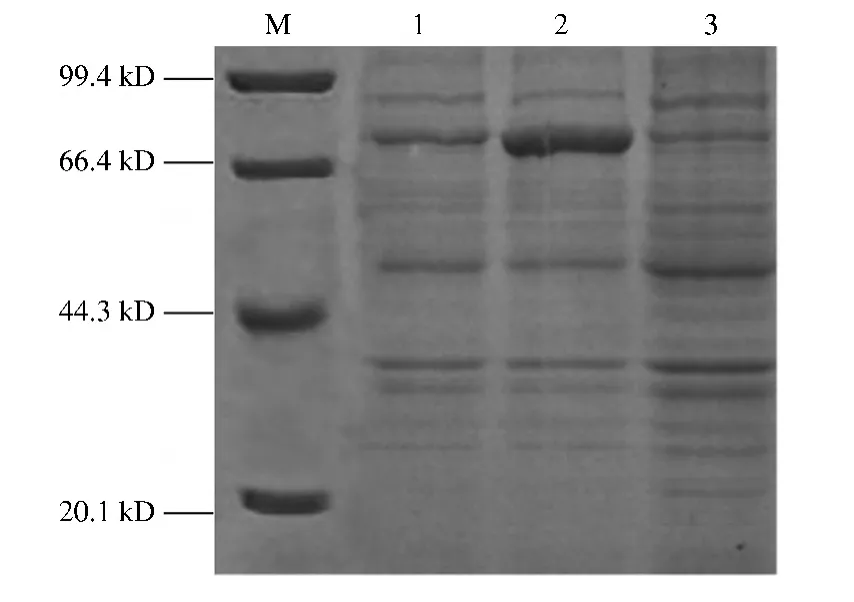
图4 pET/32a-BmGBPBP表达产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis of expressed pGEX-6P1-LsP13
取未诱导的pET/32a-BmGBPBP的BL21(DE3)菌液作为对照,对IPTG诱导的全菌和超声波破碎后的上清进行SDS-PAGE检测,结果如图4所示。从图 4可以看出,pET/32a-BmGBPB经IPTG诱导后产生1条75 kD左右的特异性条带,而未经诱导的重组载体则无此条带,且超声破碎后目的蛋白也存在于上清液中。
2.4 GST Pull down检测 LsP13与 BmGBPBP的相互作用
采用 GST Pull down来检测 LsP13蛋白与BmGBPBP蛋白的相互作用,结果如图5所示。从图5可以看出,BmGBPBP/His融合蛋白不能结合到空白的GST亲和柱上,但可以与LsP13/GST蛋白的亲和柱结合。

图5 GST Pull down结果SDS-PAGE分析Fig.5 SDS-PAGE analysis of GST Pull down product
为了证实亲和柱结合的蛋白是否为LsP13/GST和BmGBPBP/His融合蛋白,对PAGE胶上的蛋白进行Western blot检测,孵育一抗的同时加入抗GST和His标签的单抗,得到图6结果。从图6可以看出,Pull down结果以及His和GST单抗都发生了特异性反应,证明2种蛋白间存在相互作用。

图6 Western印迹分析LsP13/GST和BmGBPBP/His的Pull down结果Fig.6 Western blotting analysis of Pull down product of LsP13/GST and BmGBPBP/His
3 讨论
P13基因特异性的存在于杆状病毒 II型中[2]。但近年来研究发现,P13基因在II型棉铃虫核型多角体病毒(HaNPV)中为非必须基因,但被敲除后病毒的杀虫能力明显下降,说明其表达的P13蛋白可能是与杀虫有关的正调控因子[7]。已有研究表明,P13基因在Sf9细胞中的表达可以明显抑制多角体的产生,其抑制效果随P13基因表达时相的提前而加强,且明显增加出芽病毒(BV)的产生,表明P13蛋白提前杀虫效果的机制是由于P13蛋白改变了BV与多角体之间的动态平衡[5]。这些研究结果暗示,P13基因可能是一个与杀虫相关的基因,但至今缺乏在分子水平上的证据。
本研究通过比对LsGBPBP蛋白序列,发现家蚕BmGBPBP蛋白与LsGBPBP蛋白有着较高的同源性,因此选择了BmGBPBP作为研究对象。但由于目前对昆虫GBP及其结合蛋白GBPBP的研究较少,已有的相关研究大多集中于对哺乳动物的同源蛋白进行比较[13,15],而有关 GBPBP 与昆虫病毒蛋白的相互作用研究还未见报道,所以本研究通过体外的Pull down试验来证实GBPBP蛋白与昆虫病毒LsP13蛋白的相互作用,虽然研究结果不能作为其生理功能的直接证据,但可为最终阐明其作用机制提供理论参考。
前人的研究发现,黏虫的LsGBP具有刺激昆虫免疫血细胞、调控幼虫生长、影响细胞增殖和诱导其他血细胞溶血等功能,类绛色细胞中的GBPBP蛋白与GBP分子结合后,可引起这类细胞的裂解[12]。对家蚕GBPBP蛋白的研究发现,病毒感染后蚕体GBPBP的表达量会有所上升,但是也有相反的报道,GBPBP蛋白的表达量上升不是病毒感染,而是由于细菌感染所致[15-16]。基于以上研究结果,推测P13蛋白与GBPBP蛋白相互作用,可能影响了GBP作用于血细胞的免疫反应或溶血反应。这些研究为进一步阐明杆状病毒的杀虫机制提供了新的启示。
[1] HERNIOU E A,OlSZEWSKI J A,CORY J S,et al.The genome sequence and evolution of baculoviruses[J].Annu Rev Entomol,2003,48:211-234.
[2] WANG J W,QI Y P,HANG Y X,et al.Nucleotide sequence of a 1446 base pair SalI fragment and structure of a novel early gene of Leucania separata nuclear polyhedrosis virus[J].Arch Virol,1995,140(12):2283-2291.
[3] JIN T,QI Y,QI B,et al.Nucleotide sequence of a 5423 base pairs fragment of the LsNPV genome and comparison with the AcNPV genome[J].Virus Genes,1997,14(3):201-210.
[4] LIU D L,JIN T Q.QI Y P,et al.Sequencing of a 3.3 kb Fragment from LsNPV Genome and Comparison of Its Genome Structure with Other Two NPVs[J].Acta Biochimicaet Biophysica Sinica,1999,31(2):215-219.
[5] DU E Q,YAN F,JIN W X,et al.P13 of Leucania separata multiple nuclear virus affected the polyhedra and budded virions yields of polyhedrosis AcMNPV[J].Virus Res,2007,124(1/2):160-167.
[6] QIAO H,LU N,DU E,et al.Rare codons in uORFs of baculovirus p13 gene modulates downstream gene expression[J].Virus Res,2011,155(1):249-253.
[7] LU N,DU E,LIU Y,et al.p13 from group II baculoviruses is a killing-associated gene[J].BMB Rep,2012,45(12):730-735.
[8] ENDO Y,OHNISHI A.HAYAKAWA Y .Mechanism of parasitism-induced elevation of haemolymph growthblocking peptide levels in host insect larvae(Pseudaletia separata)[J].J Insect Physiol,1998,44(9):859-866.
[9] YOSHIDA M,AIZAWA T,NAKAMURA T ,et al.The Gly-Gly Linker region of the insect cytokine growthblocking peptide is essential for activity[J].J Biol Chem,2004,279:51331-51337.
[10] NINOMIYA Y ,HAYAKAWA Y.Insect cytokine,growth-blocking peptide,is a primary regulator of melanin-synthesis enzymes in armyworm larval cuticle[J].FEBS J,2007,274(7):1768-1777.
[11] NINOMIYA Y,KURAKAK E,ODA Y,et al.Insect cytokine growth-blocking peptide signaling cascades regulate two separate groups of target genes[J].FEBS J,2008,275(5):894-902.
[12] HAYAKAWA Y.Structure of a growth-blocking peptide present in parasitized insect hemolymph[J].J Biol Chem,1991,266:7982-7984.
[13] HAYAKAWA Y ,OHNISHI A.Cell growth activity of growth-blocking peptide[J].Biochem Biophys Res Commun,1998:250(2):194-199.
[14] OHNISHI A,ODA Y,HAYAKAWA Y.et al.Characterization of receptors of insect cytokine,growth-blocking peptide,in human keratinocyte and insect Sf9 cells[J].J Biol Chem,2001,276(41):37974-37979.
[15] MATTSUMOTO Y,ODA Y.URYU M,et al.Insect cytokine growth-blocking peptide triggers a termination system of cellular immunity by inducing its binding protein[J].J Biol Chem,2003,278(40):38579-38585.
[16] STRAND M R,HAYAKAWA Y,CLARK K D ,et al.Plasmatocyte spreading peptide(PSP1)and growth blocking peptide(GBP)are multifunctional homologs[J].J Insect Physiol,2000,46(5):817-824.

