芝麻素对人结肠癌SW480 细胞株的影响
孙方博,白金权 ,王 瑶,赵 斌,佟瑶瑶,张晓霞 (吉林医药学院:.临床医学院,2.附属医院肛肠外科,吉林 吉林 3203)
结直肠癌是严重威胁人类健康的恶性疾病,其发病率及死亡率呈逐年上升趋势,随着化疗药物和分子靶向药物的开发与应用,结肠癌的治疗效果较以往有所提高,但疗效仍不能令人满意,且化疗药物带来的毒副作用及耐药事件的发生,导致化疗的失败一直是困扰着医生的一个难题[1]。故探索高效低毒的抗肿瘤药物已成为目前研究的热点话题。本实验主要研究芝麻素对人结肠癌细胞是否具有诱导凋亡及抗肿瘤作用,并探究可能的抗肿瘤机制。
1 材料与方法
1.1 材料及设备
人结肠癌SW480 细胞株购自中科院上海生物细胞库。芝麻素购自成都曼思特生物科技有限公司(产品编号:A0174-20 mg,Purity:≥98% HPLC),4 ℃保存,使用时将芝麻素加入Trichloromethane 中溶解,再溶于DMEM 液中配制成所需浓度。DMEM 培养液、NCS、凋亡双染检测试剂盒、免疫组化试剂盒购自中生华美(北京)科技有限公司。其他设备有倒置显微镜,CO2细胞培养箱,超净工作台,电热恒温水浴箱,超低温冰柜,离心机,电热恒温鼓风干燥箱,光学显微镜,冰箱,立式高压蒸汽灭菌器等。
1.2 MTT 比色法检测SW480 细胞株增殖抑制率
实验检测开始前24 h 行常规细胞换液,取对数生长期SW480 细胞株,经消化后制备成单细胞悬液并进行细胞计数(细胞浓度为1 ×106/mL),将细胞接种在96 孔板内180 μL,细胞贴壁48 h 后将每孔分别加入芝麻素终浓度达20、40、60、80、100、120、140 mg/L 20 μL,另设空白对照组(只加培养液)和对照组(只加SW480 细胞株和培养液),培养48 h 后将每孔分别加入MTT 溶液5 g/L 20 μL,经37 ℃孵育4 h后,弃去上清液,将二甲基亚砜(DMSO)分别加入每孔中150 μL,轻轻振荡10 min,取酶标仪测量波长490 nm 处吸光度(D 值),利用NDST 软件计算,细胞增殖抑制率计算公式:抑制率(%)=(1 -芝麻素组D 值/对照组D 值)×100%;将芝麻素组药物浓度接近半数抑制浓度(IC50)为参考,进行后续研究。
1.3 倒置显微镜下观察SW480 细胞株形态
将处于对数生长期的SW480 细胞株加入芝麻素终浓度(IC50),设对照组,将培养瓶置入37 ℃CO2细胞培养箱中培养48 h 后,利用倒置显微镜观察SW480 细胞株的形态学变化并随机拍照记录。
1.4 流式细胞术检测细胞早期凋亡率
取对数生长期的SW480 细胞株,经消化后制备成含细胞悬液(1 ×106个细胞)3 mL,置于25 mL 的细胞培养瓶中进行培养,待细胞贴壁后每个培养瓶中再各加2.7 mL 含10% NCS DMEM 培养液,再分别加入0.3 mL 芝麻素终浓度(IC50),对照组加入等体积不含10% NCS DMEM 培养液,将培养瓶置入37 ℃CO2细胞培养箱中培养48 h 后,弃去上清液,用PBS液(pH 为7.2 ~7.4)洗涤1 次,消化5 min 后,取含10% NCS DMEM 培养液终止消化,轻柔吹打使其成为细胞悬液,600 g 离心5 min,弃去上清收集细胞,用PBS 液重悬细胞并计数(取1 ×106重悬的细胞),600 g离心5 min,弃去上清,加入Annexin V-FITC 结合液195 μL 重悬细胞;加入Annexin V-FITC 5 μL 混匀,23 ℃避光孵育10 min;600 g 离心5 min,弃去上清,加入Annexin V-FITC 结合液190 μL 重悬细胞;再加入碘化丙啶(PI)染色液10 μL,避光混匀;上机检测细胞早期凋亡率。
1.5 免疫细胞化学染色
细胞爬片浓度1 × 105/mL,用10% 甲醛溶液23 ℃条件下固定30 min,PBS 液(pH 7.2 ~7.6)冲洗;30%双氧水1 份+纯甲醇50 份混合,23 ℃条件下孵育30 min,PBS 液冲洗;滴入10%正常山羊血清封闭非特异性抗原,23 ℃条件下孵育20 min;分别滴入caspase-3、caspase-8 一抗工作液50 μL,置入37 ℃CO2细胞培养箱中孵育1 h,PBS 液冲洗2 min×3 次;滴入二抗工作液50 μL,置入37 ℃CO2细胞培养箱中孵育1 h,PBS 液冲洗2 min ×3 次;滴入三抗工作液50 μL 37 ℃CO2细胞培养箱中孵育1 h,PBS 液冲洗2 min×3 次;滴入DAB 显色剂,23 ℃条件下显色,显微镜观察,阳性显色显著时用蒸馏水冲洗;苏木素染色剂轻度复染;利用水溶性封片剂进行封片,在光学显微镜下观察,并用照相机随机拍照记录。观察当细胞内出现棕色颗粒的为阳性细胞,细胞轻微着色的或未着色的为阴性细胞。阴性对照用PBS 液(pH 7.2 ~7.6)代替一抗工作液,阳性对照取已知阳性物质的大肠癌免疫组织化学染色切片。在光学显微镜下观察(放大400 倍),于每张爬片上观察10 个视野,将每个视野中分别计算出阳性细胞数和细胞总数。细胞阳性表达率(%)= 阳性细胞数/细胞总数×100%。
1.6 统计学方法
应用SPSS 17.0 统计学软件包进行统计学分析,数据资料以均数±标准差(±s)表示,组间均数比较采用t 检验,以P <0.05 认为差异具有统计学意义。
2 结 果
2.1 MTT 比色法检测SW480 细胞株增殖抑制率
结果显示各浓度芝麻素均对人结肠癌SW480 细胞株具有增殖抑制的作用,在药物作用时间不变的前提条件下,随着药物浓度的递增SW480 细胞呈现出增殖抑制作用加强,芝麻素组与对照组比较有统计学意义,P <0.01(图1)。其中芝麻素100 mg/L 最接近IC50,所以将此浓度的芝麻素作为后续研究。
2.2 倒置显微镜形态学观察
倒置显微镜下观察,对照组SW480 细胞株形态为椭圆形或多边形,贴壁牢固,密集生长,细胞膜完整,胞质丰富且分布均匀,可见核分裂相,细胞间距较小,细胞体积较大;芝麻素100 mg/L 组作用48 h 后,SW480 细胞体积缩小,皱缩变圆,细胞之间的间距变大,细胞数量较对照组有所减少,部分细胞漂浮,细胞贴壁不牢固,细胞膜完整,胞质分布不均匀,核分裂相较对照组有所减少,视野中细胞凋亡明显(图2)。
2.3 流式细胞术检测细胞早期凋亡率
芝麻素100 mg/L 组作用48 h 后,行Annexin VFITC/PI 检测细胞早期凋亡率,结果与对照组比较有统计学意义,P <0.01(见图3)。
2.4 免疫细胞化学染色
芝麻素100 mg/L 组作用48 h 后,经免疫细胞化学染色在光学显微镜下观察发现,与对照组相比caspase-3 和caspase-8 表达增高,有明显的差异,P <0.01(参见表1,图4 ~5)。
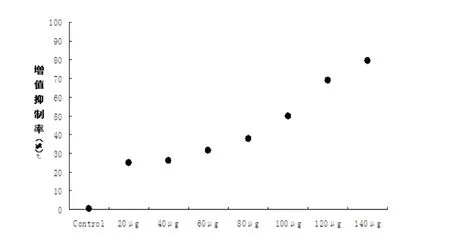
图1 芝麻素对人结肠癌SW480 细胞株增殖抑制率

图2 芝麻素IC50浓度作SW480 细胞株48 h 后图像
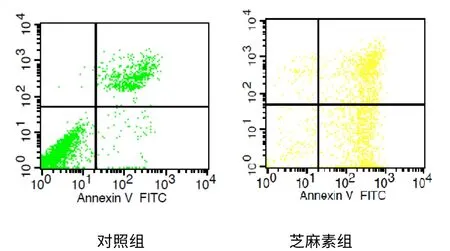
图3 流式细胞术检测细胞早期凋亡率(%)

表1 芝麻素作用48 h 后caspase-3 和caspase-8 表达(%)
3 讨 论

图4 人结肠癌SW480 细胞Caspase-3 表达(SABC,400 ×)

图5 人结肠癌SW480 细胞Caspase-8 表达(SABC,400 ×)
结肠癌是常见的恶性肿瘤之一,发病率和死亡率逐年上升,化学药物已成为晚期结肠癌主要的治疗手段之一,但由于部分肿瘤细胞对化疗药物产生耐药、药物生物利用度低及药物对正常组织细胞毒性较强等原因,常常影响其治疗效果[2],故研发新型抗结肠癌药物已势在必行。芝麻素具有抗氧化、调节脂质及胆固醇代谢、促进乙醇代谢及保护肝脏、抗高血压、降血糖、抗菌等作用,同时还具有抑制肿瘤作用[3-4]。
本实验采用MTT 法测得芝麻素对人结肠癌SW480 细胞株具有很好的增殖抑制作用,结果显示,药物作用48 h 后芝麻素100 mg/L 增殖抑制率为49.95%接近IC50,芝麻素对SW480 细胞株的最大抑制率为79.21%,因此以接近IC50为参考进行后续研究。利用倒置显微镜观察到,芝麻素浓度接近IC50作用SW480 细胞48 h 后,呈现明显的细胞凋亡特征性形态学变化,提示芝麻素具有抑制肿瘤细胞增殖及诱导凋亡作用。经流式细胞术采用Annexin V-FITC 与PI 双染法来测定细胞早期凋亡率是目前较为可靠的检测方法,结果显示芝麻素组出现早期凋亡细胞,提示芝麻素具有早期抑制细胞增殖和诱导细胞凋亡作用。
细胞凋亡又称程序性死亡(Programmed Cell Death,PCD)指的是在一定生理或者病理条件下主动遵循自身程序,结束生命的一个过程[5]。caspase-3和caspase-8 是重要的caspase 家族成员,它们参与了细胞凋亡过程中至关重要的环节,在细胞凋亡和caspase 家族成员的激活主要涉及到以下三条通路:第一条即内质网通路,内质网是细胞内Ca2+的储存库,一旦内质网应激时,将造成大量Ca2+释放,当胞浆内Ca2+浓度一旦升高便引发caspase 级联放大效应,最终导致细胞凋亡事件的发生,而第二条即死亡受体通路,第三条即线粒体通路也参与其中[6-7]。本研究对caspase 家族成员中caspase-3 和caspase-8 进行检测发现,芝麻素作用SW480 细胞株48 h 后caspase-3 和caspase-8 表达与阴性对照组比较均有较显著的增高,推测芝麻素诱导结肠癌细胞凋亡现象的发生可能与其激活了caspase-3 和caspase-8 有关,进而引发caspase 级联反应,最终导致细胞凋亡。
综上所述,芝麻素对人结肠癌SW480 细胞株具有抗增殖及诱导肿瘤细胞凋亡的作用,其机制可能是通过激活caspase-3 和caspase-8 从而影响凋亡通路实现。研究结果提示芝麻素具有抗结肠癌细胞作用。
[1] Peeters M,Price TJ,Cervantes A,et al.Randomized phase III study of panitumumab with fluorouracil,leucovorin,and irinotecan (FOLFIRI)compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer[J].Clin Oncol,2010,28(31):4706-4713.
[2] 刘晓康,韩欣冶,林英嘉,等.桦木醇对人结肠癌SW480细胞增殖和凋亡的影响[J].吉林大学学报:医学版,2015,41(1):39-43.
[3] 陈凤香,曹文明,曹国武,等.芝麻木脂素研究进展[J].粮食与油脂,2012(6):1-6.
[4] 白金权,车成日.芝麻素的提取及药理作用研究现状[J].延边大学医学学报,2012,35(3):229-232.
[5] Habib MR,Joel AH,Qing F.Modulation of apoptosis by nitric oxide:implications in myocardial ischemia and heart failure[J].Pharmacol Ther,2005,106(2):147-162.
[6] Apáti A,Jánossy J,Brózik A,et al.Effects of intracellular calcium on cell survival and the MAPK pathway in a human hormone-dependent leukemia cell line (TF-1)[J].Ann N Y Acad Sci,2003,1010:70-73.
[7] Dudits D,Abrahám E,Miskolczi P,et al.Cell-cycle control as a target for calcium,hormonal and developmental signals:the role of phosphorylation in the retinoblastoma-centred pathway[J].Ann Bot,2011,107(7):1193-1202.

