一种更符合临床的深静脉血栓形成大鼠模型
张朝顺,柯常江,冯起校,邱海兵,覃善君
(广东医学院附属中山医院呼吸内科,广东 中山 528415)
一种更符合临床的深静脉血栓形成大鼠模型
张朝顺,柯常江,冯起校,邱海兵,覃善君
(广东医学院附属中山医院呼吸内科,广东 中山 528415)
目的 建立一种新的更符合临床的深静脉血栓形成大鼠模型,并探讨其深静脉血栓形成机制。方法将72只SD大鼠随机分为正常对照组(N组)、假手术组(S组)及模型组(M组),每组24只。M组采用不完全阻滞左股静脉血流+注入10%高渗盐水的方法建立大鼠股静脉血栓模型。于建模后第2、6、10天分别处死各组大鼠8只,比较各组血栓形成情况,行病理学分析,并应用放免法测定各组大鼠各时间点血浆血栓素B2(TXB2)、6-酮-前列腺素F1α(6-Keto-PGF1α)及内皮素(ET)的含量。结果建模后第2、6、10天,N组和S组均未见血栓形成,M组血栓形成率明显高于N组和S组,差异均有统计学意义(P<0.05)。M组病理检查可见血栓不同时期的变化及血管再通现象,且该模型各时间点血浆TXB2、ET含量均较N、S组升高(P<0.05),而6-Keto-PGF1α含量较N、S组降低(P<0.05)。结论通过不完全阻滞股静脉血流+注入10%高渗盐水的方法,可以建立稳定的、更符合临床的深静脉血栓形成大鼠模型,该模型静脉血栓形成可能与血浆血栓素A2(TXA2)/前列环素(PGI2)比例升高及ET含量升高有关。
深静脉血栓形成;模型;大鼠;血栓素B2;6-酮-前列腺素F1α;内皮素
深静脉血栓形成(DVT)指血液在深静脉内不正常地凝结、阻塞管腔,导致静脉回流障碍,多发生于下肢深静脉。西方国家每年因DVT住院人数约65万例,死亡人数5万~20万例,台湾地区的DVT发生率约为欧美的2/3,大陆尚无对DVT发病情况的统计[1]。随着人口老龄化,DVT发病率近年来呈明显上升趋势。DVT除可能引致肺栓塞(PTE)外,尚会导致慢性静脉功能不全,引起慢性静脉溃疡、跛行等,影响患者生活质量,加重社会负担[2]。DVT病变过程复杂,为明确其发病的机制及转归,建立合适的DVT动物模型,模拟其病理生理过程,是研究DVT的重要途径。虽然目前已有多种DVT动物模型,但能很好的模拟人类DVT病理生理过程的动物模型仍较少。如何复制更符合临床的DVT动物模型,是今后推进DVT防治研究的关键。我们通过不完全阻滞左股静脉血流+注入10%高渗盐水的方法,建立了一种简单、稳定且更符合临床的大鼠DVT疾病模型,并探讨了其深静脉血栓形成机制,现报道如下:
1 材料与方法
1.1 实验动物 雄性清洁级SD大鼠72只,月龄4个月,体重300~400 g,平均(350±27)g,购自广东省医学实验动物中心,合格证号:SCXK(粤) 2008-0002。SD大鼠饲养于动物中心实验室动物房,室温18℃~25℃,房间通风良好,实验动物自由饮水及进食,适应性喂养1周后进入实验。
1.2 实验试剂 血栓素B2(TXB2)放射免疫分析药盒(批号:131220),6-酮-前列腺素F1α(6-Keto-PGF1α)放射免疫分析药盒(批号:131220),内皮素(ET)放射免疫分析药盒(批号:140102)购自北京北方生物技术研究所。
1.3 动物分组及模型的建立 72只SD大鼠,按随机原则分为3组,每组24只。N组:正常对照组;S组:假手术组;M组:模型组。N组:不作任何操作;S组:大鼠以5%水合氯醛(0.6 ml/100 g)腹腔注射麻醉,沿左腹股沟区中点行2 cm纵行切口,分离左股静脉;术毕检查周围组织无出血后缝合切口,外敷消毒纱布;M组:5%水合氯醛(0.6 ml/100 g)腹腔注射麻醉,沿左腹股沟区中点行2 cm纵行切口,分离左股静脉;在左股静脉近心端处绕以丝线不完全结扎,使血管腔缩小约1/2,以减慢血流,并自阻滞血管远端缓慢注入10%高渗盐水1 ml造成局部静脉血管壁损伤。术后动物自由饮水,正常饲料饲养,不用抗凝剂及抗生素。
1.4 标本的获取及处理 建模后第2、6、10天作为观察时间点,在各观察时间点每组各随机取8只大鼠,对大鼠麻醉(麻醉方法同前),全部大鼠心脏取血制备血浆测定TXB2、6-Keto-PGF1α、ET等各项指标,并经原切口取出病变静脉(正常对照组逐层切开皮肤、皮下,取股静脉),用10%甲醛溶液固定,制成石蜡切片,行苏木素-伊红(HE)染色,显微镜下观察组织病理学改变,并计算血栓形成阳性率。
1.5 测定指标
1.5.1 TXB2、6-Keto-PGF1α检测 心脏取血2 ml,置于含消炎痛-EDTA·Na2液0.2 ml的塑料试管中,充分混匀,4℃,3 500 r/min,离心15 min,分离血浆,放-20℃保存。测定时采用放免法按照TXB2、6-Keto-PGF1α放免试剂盒说明书严格操作。
1.5.2 ET检测 心脏取血1 ml,注入含7.5% EDTA·Na215µl和抑肽酶20µl的塑料试管中,充分混匀,4℃,3 000 r/min,离心 15 min,分离血浆,放-20℃保存。测定时采用放免法按照ET放免试剂盒说明书严格操作。
1.6 统计学方法 采用SPSS17.0统计软件进行数据分析。各组计量资料数据以均数±标准差(±s)表示,计量资料组间的比较采用单因素方差分析及q检验,计数资料组间率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 实验动物存活情况 72只受试大鼠中,S组在建模时因麻醉过量死亡1只,其余71只大鼠均存活至完成实验。
2.2 各组大鼠股静脉血栓形成率比较 光镜观察各组大鼠左股静脉血栓形成结果见表1。术后各时间点,N组和S组均未见血栓形成,术后第2、6、10天,M组大鼠股静脉血栓形成率分别为62.5%(5/8)、87.5%(7/8)、75%(6/8)。M组血栓形成率明显高于N组和S组,差异均具有统计学意义(P<0.05)。

表1 光镜观察大鼠左股静脉血栓形成结果(以静脉数表示)
2.3 各组大鼠局部股静脉的组织形态学观察 N组及S组大鼠在各时间点均无股静脉血栓形成;光镜观察见整个血管内膜表面平整,内皮细胞大小均匀、排列整齐,管腔内无血栓形成,管壁无炎性细胞浸润(图1A、B)。M组术后第2、6、10天,光镜下股静脉血栓病理形态见图1C、D、E。
2.4 各组大鼠血浆TXB2、6-Keto-PGF1α、ET的对比观察 M组各时间点血浆TXB2含量均较N、S组明显升高,差异有统计学意义(P<0.05);N组与S组各时间点血浆TXB2含量比较差异无统计学意义(P>0.05)。M组各时间点血浆6-Keto-PGF1α含量均较N、S组明显降低,差异有统计学意义(P<0.05);N组与S组各时间点血浆6-Keto-PGF1α含量比较差异无统计学意义(P>0.05)。M组各时间点血浆ET含量均较N、S组明显升高,差异有统计学意义(P<0.05);N组与S组各时间点血浆ET含量比较差异无统计学意义(P>0.05),见表2、表3和表4。
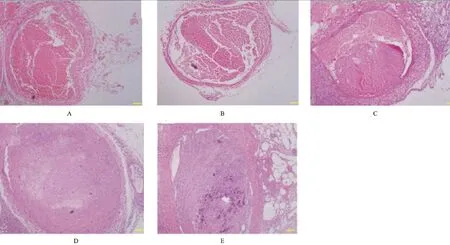
图1 各组大鼠局部股静脉的组织形态学观察(HE×100)
表2 各组大鼠时间点血浆TXB2含量(±s,pg/ml)

表2 各组大鼠时间点血浆TXB2含量(±s,pg/ml)
注:S组第2天为7只大鼠,其他各组各时间点均为8只大鼠;与正常对照组比较,aP<0.05;与假手术组比较,bP<0.05。
组别N组(n=24) S组(n=23) M组(n=24)第2天352.78±18.06 362.04±11.84 506.75±31.83ab第6天350.53±15.80 364.05±16.19 578.48±36.41ab第10天351.24±19.05 348.98±15.22 512.92±24.22ab
表3 各组大鼠各时间点血浆6-Keto-PGF1α含量(±s,pg/ml)

表3 各组大鼠各时间点血浆6-Keto-PGF1α含量(±s,pg/ml)
注:S组第2天为7只大鼠,其他各组各时间点均为8只大鼠;与正常对照组比较,aP<0.05;与假手术组比较,bP<0.05。
组别 第2天 第6天 第10天N组(n=24)161.42±16.48165.04±26.34163.25±21.33 S组(n=23)158.48±19.92162.99±27.91160.27±19.04 M组(n=24)108.45±24.58ab80.19±14.56ab105.05±22.67ab
表4 各组大鼠各时间点血浆ET含量(±s,pg/ml)

表4 各组大鼠各时间点血浆ET含量(±s,pg/ml)
注:S组第2天为7只大鼠,其他各组各时间点均为8只大鼠;与正常对照组比较,aP<0.05;与假手术组比较,bP<0.05。
N组(n=24) S组(n=23) M组(n=24) 89.77±13.51 92.36±14.14 141.41±23.64ab93.86±19.42 94.53±23.39 177.86±33.98ab92.37±24.19 90.80±20.05 144.97±26.07ab
3 讨论
DVT尤其是下肢的DVT作为住院患者的一项严重疾病及常见并发症已越来越受到重视,具有很高的致残率及致死率[3-4]。国外文献报道,DVT是继急性冠脉综合征和中风后的第三大心血管疾病,且其发病率近年来呈明显上升趋势[5]。许多DVT患者并发PTE和心血管意外从而导致严重后果[6]。因此,深入研究DVT的发病原因、致病机制以及相关的病理生理,对于改善诊治现状,降低并发症发生及死亡率,具有良好的经济和社会效益。而建立简单、价格低廉、稳定、可靠且符合临床深静脉血栓形成特点的DVT动物模型是研究该问题的基础。虽然目前已有多种DVT动物模型,但均与临床实际不尽相符,如:(1)临床DVT绝大部分为亚急性或慢性,而现有造模方法所形成的血栓均为急性;(2)现有造模方法多为完全结扎静脉以阻断静脉回流、造成血液淤滞而诱发血栓形成,这样虽然可以形成稳定的血栓,但是不能保障血栓的近心端通畅,不适合作为对溶栓及抗血栓药物动态研究的模型,也不符合人体静脉血栓的发病特点(临床绝大多数DVT发病初始并不存在静脉回流完全阻断);(3)电流损伤法、机械损伤法等均直接损伤静脉,与临床DVT几乎都未直接损伤深静脉不相符,且创伤性均较大,易引起全身应激状态而对实验模型造成干扰,不符合自然状态下的深静脉血栓形成过程;(4)注入促凝物质法与临床DVT患者多无使用促凝血药史不相符,且部分患者在使用抗凝血药时仍发生DVT。因此,有必要探索新的造模方法以制备出更符合临床的DVT动物模型。
本试验通过不完全阻滞股静脉血流+注入10%高渗盐水的方法建立了一种新的、稳定的、更符合临床深静脉血栓形成特点的大鼠DVT模型。该造模方法的血栓形成率高,形成血栓稳定可靠;与完全结扎的模型相比,此模型更符合人体DVT的病理生理学演变,且形成血栓的血管段近心端保持通畅,可有效地用于观察药物溶栓或抗栓塞作用的效果;与电流损伤法、机械损伤法等直接损伤静脉的造模方法相比,注入高渗盐水对静脉损伤较小,更符合临床DVT的发病特点;且光镜观察见模型组不同时间点形成的血栓与临床实际形成的血栓在性质和成分上相似,能很好的模拟临床DVT的病理生理演变过程。
TXA2和PGI2均为花生四烯酸的代谢产物,TXA2主要在血小板中经TXA2合成酶的作用下生成,而PGI2主要在血管内皮细胞中经PGI2合成酶的作用下生成。TXA2可以促进血小板激活、聚集,进而促进凝血和血栓形成,收缩血管并刺激平滑肌细胞增殖;PGI2则相反,具有很强的抑制血小板聚集的作用,它不仅预防血栓的形成,甚至能消除己经存在的血小板聚集,其作用机制是通过细胞内第二信使激活一系列酶使血小板内TXA2合成减少,从而抑制血小板聚集,PGI2还有舒张血管和抑制平滑肌细胞增殖的作用[7]。在生理状态下,循环血液中TXA2和PGI2的浓度处于相对平衡状态,两者共同调节血小板聚集和血管舒缩,对维持血流通畅和血管正常张力具有重要意义。当血栓阻塞血管时,血管内皮层损伤部位聚集血小板可释放TXA2,浓度显著升高,TXA2/PGI2比例明显高于平时,提示TXA2浓度升高和TXA2/PGI2的平衡失调,与血管痉挛、血小板聚集或血栓形成有密切的关系。因为二者的半衰期仅数分钟,TXA2很快被水解为无活性的TXB2,而PGI2被迅速氧化为6-Keto-PGF1α而难以直接测定,所以一般用放免法测定血浆TXA2和PGI2的稳定代谢产物TXB2和6-Keto-PGF1α以代表其含量。本实验结果显示:模型组大鼠血浆TXB2水平明显升高,而6-Keto-PGF1α水平明显降低,与正常对照组、假手术组比较差异显著。提示该造模方法可引致大鼠机体产生以下一系列病理改变:大鼠股静脉不全结扎,造成局部血流缓慢,当静脉输入10%高渗盐水时,血浆渗透压升高,使血管内皮细胞脱水、低氧、充血、水肿,从而损伤血管内皮,暴露胶原纤维,触发内源性凝血过程[8];血小板聚集于损伤内皮部位,释放TXA2,损伤血管内皮,PGI2生成减少,导致TXA2/PGI2比例明显高于平时;而TXA2浓度升高和TXA2/PGI2的平衡失调又进一步加重血管痉挛、血小板激活、聚集和血栓形成。
ET主要由粒细胞、巨核细胞分泌,参与广泛的生理病理过程的调控,对细胞功能、炎症反应等具有重要作用,通过影响内皮细胞等改变血管功能和结构。ET是1988年首先由日本学者Yanagisawa等从培养的猪主动脉内皮细胞的上清液中分离纯化获得的,是一种含有21个氨基酸的血管活性肽,共有4个亚型,即ET-1、ET-2、ET-3和ET-4,是目前己知的作用最强的血管收缩因子[9]。血管损伤是DVT形成的主要原因之一,而血管内膜的损伤是DVT形成的启动因素。完整的血管内膜具有良好的抗血栓功能,当内皮细胞受损后,ET合成增加,血浆ET含量增加,血管内膜抗凝功能减弱,致使凝血和抗凝功能动态平衡失调,最终导致血栓形成,所以血浆ET含量增加是在DVT形成过程中血管内膜细胞损伤的直接反映和客观指标。本实验结果显示:模型组大鼠血浆ET水平明显升高,提示10%高渗盐水损伤了血管组织,血管各系统反应性的释放ET,导致血液中ET增多,血管张力增大,血管痉挛,血流缓慢,从而促进了血栓形成。
综上所述,通过不完全阻滞股静脉血流+注入10%高渗盐水的方法可以建立稳定的大鼠DVT疾病模型,与完全结扎的模型比较,此模型更符合人体DVT的病理生理学演变,更适用于DVT的基础研究。该模型静脉血栓形成可能与血浆TXA2/PGI2比例升高及ET含量升高有关,提示临床上动态监测血浆TXB2、6-Keto-PGF1α、ET含量可能有助于DVT的早期诊断。
[1]王鸿利,王学锋.血栓病临床新技术[M].北京:人民军医出版社, 2003:25.
[2]Delis KT,Bountouroglou D,Mansfield AO.Venous claudication in iliofemoral thrombosis:long-term effects on venous hemodynamics,clinical status,and quality of life[J].Ann Surg,2004,239(1): 118-126.
[3]Abad Rico JI,Llau Pitarch JV,Rocha E.Overview of venous thromboembolism[J].Drugs,2010,70(Suppl 2):3-10.
[4]Torbicki A,Perrier A,Konstantinides S,et al.Guidelines on the diagnosis and management of acute pulmonary embolism:the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology(ESC)[J].Eur Heart J,2008,29:2276-2315.
[5]Theodorou SJ,Theodorou DJ,Kakitsubata Y.Sonography and venography of the lower extremities for diagnosing deep vein thrombosis in symptomatic patients[J].Clin Imaging,2003,27:180-183.
[6]Nilsson-Helander K,Thurin A,Karlsson J,et al.High incidence of deep venous thrombosis after Achilles tendon rupture:a prospective study[J].Knee Surg SportsTraumatolArthrosc,2009,17:1234-1238.
[7]刘泽霖,贺石林,李家增.血栓性疾病的诊断与治疗[M].北京:人民卫生出版社,2000:126-127.
[8]朱 姝,黎贵湘,兰 霞.高渗性药物致静脉炎的防治进展[J].护理与康复,2012,11:135-137.
[9]张 漓,胡 扬.运动对血液内皮素-1的影响及其在血液重新分配中的作用[J].中国运动医学杂志,2011,30(6):583-590.
A rat model of deep venous thrombosis more consistent with the clinical practice.
ZHANG Chao-shun,KE Chang-jiang,FENG Qi-xiao,QIU Hai-bing,QIN Shan-jun.Department of Respiratory Diseases,the Affiliated Zhongshan Hospital of Guangdong Medical College,Zhongshan 528415,Guangdong,CHINA
Objective To establish a rat model of deep venous thrombosis which is more consistent with the clinical practice,and to investigate the possible mechanism of deep venous thrombosis.MethodsSeventy-two Sprague-Dawley rats were randomly and equally divided into 3 groups(N,S,M),with group N defined as control group.The rats in the group S underwent sham operation.In the group M,the left femoral vein of the rats was incompletely ligated in combination with injection of 10%hypertonic saline from the distal end of the incompletely ligated femoral vein.On the 2nd, 6thand 10thday,8 rats from each group were sacrificed,the femoral vein was collected for observing the formation of the thrombosis and pathological analysis,and the plasma contents of thromboxane B2(TXB2),6-keto-prostaglandin F1α(6-keto-PGF1α)and endothelin(ET)were measured by radioimmunoassay.ResultsOn day 2,6 and 10,no thrombosis was observed in group N or group S.The rate of thrombosis formation in group M(62.5%,87.5%and 75%on day 2, 6 and 10)was significantly higher than those in group N and group S(P<0.05).The changes of thrombosis at different periods and the vascular recanalization were observed by pathological examination in group M.At each time point, the plasma contents of TXB2and ET in group M were significantly higher than those in group N and group S(P<0.05),and the plasma content of 6-keto-PGF1αin group M was significantly lower than those in group N and group S(P<0.05).ConclusionA rat model of deep venous thrombosis which is stable and more consistent with the clinical practice can be established by incomplete ligature of the femoral vein combined with injection of 10%hypertonic saline from the distal end of the incompletely ligated femoral vein.The formation of thrombosis in the model may be associated with the thromboxane A2(TXA2)/Prostacyclin(PGI2)ratio increased and the content of ET increased in rat plasma.
Deep vein thrombosis;Models;Rat;TXB2;6-Keto-PGF1α;Endothelin(ET)
R-332
A
1003—6350(2015)05—0625—05
10.3969/j.issn.1003-6350.2015.05.0226
2014-08-26)
广东省医学科研课题(编号:B2011366);中山市科技计划项目(编号:20113A096)
冯起校。E-mail:zhangcs790622@163.com

