HPLC法测定宜昌胡颓子根中槲皮素的含量*
杨林 谢瑶 孙志伟 秦文
胡颓子属(Elaeagnus L)植物在全世界约有80余种,在我国约有55种,是胡颓子科中种类最多,分布最广的属,其主要分布在长江流域及其以南地区,植物资源比较丰富[1-2]。和沙棘属植物相比,胡颓子属植物资源更为丰富,其中很多品种除了具有药食两用价值外,还具有环保价值和观赏价值。目前针对胡颓子属的植物资源研究,国内主要围绕其生药学、分布学等方面,国外则更侧重于分子生物学和其共生根瘤菌的研究[3-4]。
宜昌胡颓子为胡颓子科胡颓子属常绿灌木,又名羊奶子、红鸡踢香。宜昌胡颓子集食用、药用和观赏价值于一体,是非常珍贵的药食两用植物。其果实含有丰富的钾,可调节人体的血液渗透压,可作为饮料补充人体的无机盐损失。其根、叶和果实均可入药,常用于治疗肺虚气短、疥疮、痢疾、吐血、脑血栓等疾病[5]。同时宜昌胡颓子容易修剪,外形漂亮,常作为庭院观赏植物。
近年来随着人们对胡颓子属植物的关注和深入研究,其更多的药用价值和经济价值被人们所发现。虽然对胡颓子属植物的次生代谢产物的研究在国外有了一定进展,而国内却少有人探究,尤其是对宜昌胡颓子的研究更少,主要集中在生药学、栽培种植和药用价值等方面[6-8]。除了少量关于微量元素成分及挥发油的分析研究外,药理作用和化学成分的研究报道少之又少[9-13]。因此,为进一步推动我国胡颓子属植物资源的更深层次利用和开发,本文采用高效液相色谱(HPLC)法对宜昌胡颓子根中的槲皮素含量进行了测定,以期为该品的质量评价、质量控制及进一步开发利用提供一定的科学依据,为今后更好综合利用开发宜昌胡颓子的植物资源提供参考,现具体报道如下。
1 材料与方法
1.1 实验材料 Agilent1200高效液相色谱仪,Agilent G1314 VWD检测器,HP化学工作站(美国Agilent公司);Sartorius BT224S电子天平(北京赛多力斯仪器公司);BNX-1000超声波清洗仪(苏州比能信电气有限公司)。胡颓子根采自湖北宜昌市秭归县,经湖北三峡职业技术学院杨先哲副教授鉴定为真品,标本现存于湖北三峡职业技术学院药学标本室。槲皮素对照品(中国食品药品检定研究院,批号:100081-200908);甲醇为色谱纯(美国Tedia公司),其他试剂均为分析纯,水为自制重蒸馏水。
1.2 方法
1.2.1 色谱条件 色谱柱:Agilent Promosil C18(250 mm×4.6 mm,5 μm);流动相为:甲醇(A)-0.1%磷酸水溶液(B);洗脱程序:0~35 min,流动相A相的比例由38%上升至95%;流速1 mL/min;检测波长238 nm;柱温30 ℃,进样量10 μL。
1.2.2 对照品溶液的制备 (1)对照品储备液的制备:精密称取槲皮素对照品10 mg,置100 mL容量瓶中,加入甲醇溶解并稀释至刻度,摇匀,即得。(2)对照品溶液的制备:精密量取对照品储备液2.5 mL,置10 mL容量瓶中,加入甲醇溶解并稀释至刻度,摇匀,即得。1.2.3 供试品溶液的制备 将宜昌胡颓子根干燥并粉碎,过60目筛。称取宜昌胡颓子根干粉4.0 g置于50 mL烧瓶中,先用32 mL石油醚于50 ℃回流提取1.5 h,滤过;滤渣中再加入24 mL石油醚于50 ℃回流提取1 h,减压过滤,收集滤液,挥干石油醚,干燥,备用[14]。精密称取上述方法脱脂的胡颓子根粉末约1.0 g,精密称定,置圆底烧瓶中,精密加入25%盐酸-75%乙醇(1:4)混合溶液50 mL,称定重量,加热回流1.5 h,放冷,再称定重量,用75%乙醇补足失重,摇匀、滤过,取续滤液,即得供试品溶液。
1.2.4 HPLC法各项性能检测 (1)系统适用性:取供试品溶液和对照品溶液各10 μL,按“1.2.1”条色谱条件检测。(2)线性关系:精密吸取对照品储备液1.0、2.0、3.0、4.0和 5.0 mL,,分别置 10 mL容量瓶中,加入甲醇溶解并稀释至刻度,摇匀,得系列标准溶液,按“1.2.1”条色谱条件测定,以槲皮素峰面积A为纵坐标,质量浓度ρ为横坐标,进行线性回归。(3)精密度:精密吸取上述对照品溶液10 μL,连续进样5次,按“1.2.1”项色谱条件测定。(4)稳定性:取“1.2.2”项下供试品溶液,分别于制备后第0、2、4、6、8 h进样,每次10 μL,按“1.2.1”项下色谱条件测定。(5)重复性:称取5份同一批宜昌胡颓子根粉末各约1 g,精密称定,分别按“1.2.3”项下方法平行制备5份供试品溶液,再按“1.2.1”项下色谱条件测定峰面积并计算样品含量。(6)加样回收率:取已知槲皮素含量(1.27 mg/g)的胡颓子根粉末各约1.0 g,精密称定,照“1.2.2”项下方法制备供试品溶液,总共9份,分别精密加入对照品储备液2、2.5、3 mL,各3份,按“1.2.1”项下色谱条件分析,计算回收率。
1.3 统计学处理 采用SPSS 18.0统计学软件进行线性回归分析。
2 结果
HPLC法各项性能均较好,(1)系统适用性:槲皮素对照品与其他色谱峰分离良好,理论板数大于5000(图1)。(2)线性关系:其回归方程为A=23931ρ+54.3,相关系数r=0.9999,表明在10~50 μg/mL范围内槲皮素质量浓度ρ与峰面积A值呈良好的线性关系。(3)精密度:计算槲皮素峰面积的RSD为0.03%,表明方法精密度良好。(4)稳定性:计算槲皮素峰面积的RSD为1.02%,表明供试品溶液在室温放置8 h稳定性良好。(5)重复性:样品平均含量为1.27 mg/g,RSD=1.68%,表明该方法重复性良好。(6)加样回收率:平均回收率为99.66%,RSD=0.67%,见表1。

图1 高效液相色谱图注:A为对照品,B为供试品
3 讨论
3.1 流动相选择 本实验采用甲醇-水、甲醇-0.1%磷酸溶液、乙腈-水和乙腈-0.1%磷酸等多种配比的流动相进行比较,结果显示,使用乙腈-水体系时,出峰时间较早,峰形较钝。当采用洗脱能力较弱,黏度较大的甲醇-水体系洗脱时,各峰分离度显著提高。为了进一步使峰形改善,笔者在流动相中使用了磷酸溶液,结果显示当磷酸的体积分数达到0.1%时,各峰峰形对称,且分离度均大于2.0,故确定甲醇-0.1%磷酸溶液为流动相。
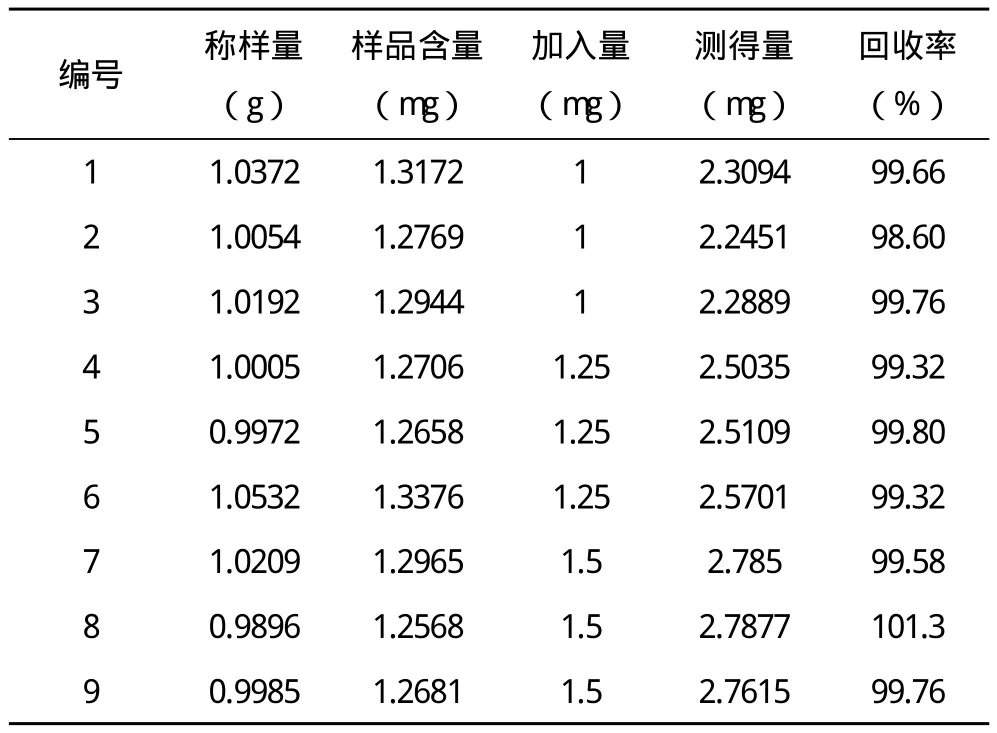
表1 加样回收率试验结果
3.2 梯度洗脱依据 当采用等度洗脱时,槲皮素的分离度和理论踏板数并不理想,相邻色谱峰之间分离度≤1.2,而改用梯度洗脱后槲皮素峰的分离效果显著提高,理论塔板数大于6000,相邻色谱峰间分离度良好,保留时间适中,故确定使用梯度法进行洗脱[15-16]。
3.3 最大吸收波长的选择 笔者对槲皮素对照品溶液与宜昌胡颓子根供试品溶液分别进行了紫外吸收光谱扫描,结果发现二者均在238 nm波长附近有最大吸收,故确定检测波长为238 nm。
3.4 宜昌胡颓子粗粉的处理 宜昌胡颓子中的挥发油是宜昌胡颓子中一类含量较高的成分,如果采取醇直接提取宜昌胡颓子中的黄酮类成分,不仅导致黄酮类成分提取不充分,也无法保证HPLC测定时进样量的一致。因此本实验中,笔者采用石油醚预先脱去宜昌胡颓子根干粉中的油脂,可提高黄酮类化合物的提取率和测定的准确性[17]。
3.5 供试品溶液的制备方法及提取溶剂的选择 由于宜昌胡颓子中槲皮素主要以苷的形式存在,经醇直接提取后进行HPLC测定,含量将无法达到HPLC的最低检测限要求,故必须经过酸水解将苷转化为苷元后再进行测定[18]。因此,在提取过程中,采用盐酸将苷完全转化为苷元后再进行HPLC测定,槲皮素含量显著提高。本实验结果表明,用25%盐酸-75%乙醇(1∶4)提取的槲皮素含量较高,色谱峰分离度好,故选用25%盐酸-75%乙醇(1∶4)作为提取溶剂[19]。
湖北拥有丰富的胡颓子资源,但没有现成的标准对宜昌胡颓子进行质量控制,本文采用HPLC法测定槲皮素的含量,方法简便、准确、重复性好,为完善和提高宜昌胡颓子的质量控制标准提供了科学的依据。
[1] Delectis Florae Reipublicae Popularis Sinicae Agendae Academiae Sinicae Edita.Flora Reipublicae Popularis Sinicae[M].Tomus 52(2).Beijiing:Science Press,1983.
[2] Editorial Braod of Tradition Chinese Medicine.Dictionary of China Herbal[M].Beijing:China Medico-pharmaceutical Science and Technology Publishing House,2000.
[3]彭国权,季梦成.江西属植物资源及开发利用研究[J].江西农业大学学报,2004,26(1):64-67.
[4]陈新.川渝地区胡颓子属药用植物资源研究[J].成都中医药大学学报,2001,24(2):40-42.
[5]陆俊,王珺,成策,等.胡颓子属植物化学成分与药理活性研究进展[J].中药材,2015,38(4):855-861.
[6] Bekker N P,GlushenkovaA I.Components of certain species of the Elaeagnaceae family[J].Chemistry of Natual Compound,2001,37(2):97-116.
[7]蔡毅,姜建萍,朱意麟,等.红鸡踢香的显微结构研究[J].广西中医学院学报,2004,7(4):47-49.
[8]叶选件,寿平台.庆元县胡颓子属植物资源及其利用[J].现代农业科技,2009,37(4):76-78.
[9]吴彩霞,邢煜君,曹乃锋,等.宜昌胡颓子根挥发性成分的HSSPME-GC-MS研究[J].中国实验方剂学杂志,2010,16(10):53-55.
[10]赵鑫,黄浩,朱瑞良.中药胡颓子叶的脂溶性化学成分研究[J].中成药,2006,28(3):403-405.
[11]贾献慧,王晓静,牟忠祥,等.中药胡颓子叶的挥发油成分分析[J].中成药,2009,31(6):947-948.
[12]黄浩,赵鑫,姜标.胡颓子科植物化学成分研究概况[J].中草药,2006,37(2):307-309.
[13]李孟顺,廖矛川,葛月宾,等.胡颓子叶水溶性化学成分的研究[J].中国药学杂志,2012,370(9):1224-1226.
[14]侯霄.正交实验法优化沙棘黄酮的提取工艺[J].国际沙棘研究与开发,2010,8(3):21-36.
[15]刘亚蓉.HPLC法同时测定沙棘膏中槲皮素、山奈酚和异鼠李素的含量[J].药物分析杂志,2008,28(5):759-762.
[16]樊鑫梅,申雪丽,闫丽丽,等.高效液相色谱法同时测定沙棘果中槲皮素、山奈酚和异鼠李素的含量[J].中国医院药学杂志,2012,32(17):1343-1346.
[17]王树林.沙棘叶黄酮提取工业研究[J].食品研究与开发,2008,29(8):110-113.
[18]左小川,李建萍,曾晓瑜.醋柳黄酮的水解条件研究[J].中国药业,2008,17(15):23-24.
[19]黄丽杰,崔永霞,刘伟,等.HPLC法同时测定胡颓子叶中槲皮素和山奈酚[J].中成药,2015,37(6):1302-1305.

