乳清“发泡酒”发酵菌株选育及发酵工艺研究
郭宝帅,刘秀河*
(齐鲁工业大学轻工学部 食品科学与工程学院,山东 济南 250353)
“发泡酒”是以乳清作为原料,利用酸奶生产技术与啤酒技术而制成的一种低醇、含二氧化碳高级乳制饮品,是将现代生物技术应用到饮料中的一次尝试。乳酸菌降解奶中的乳糖、蛋白质以及脂肪,产生易于吸收的单糖、挥发脂肪酸和游离氨基酸等代谢物,为酵母菌提供了能量来源。酵母菌能赋予饮料特殊的酒香味与二氧化碳气体,使其具有普通饮料所没有的爽口感和风味[1-2]。乳清是一种黄绿色液体,每生产1 t干酪要消耗约10 t鲜牛奶,而分离出约9 t乳清,全世界大约47%的乳清排入湖泊河流或泥土里,乳清的处理是奶酪生产者面临的一个重大难题[3-4]。乳清保留了牛奶55%的营养成分,乳清中的蛋白质约为牛奶里蛋白质的20%,乳清蛋白主要包括α-乳白蛋白(13%)、β-乳球蛋白(58%),少量的免疫球蛋白、血清蛋白及朊蛋白等,而牛奶里的矿物质、维生素和乳糖几乎全部保留在乳清中,因此乳清具有很高的生物学价值[5-7]。乳清经发酵后可产生必需氨基酸、生物活性肤和乳酸或乙醇,赋予其丰富的营养,能调节神经系统和循环系统,促进新陈代谢,对心脏病、胃肠病、糖尿病有独特疗效,有向保健食品方向发展的潜力[8-9]。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌种
乳清:山东省农科院兴牛乳业有限公司提供,马苏干酪副产物。
啤酒酵母2399:齐鲁工业大学啤酒酿造中心提供;葡萄酒酵母:齐鲁工业大学葡萄与葡萄酒酿造研究所提供;白酒酵母1300:齐鲁工业大学微生物实验室提供;乳酸菌帝斯曼MY1821(规格,0.1 U;批号2013-7-13,简称M菌):齐鲁工业大学食品学院提供。
1.1.2 培养基和试剂
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g/L,酵母膏粉10 g/L,胰蛋白胨10 g/L,pH 5.8~6.2,121 ℃灭菌20 min。
MRS培养基:葡萄糖20 g/L,牛肉膏10 g/L,酵母膏粉5 g/L,胰蛋白胨10 g/L,醋酸钠5 g/L,吐温80 0.1 g/L,柠檬酸二铵2 g/L,硫酸锰0.28 g/L,硫酸镁0.58 g/L,pH 6.2~6.4,121 ℃灭菌15 min。
乳糖培养基:乳糖20 g/L,酵母膏粉10 g/L,胰蛋白胨20 g/L。
麦芽汁培养基:新鲜麦芽汁200 mL在65 ℃水浴糖化3 h,加水400 mL,调匀至生泡沫,将糖化液用4层纱布滤至澄清,并稀释到5~6°Bé,pH 6.4,121 ℃灭菌30 min。
酵母膏粉(生化试剂):北京奥博星生物技术有限公司;硫酸镁、氯化钠(分析纯):天津市大茂化学试剂厂;胰蛋白胨(生化试剂):国药集团化学试剂有限公司;葡萄糖(分析纯):天津市广成化学试剂有限公司;1%乳糖酶(100 U/g);邻苯二甲酸氢钾(分析纯):南京化学试剂股份公司;磷酸二氢钠(分析纯):天津博迪化工股份公司;脱脂乳清粉:芬兰维利奥有限公司。
1.2 仪器与设备
pHS-3C精密pH计:上海三北仪表厂;YXQ-LS-50G立式压力蒸汽灭菌器:上海博讯有限公司;CP114电子天平:奥豪斯仪器(上海)有限公司;TDL-40B低速离心机:上海安亭科学仪器厂;XW-80A漩涡混合器:上海精科实业有限公司;GNP-9270隔水式电热恒温培养箱:上海奥铮仪器;SGD-IV全自动还原糖测定仪:山东省科学院;UF-中空纤维超滤装置:华泰净化工程有限公司。
1.3 方法
1.3.1 测定方法
酸度:采用滴定法,用标定好的0.1 mol/L 的NaOH 溶液滴定测定酸度,然后折算为乳酸含量;乳糖含量:莱因-埃农法测定;还原糖含量:全自动还原糖测定仪测定;酒精度:采用比重法。
1.3.2 乳清处理
采用的原料是生产干酪后剩余的乳清。膜分离技术是乳制品工业中日益受到重视的一种新型分离技术,具有很多优点,操作简单,条件温和[10-11]。采用中空纤维超滤装置对乳清液进行浓缩处理。膜出口压力为0.2 MPa,浓缩温度为30 ℃,浓缩时间为150 min,平均透液通量约为20 kg/(m2·h)。原乳清液与浓缩液中主要成分含量见表1。

表1 乳清液与浓缩液的主要成分Table 1 Main components of whey and concentrated solution %
1.3.3 菌种组合筛选及发酵菌株构建
(1)酵母菌的活化与培养
将白酒酵母1300、啤酒酵母2399和葡萄酒酵母分别接入YPD培养基,28 ℃培养20 h,并观察生长情况。将生长良好的酵母菌分别取3环,放入含适量生理盐水的离心管中,低速离心10 min,除去上清液并加入生理盐水混匀,再离心,除去上清液,加入适量生理盐水混匀,取0.1 mL菌悬液于YPD和乳糖培养基中涂布平板,28 ℃培养观察。用麦芽汁培养基对酵母菌分别进行扩大培养。
(2)乳酸菌的活化与筛选
活化培养:将S菌种和M菌种取适量,分别加2.5 mL生理盐水稀释混匀,取0.1 mL稀释液接于MRS培养基中,37 ℃恒温活化培养。
乳酸菌菌种筛选[12]:将稀释后的乳酸菌液接种于MRS培养基,无氧条件37 ℃培养。将生长良好的单菌落进行划线分离并分别接种,再次分别进行无氧条件和有氧条件培养,并将生长良好菌种标记后保存。
1.3.4 工艺流程
乳清→超滤处理→乳酸发酵→添加乳糖酶→酒精发酵→补加氮源→杀菌冷却→包装
1.3.5 发酵条件优化
两种乳酸菌不同比例对发酵的影响:杆状乳酸菌和球状乳酸菌在生长的过程中具有共生效应,两者的混合比例对产品的品质影响很大,常见的比例为1∶1或1∶2[12-13]。分别取1 L乳清液,按杆菌M-2b和球菌M-1a不同比例(1.0∶2.0、1.0∶1.8、1.0∶1.6、1.0∶1.2、1.0∶1.0、1.0∶0.8、1.0∶0.6)接入10%乳酸菌。42 ℃培养4 h后,加入1.0%乳糖酶溶液以及5.0%酵母菌,30 ℃发酵10 h,测定酒精度及酸度。
乳酸菌接种量对发酵影响:乳酸菌的接种量影响产品的风味。分别取1 L乳清溶液接入不同梯度的乳酸菌6%、8%、9%、10%、11%、12%、14%。42 ℃培养4 h后,加入1.0%乳糖酶溶液以及5.0%酵母菌,30 ℃发酵10 h,测定酒精度及酸度。
乳糖酶添加量对发酵影响:因酵母不直接发酵乳糖,会影响乳清在发酵中的利用,故添加乳糖酶将乳糖分解为葡萄糖和半乳糖。乳糖酶在不同条件下对乳糖水解程度差别很大,确定最佳的乳糖酶添加量以提高乳清的利用率。分别取1 L乳清溶液,接入10%乳酸菌(杆菌∶球菌=1.0∶1.0),42 ℃培养4 h后,分别加入不同梯度的乳糖酶溶液(0.80%、0.90%、0.95%、1.00%、1.05%、1.10%、1.20%)和5.0%酵母菌液,30 ℃发酵10 h,测定酒精度及酸度。
胰蛋白胨添加量对发酵影响:酵母菌进行酒精发酵到一定阶段,由缺乏氮源而导致酵母菌停止生长,使最终产品酒精度偏低,所以需要补加氮源使酵母菌能正常生长发酵,后期氮源采用补差法添加[14]。根据原始乳清测定的氮含量,以及胰蛋白胨溶液的含氮量进行适量补充。分别取1 L乳清溶液,接入10%乳酸菌(杆菌∶球菌=1∶1),42 ℃培养4 h后,分别加入不同梯度(3.5%、4.0%、4.5%、5.0%、5.5%、6.0%、6.5%)的胰蛋白胨溶液,同时加入1.0%乳糖酶溶液和5.0%酵母菌,30 ℃发酵10 h,测定酒精度及酸度。
酵母菌接种量对发酵影响:酵母菌的接种量对产品酒精度会有直接的影响,其接种量多少需要适当控制。分别取1 L乳清溶液,接入10%乳酸菌(杆菌∶球菌=1.0∶1.0),42 ℃培养4 h后,加入1.0%乳糖酶溶液,分别接入不同梯度的酵母菌(3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6.0%),30 ℃发酵10 h,测定酒精度及酸度。
1.3.6 发酵工艺条件优化正交试验
选用杆菌M-2b和球菌M-1a两种乳酸菌以及啤酒酵母2399进行乳酸发酵和酒精发酵,其中两种乳酸菌的配比为1.0∶1.0。在单因素试验基础上以乳酸菌接种量、乳糖酶添加量、胰蛋白胨添加量和酵母菌接种量4个参数作为试验因素,设计L9(34)正交试验,以酒精度为评价指标,确定其最佳发酵条件。
1.3.6 产品的稳定性
(1)稳定剂的选择
发酵后的乳清产品经放置一段时间后,由于物质的密度不同,产品呈现不均匀状态,容易出现分层。为了使产品更加稳定,必须适当加入一些稳定剂。分别选择羧甲基纤维素、海藻酸钠、黄原胶、明胶作为稳定剂进行试验。以空白试验为对照,以沉淀率为评价指标,考察不同稳定剂及添加量对产品稳定性的影响。
沉淀率的测定:将添加不同稳定剂的乳清饮料放置于10 mL离心管,5 000 r/mim离心20 min,并称量沉淀物,沉淀率越大则稳定性越差。按如下公式计算沉淀率[15]:

(2)产品稳定系数的测定
向适量乳清发酵产品中添加0.35%的黄原胶,分别加入不同量的蔗糖酯(0.02%、0.04%、0.06%、0.08%、0.10%、0.12%、0.14%、0.16%),并稀释50倍。利用分光光度计在波长540 nm处测定其吸光度值为A1,然后将添加不同量蔗糖酯的产品,3 500 r/min离心20 min,取中间清液并稀释50倍,并在相同条件下测其吸光度值为A2。用稳定系数来表示产品的稳定性和乳化性。稳定系数越大则表示稳定性和乳化性越好。稳定系数按如下公式计算[16]:

式中:A1、A2分别为离心前后发酵液的吸光度值。
2 结果与分析
2.1 单因素试验结果
2.1.1 两种乳酸菌不同比例对发酵的影响
在混合乳酸菌的接种量为9%,酵母菌的接种量为5.0%条件下,考察两种乳酸菌的不同配比对产品发酵效果的影响,结果见图1。

图1 两种乳酸菌接种比例对发酵产品酒精度和酸度的影响Fig.1 Effect of two different lactic acid bacteria inoculum ratio on alcohol content and acidity of the products
由图1可知,随着杆状菌M-2b占比的增加最终发酵产品的酸度呈增加趋势,而酒精度先提高后下降。这可能是因为杆状菌M-2b比球状菌M-1a的产酸能力强,故随着其占比的增加产品酸度增加。由于乳酸菌与酵母菌的相互作用机理,而杆状菌M-2b的繁殖能力较强,故当菌M-2b的占比超过50%后会加快碳源消耗而导致酒精度有所下降。故选两种乳酸菌种比例为1.0∶1.0,该条件下产品酒精度为0.53%vol,酸度为1.014%。
2.1.2 乳酸菌接种量对发酵影响
乳酸菌的接种量不仅影响产品的品质,还对产品的酸度和酒精度有直接影响。在乳酸菌的比例为1.0∶1.0,酵母菌的接种量为5.0%条件下,考察乳酸菌的接种量对产品发酵效果的影响,结果见图2。

图2 乳酸菌接种量对发酵产品酒精度和酸度的影响Fig.2 Effect of lactic acid bacteria inoculum on alcohol content and acidity of the products
由图2可知,随着乳酸菌接种量的增加,发酵产品的酒精度会越来越小,而酸度会越来越大。这是因为发酵过程中乳酸菌和酵母菌存在竞争作用,随着乳酸菌接种量的增加,会加强乳酸发酵过程而降低酒精发酵过程。在保证产品酸度的前提下选择较高的酒精度[17]。故选择乳酸菌接种量为10.0%,此时产品酒精度为0.50%vol,酸度为0.996%。
2.1.3 乳糖酶添加量对发酵的影响
酵母菌无法直接利用乳糖,添加乳糖酶分解乳糖以提高乳清的利用率。考察乳糖酶的添加量对产品发酵效果的影响,结果见图3。

图3 乳糖酶添加量对发酵产品酒精度和酸度的影响Fig.3 Effect of lactase addition on alcohol content and acidity of the products
由图3可知,乳糖酶添加量的增加对产品酸度无明显影响,但总体呈下降趋势。下降趋势是因为乳糖分解会影响乳酸菌的生长代谢而影响其产酸能力。随着乳糖酶添加量的增加,产品的酒精度呈明显增加趋势后有所下降。可能是因为乳糖酶分解乳糖为酵母菌提供了充足碳源,促进了酒精的产生,又因为酵母菌与乳酸菌存在竞争机制而导致酒精度有所降低[18]。在乳糖酶添加量为0.95%时酒精度最高,为0.55%vol,其产品酸度为1.024%。因此,乳糖酶最适添加量为0.95%。
2.1.4 胰蛋白胨添加量对发酵影响
发酵后期由于氮源的缺乏会限制酵母菌的生长代谢,适当添加胰蛋白胨有助于改善产品的品质和提高其酒精度。考察胰蛋白胨添加量对产品发酵效果的影响,结果见图4。
由图4可知,随着胰蛋白胨添加量的增加,产品的酒精度和酸度都有所增加。这是因为及时补加了氮源,保证了乳酸菌与酵母菌的生长,但是由于乳酸菌与酵母菌的互生机理以及碳源等其他因素的限制,酒精度的增加幅度有限。当胰蛋白胨添加量为5.0%时,产品的酒精度最高,为0.6%vol,酸度为1.046%。因此,胰蛋白胨最适添加量为5.0%。

图4 胰蛋白胨添加量对发酵产品酒精度和酸度的影响Fig.4 Effect of tryptone addition on alcohol content and acidity of the products
2.1.5 酵母菌接种量对发酵的影响
酵母菌的接种量直接影响了产品的酒精度,考察不同酵母菌接种量对产品发酵效果的影响,结果见图5。
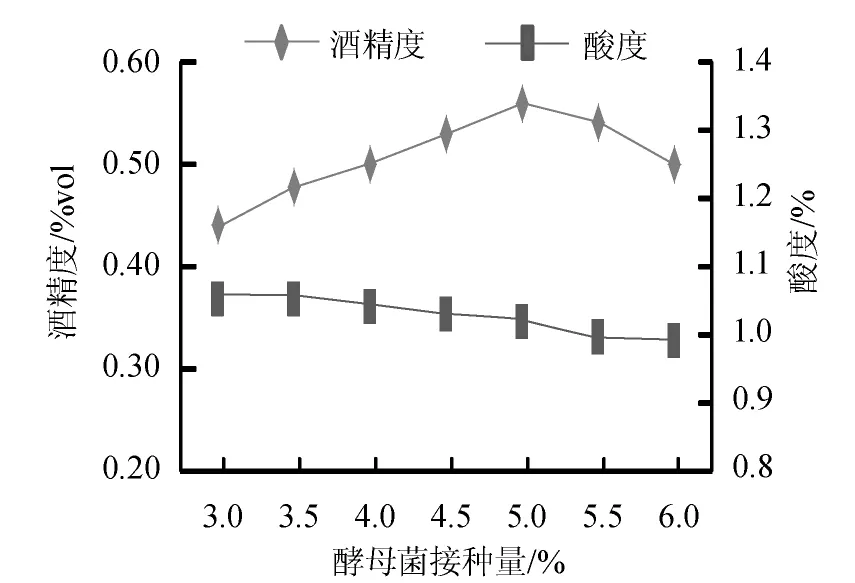
图5 酵母菌接种量对发酵产品酒精度和酸度的影响Fig.5 Effect of yeast inoculums on alcohol content and acidity of the products
由图5可知,随着酵母菌的接种量的增加,发酵产品的酸度越来越低,酒精度先提高后降低。因为酵母菌接种量的不断加大会限制乳酸菌的生长繁殖,故产品酸度会降低。而当酵母菌接种量偏大,则酵母菌的“疲劳”现象越快出现,会使酒精度降低。当酵母菌接种量为5.0%时,产品的酒精度最高,为0.56%vol,酸度为1.016%。因此,酵母菌接种量5.0%为宜。
2.2 正交试验结果与分析
在单因素试验基础上,以酒精度为评价指标,考察胰蛋白胨添加量、乳糖酶添加量、乳酸菌(杆菌∶球菌=1.0∶1.0)接种量及酵母菌接种量对产品发酵效果的影响,正交试验结果与分析见表2。
由表2可知,各因素对产品还原糖含量的影响作用依次为B>A=D>C,其中乳糖酶添加量对产品的酒精度有较大影响。最佳组合为A2B2C2D2,即乳清“发泡酒”的最佳发酵条件为乳酸菌(杆菌∶球菌=1∶1)接种量10%,乳糖酶添加量0.95%,胰蛋白胨添加量5.0%和酵母菌接种量5.0%。该最佳发酵条件下产品的酒精度为0.68%vol,酸度为1.036%。

表2 发酵工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal tests for fermentation process optimization
2.3 产品的稳定性
2.3.1 稳定剂的选择
稳定剂不仅能够增加产品的黏度,而且在蛋白质分子外围形成了一层保护膜,在pH 3.6~4.6内防止蛋白质发生沉淀,并适当提高产品的口感[17]。不同稳定剂的稳定效果见表3。
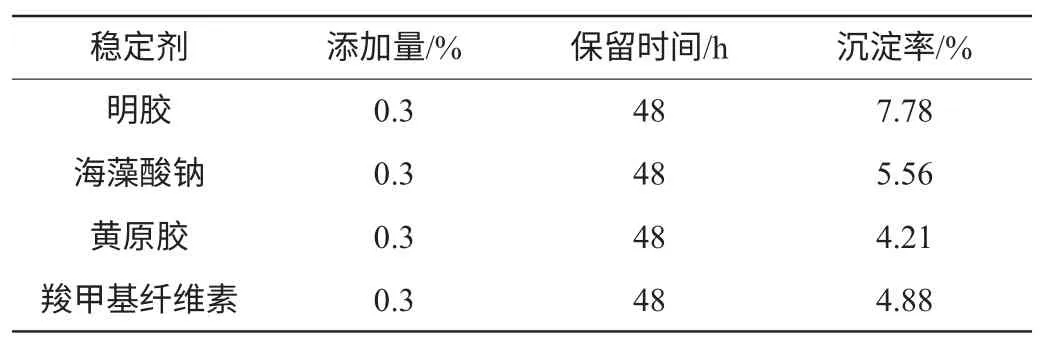
表3 不同稳定剂对产品稳定性的影响Table 3 Effect of different stabilizers on product stability
由表3可知,黄原胶对产品的稳定效果最好,沉淀率仅为4.21%;其次是羧甲基纤维素和海藻酸钠;而明胶的沉淀率最高,稳定效果最差。黄原胶溶胶分子形成超结合带状的螺旋共聚体,构成能够支持液滴、固体颗粒的网状结构,从而显示出较强的稳定作用[17]。因此选择添加黄原胶来增加产品的稳定性。

图6 黄原胶对产品稳定性的影响Fig.6 Effect of xanthan addition on product stability
选择不同的黄原胶添加量进行试验,确定黄原胶的最佳添加量,结果见图6。由图6可知,当黄原胶的添加量为0.35%时,沉淀率最低,为4.32%,产品的稳定性最好。
2.3.2 产品稳定系数的测定
在乳制品生产过程中,脂肪上浮是一大问题,在乳清产品中加入适量的蔗糖酯能够有效抑制脂肪上浮,还能防止乳脂的析出,一定程度增加了产品的稳定性[18-19],蔗糖酯对产品稳定系数影响的结果见图7。

图7 蔗糖酯对产品稳定系数的影响Fig.7 Effect of sucrose ester addition on the stability coefficient of the product
因为蔗糖酯会在油/水界面会形成界面膜,能阻止颗粒的相互结合,提高其稳定性。而当添加量过大时,由于胶束的形成,反而使稳定系数降低[18]。由图7可知,当蔗糖酯的添加量为0.10%时,产品的稳定系数为0.2。稳定系数最大,稳定效果和乳化效果较好。
3 结论
先对乳清原料进行超滤处理,除掉大部分水和部分盐。通过对菌种筛选和发酵试验,确定用球状乳酸菌M-1a、杆状乳酸菌M-2b和啤酒酵母2399分别进行乳酸发酵和酒精发酵。通过单因素和正交试验确定乳清“发泡酒”最佳发酵条件为乳酸菌(杆菌∶球菌=1.0∶1.0)接种量10%,乳糖酶添加量0.95%,胰蛋白胨添加量5.0%和酵母菌接种量0.5%。为了提高产品的稳定性,黄原胶添加量为0.35%,蔗糖酯的添加量为0.1%。最佳发酵条件下产品酒精度为0.68%vol,酸度为1.036%,产品颜色乳白,口感醇厚,符合国标GB 16321—2003《乳酸菌饮料卫生标准》中的要求。
乳清里含有乳糖、蛋白、多种维生素和矿物质,有很高的营养价值。本研究通过二次发酵制得的乳清发酵产品有良好口感和较好的稳定性,不仅具有时尚感,而且还迎合了消费者的健康理念,具有良好的社会效益和经济效益,为乳清的开发与利用提供了一种新的技术支持。
[1]闫 彬,贺银凤.乳酸菌与酵母菌共生机理综述[J].食品科学,2012,33(3):277-281.
[2]ALVAREEZ-MARTIN P,FLOREZ A B,HERNANDEZ-BARRANCO A,et al.Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J].Food Control,2008,19(1):63-70.
[3]PRAZERES A R,CARVALHO F,RIVAS J.Cheese whey management:a review[J].Journal of Environmental Management,2012,110:48-68.
[4]GIULIANO D,MUSSATTO S I,OLIVERIRA J M,et al.Characterisation of volatile compounds in an alcoholic beverage produced by whey fermentation[J].Food Chem,2009,112(4):929-935.
[5]PMICAELA P,MARIA H E,FERNANDA M,et al.Whey fermentation by thermophilic lactic acid bacteria:evolution of carbohydrates and protein content[J].Food Microbiol,2008,25(3):442-451.
[6]王 胭,刘秀河.乳清干酪产品加工现状[J].乳业科学与技术,2015,38(2):15-19.
[7]严宝兴.乳清资源的综合利用[J].草业与畜牧,2008(9):52-55.
[8]王 昕,侯聚敏,朴姗善.发酵型乳清饮料的研究进展[J].农产品加工,2011(8):44-48.
[9]刘振民,骆承痒.含醇发酵乳的研制[J].食品工业,2000,22(1):21-23.
[10]高红艳,刘振民,莫蓓红.陶瓷膜超滤技术浓缩乳清的工艺参数研究[J].食品工业科技,2012,33(2):351-354.
[11]姜 超,张 彧,陈历俊,等.超滤法分离干酪乳清中蛋白的研究[J].大连工业大学学报,2010,29(6):413-416.
[12]山丽杰,田洪涛,马 雯,等.几株保加利亚乳杆菌和嗜热链球菌在乳中发酵特性及优化搭配研究[J].中国乳业,2006(9):49-52.
[13]李延华,王伟军,张兰威,等.发酵乳中风味物质的研究进展[J].中国酿造,2008,27(14):12-15.
[14]杨士春.氮源和无机盐对酵母菌发酵酒精浓度的影响[J].能源工程,2012(4):50-54.
[15]刘 丽,蔡云升.调配型酸乳饮料稳定剂及其稳定性的研究[J].食品工业科技,2003,24(5):63-64.
[16]娄新曼,王存芳.红枣羊乳啤的制备及其稳定性[J].乳业科学与技术,2015,38(2):15-19.
[17]赵紫薇,潘道东,曾小群.发酵乳清橘汁饮料的研制[J].食品工业科技,2013,34(13):223-226.
[18]刘 强,张 可,李凤舞,等.蔗糖酯对乳体系影响作用的研究[J].现代食品科技,2010,26(11):1234-1236,1191.
[19]方新阳,赵 江,吕晓玲.奶啤饮料稳定性的研究[J].广州食品工业科技,2003,35(4):54-56.
[20]郭安民,吴 宏,刘成江,等.乳清发酵饮料酒工艺技术的研究[J].中国酿造,2009,28(7):49-50.
[21]齐海萍.乳清多肽的制备及乳清多肽酒的研制[J].中国酿造,2006,25(4):33-38.
——壳聚糖固定化乳糖酶条件的优化

