基于因素最少化的槟榔多酚错流提取条件研究
蒋晨凤,杨大伟*,高晓婷
(湖南农业大学 食品科技学院,湖南 长沙 410128)
槟榔(Areca catechuLinnaeus)属棕榈科(Arecaceae)槟榔亚科(Arecoideae)槟榔族(Arecinae)槟榔属(Areca)[1],2011年中国海南槟榔种植面积达79 232 hm2[2]。它是我国四大南药之一,具有抗氧化、抗菌、抗抑郁、抗老化等生理活性,而这些生理活性均与槟榔多酚有关[3-6]。植物多酚因其生理功能的多样性,已经成为人们研究的热点内容,目前,植物多酚的提取普遍是通过综合多种因素以获得最佳条件,然而因素越多,各因素以及因素之间的相互作用对试验结果的影响越复杂,最佳提取条件越难获得。本研究运用错流浸提工艺理论直接设计和推导出料液比与提取次数,减少了实验因素,降低了试验的复杂性,研究槟榔多酚的最佳提取条件,为槟榔多酚和植物多酚的提取研究提供理论与实验依据。
1 材料与方法
1.1 材料与试剂
烟熏槟榔果(去核粉碎过40目筛):由湖南宾之郎食品有限公司提供。
没食子酸标准品(色谱纯):中国药品生物制品检定所;甲醇、丙酮、钨酸钠、钼酸钠、磷酸、硫酸锂、液溴、浓盐酸、碳酸钠均为分析纯:国药集团化学试剂有限公司。
1.2 仪器与设备
FW177中药粉碎机:天津市泰斯特仪器有限公司;CP214电子分析天平:上海豪斯仪器有限公司;B-260恒温水浴锅:上海惠海电器设备有限公司;TGL-16台式电动离心机:常州市华普达教学仪器有限公司;722s可见分光光度计:湖南省计量检测研究所;UV-2450紫外可见分光光度计:日本岛津公司。
1.3 试验方法
1.3.1 槟榔总酚含量的测定
(1)测定波长的选择
分别取没食子酸标准溶液1 mL,槟榔酚提取液0.5 mL,加入2.0 mL Folin-酚试剂[8]并充分摇匀,1 min后加入10 mL 10%的碳酸钠溶液,并定容至50 mL,室温静置1 h后,以空白为对照,用紫外可见分光光度计在400~900 nm范围内进行波长扫描,根据呈色化合物的吸收曲线选择测定波长。
(2)没食子酸标准曲线的绘制
参照文献[7]绘制没食子酸标准曲线。
(3)槟榔总酚含量的计算
准确吸取200 μL槟榔提取液于50 mL容量瓶中,加入2.0 mL Folin-酚试剂并充分摇匀,1 min后加入10 mL 10%的碳酸钠溶液,定容,室温静置1 h后于最大吸收波长下测定吸光度值,根据标准曲线回归方程计算总酚含量。总酚含量计算公式如下:
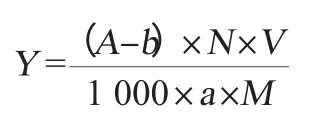
式中:Y为总酚含量,mg/g;A为吸光度值;b为标准曲线截距;N为稀释倍数;V为溶剂体积,mL;a为标准曲线斜率;M为槟榔粉末质量,g。
1.3.2 提取溶剂的选择
(1)不同体积分数甲醇提取剂对槟榔总酚含量的影响
精确称取1.00 g 槟榔烟果粉末于50 mL带塞试管中,分别加入25 mL体积分数分别为0、20%、40%、60%、80%、100%的甲醇溶液,在40 ℃提取1 h,过滤后测定其总酚含量。每个水平重复3次。
(2)不同体积分数丙酮提取剂对槟榔总酚含量的影响
精确称取1.00 g 槟榔烟果粉末于50 mL带塞试管中,分别加入25 mL丙酮体积分数分别为0、20%、40%、60%、80%、100%的溶液,在40 ℃提取1 h,过滤后测定其总酚含量。每个水平重复3次。
(3)不同比例混合溶液(甲醇:丙酮:水)提取剂对槟榔总酚含量的影响
精确称取1.00 g 槟榔烟果粉末于50 mL带塞试管中,分别加入25 mL混合溶剂,甲醇∶丙酮∶水的体积比分别为1∶1∶3、1∶2∶2、1∶3∶1、2∶1∶2、3∶1∶1、1∶1∶1,在40 ℃提取1 h,过滤后测定其总酚含量。每个水平重复3次。
1.3.3 多级错流浸取级数及料液比的设计
采用解析法推导错流浸取理论级数[9]。通过实际操作确定底流量,设定残留率,推导并计算不同料液比条件下的错流浸取理论级数。浸提级数的计算如下:
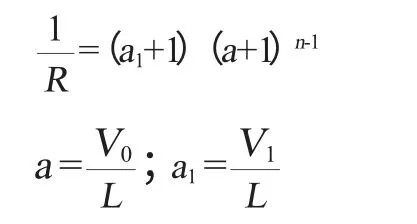
式中:R为残留率,%;a为溢流底流比;a1为第一级溢流底流比;n为浸取级数;V1为第一级溢流体积,mL;V0为单级加入的溶剂体积,mL;L为底流液体积,mL。
1.3.4 正交试验优化槟榔总酚提取条件
选定最佳提取溶剂、料液比以及浸取级数,在此条件下进行时间(40 min、60 min、80 min、100 min、120 min)、温度(40 ℃、50 ℃、60 ℃、70 ℃、80 ℃)和pH值(2.0、3.0、4.0、5.0、6.0)3个单因素分析。在单因素试验结果的基础上,以总酚得率为指标,用L9(34)设计进行正交试验优化提取条件[10],因素与水平见表1。
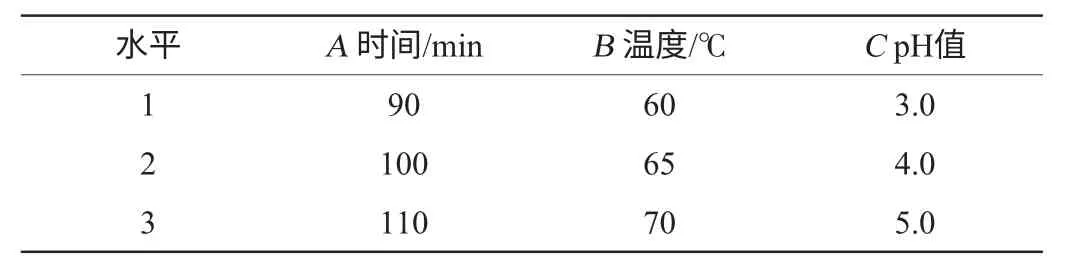
表1 提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction conditions optimization
2 结果与分析
2.1 测定波长的选择
按照1.3.1的方法,测定没食子酸及槟榔提取液最大吸收波长,绘制出的吸收曲线分别如图1和图2所示。
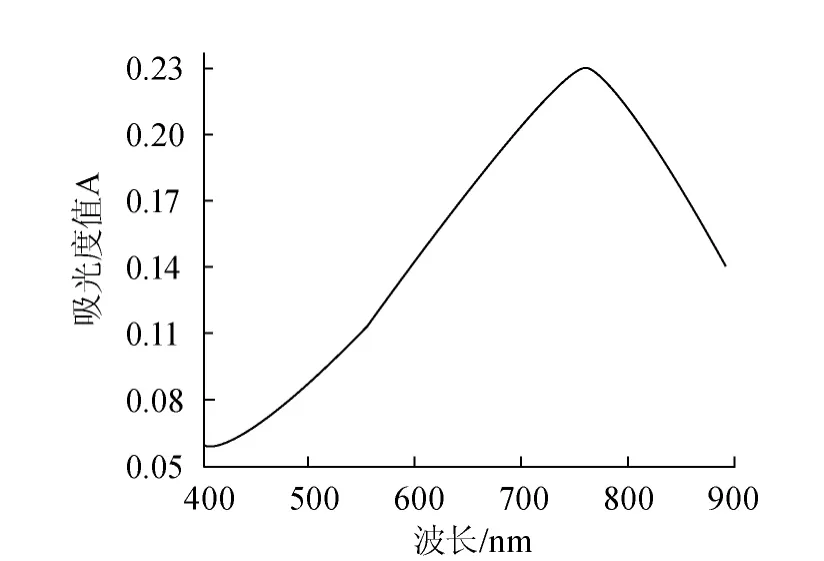
图1 没食子酸溶液吸收光谱Fig.1 Absorption spectrum of gallic acid solution
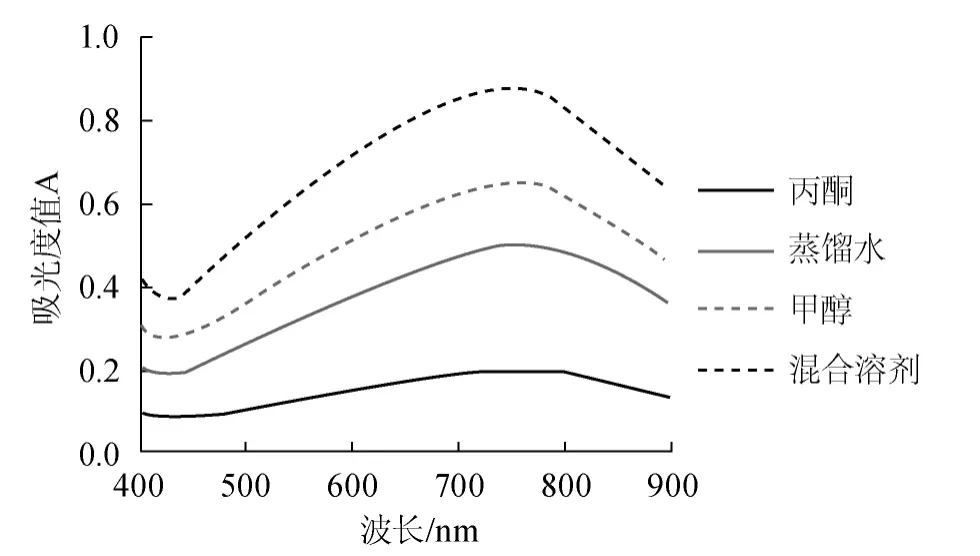
图2 槟榔提取液吸收光谱Fig.2 Absorption spectrum of A.catechu extract
由图1可知,没食子酸标准溶液经显色后的最大吸收波长在765 nm。4种曲线分别代表提取溶剂为纯丙酮、蒸馏水、纯甲醇和混合溶剂(甲醇∶丙酮∶水=1∶2∶2,V/V)条件下槟榔酚提取液的吸收曲线见图2。由图2可知,4种溶剂提取条件下的槟榔酚提取液经显色后的最大吸收波长均在765 nm左右,与没食子酸标准溶液基本一致,因此选择765 nm作为测定波长。
2.2 没食子酸标准曲线绘制
按照1.3.1的方法在765 nm波长下测定吸光度值,以没食子酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制没食子酸标准曲线如图3所示。由图3可知,标准曲线回归方程:y=0.094 0x+0.028 3,相关系数R2=0.999 1,表明没食子酸质量浓度在0~6.24 mg/L范围内与吸光度值线性关系良好。
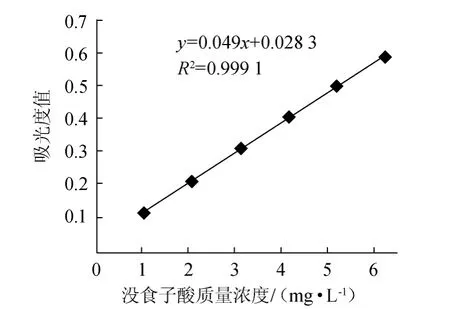
图3 没食子酸标准曲线Fig.3 Standard curve of gallic acid
2.3 提取溶剂的选择
2.3.1 不同溶剂及其浓度对槟榔总酚提取率的影响
不同溶剂及其体积分数对槟榔总酚提取率的影响如图4所示。
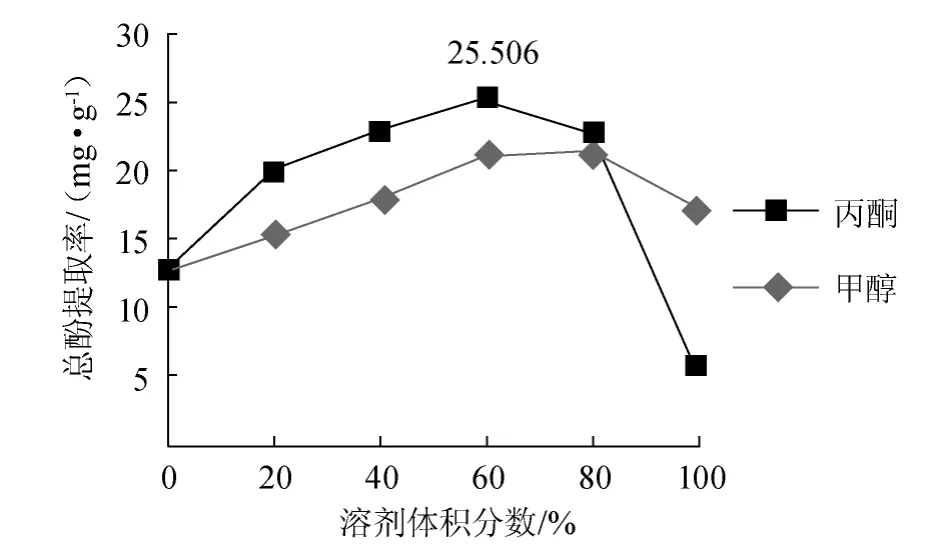
图4 不同溶剂及其浓度对总酚提取率的影响Fig.4 Effect of different solvent and concentration on extraction rate of total polyphenols
由图4可知,水和两种纯溶剂提取槟榔总酚的提取率均较低,其中纯丙酮提取总酚效果最差,而两种有机溶剂在与水的复合体系下总酚提取率较高。这可能是因为多酚常与蛋白质、多糖以及多酚分子间以氢键和疏水键形式形成稳定的分子复合物,水是多酚的良溶剂,而有机溶剂具有氢键断裂作用,因此有机溶剂与水的复合体系最适合多酚的提取[11]。结果表明,丙酮/水溶剂体系比甲醇/水溶剂体系提取率好,体积分数为80%甲醇与体积分数为60%丙酮分别在各溶剂体系中提取率较高,其中体积分数为60%丙酮提取率最佳,当丙酮体积分数>60%时,多酚提取率呈下降趋势,原因可能是当有机溶剂浓度达到一定程度,色素等亲脂性强的成分溶出,同时组织通透性下降,导致总酚得率下降[12]。因此,单一溶剂提取槟榔总酚,体积分数为60%丙酮为宜。
2.3.2 混合溶剂对槟榔总酚提取率的影响
不同体积比的甲醇/丙酮/水混合溶剂对槟榔总酚提取率的影响如图5所示。
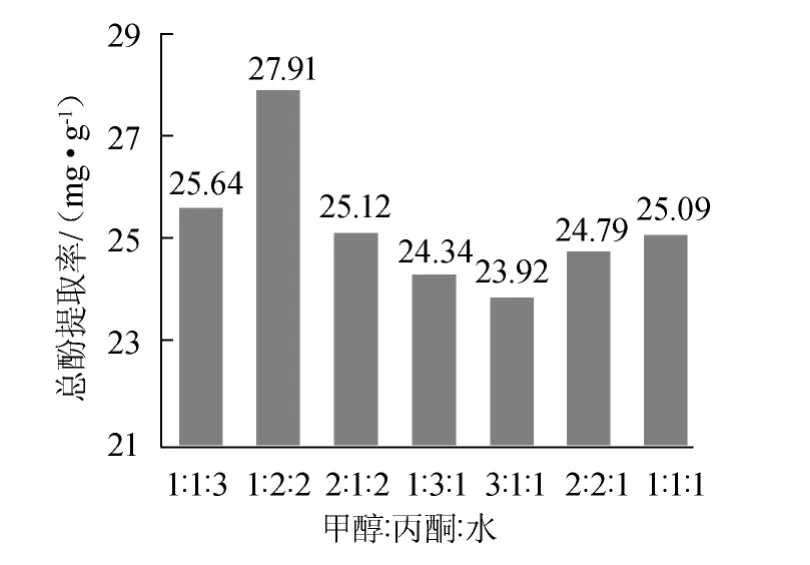
图5 混合溶剂比例对总酚提取率的影响Fig.5 Effect of mixed solvent ratio on extraction rate of total polyphenols
由图5可知,总酚提取率随混合溶剂中有机溶剂比例的增加呈先升高后降低的趋势,当甲醇∶丙酮∶水的体积比为1∶2∶2时总酚提取率最高,此比例混合溶剂中有机溶剂所占比例为60%,其中甲醇占20%,丙酮占40%,而同样占60%有机溶剂的混合溶剂(2∶1∶2)其提取率相对较低,可见丙酮比甲醇提取总酚能力更高,这也与2.3.1所得结果相符,此外,甲醇∶丙酮∶水的体积比为1∶1∶1时,总酚提取率不及体积比1∶2∶2,这可能也与有机溶剂所占比例有关。混合溶剂提取相比于溶剂/水体系提取效率更高,因此,选择甲醇∶丙酮∶水体积比为1∶2∶2的混合溶剂作为最佳提取溶剂。
2.4 多级错流浸取级数及料液比
设定残留率为5%,即残渣排走的总酚量与原料所含总酚量之比为5%,此时可视为总酚基本提取完全,通过试验确定当槟榔粉末质量为1.00 g时各浸取级排出的底流液为3 mL,利用公式计算出不同料液比条件下的错流浸取理论级数如表2所示。从实际操作方便性与经济效益等方面综合考虑,宜选用料液比为1∶20(g∶mL),浸取级数为2,通过验证试验得出在该料液比与浸取级数条件下其残留率为4.94%,符合实验所需条件。
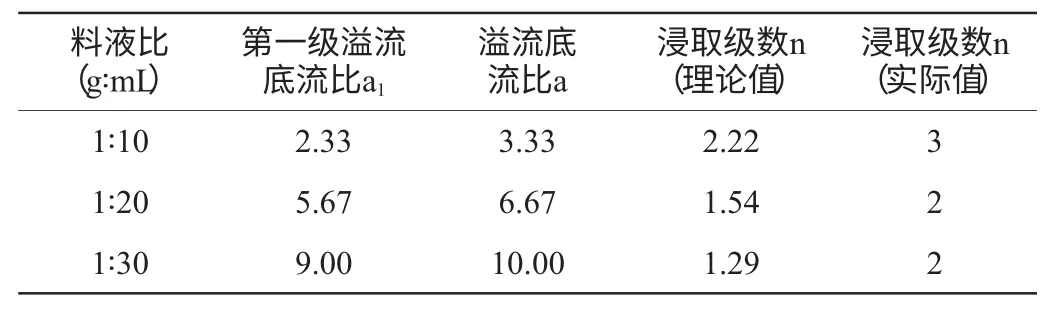
表2 多级错流浸取级数Table 2 Stages of multilevel cross-flow extraction
2.5 提取时间对槟榔总酚提取率的影响
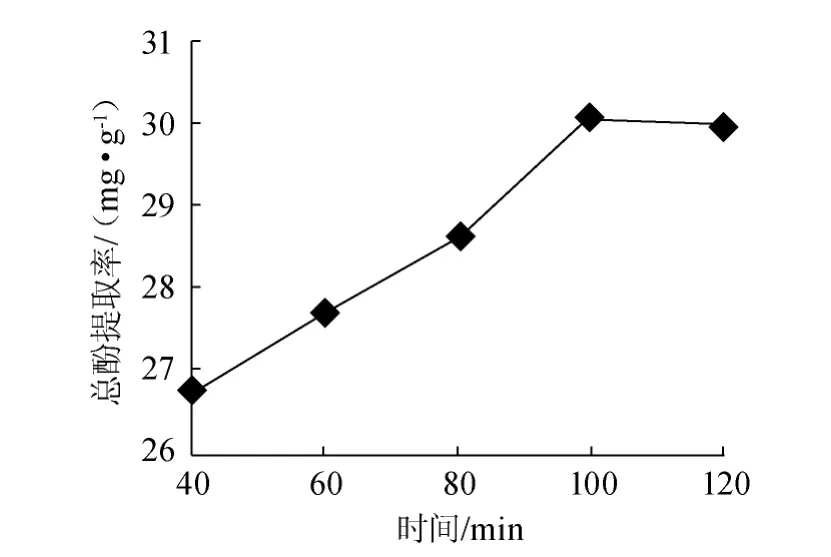
图6 提取时间对总酚提取率的影响Fig.6 Effect of extraction time on extraction rate of total polyphenols
以甲醇∶丙酮∶水=1∶2∶2的混合溶剂为提取剂,料液比1∶20(g∶mL),温度60 ℃,浸提级数2的条件下,分别提取不同时间,结果如图6所示。由图6可知,在100 min内随时间的增加,槟榔总酚提取率显著增加,100 min时提取率达到最大(30.14 mg/g),随后总酚提取率随时间增加而缓慢降低。这是因为在较高的温度下,随着时间的延长,多酚被逐步氧化,在实际工业生产中,提取时间太长会延长生产周期,从而增加生产成本,提取时间太短则使多酚提取不完全导致提取率低[13]。因此,提取时间选择100 min为宜。
2.6 提取温度对槟榔总酚提取率的影响
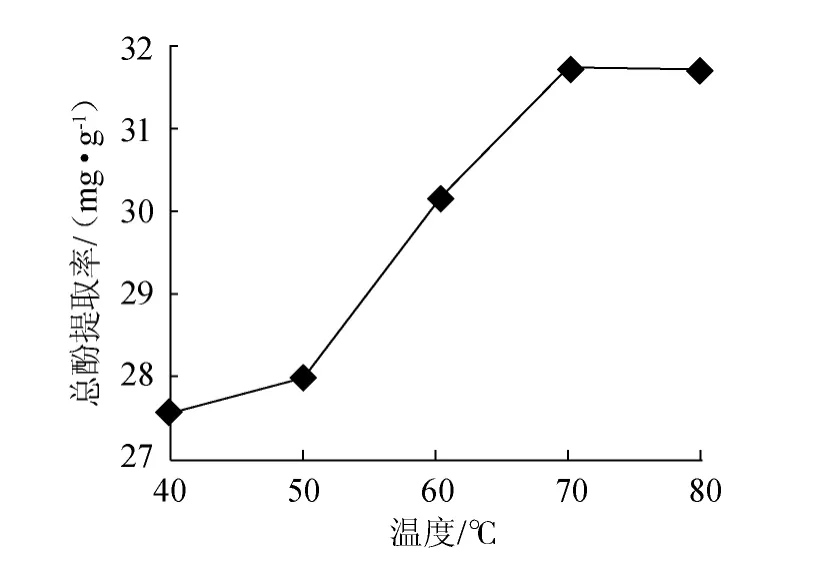
图7 提取温度对总酚提取率的影响Fig.7 Effect of extraction temperature on extraction rate of total polyphenols
以甲醇∶丙酮∶水=1∶2∶2的混合溶剂为提取剂,料液比1∶20(g∶mL),时间100 min,浸提级数2的条件下,分别在不同温度下提取,结果如图7所示。由图7可知,在50~70 ℃,随着温度的增加,槟榔总酚提取率迅速增加,在温度70 ℃时提取率达到最大(31.75 mg/g),而后随温度增加其总酚提取率变化不明显,原因可能是增加温度可软化植物组织,加速分子间的运动,从而促进多酚类物质从植物细胞中溶出[14]。温度过高,多酚被氧化而遭到破坏,甚至使含量降低[15],因此,提取温度选择70 ℃为宜。
2.7 pH值对槟榔总酚提取率的影响
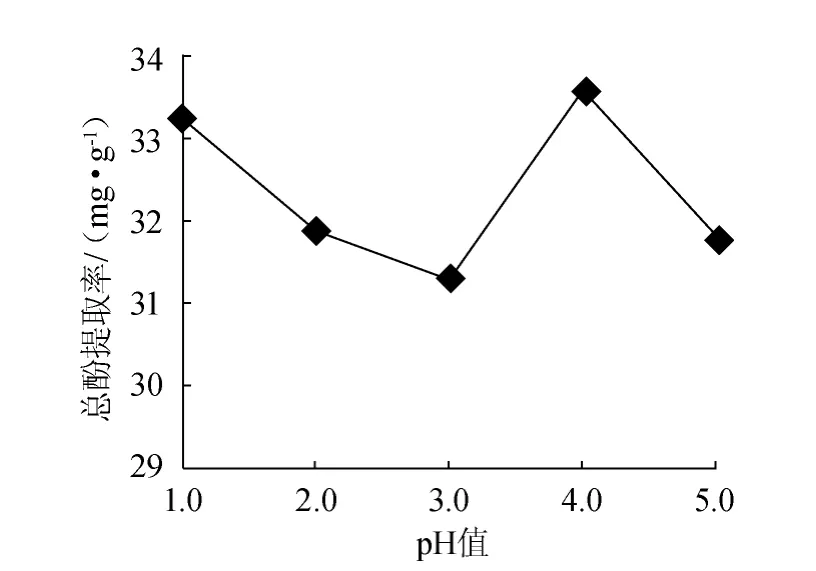
图8 pH值对总酚提取率的影响Fig.8 Effect of pH on extraction rate of total polyphenols
以甲醇∶丙酮∶水=1∶2∶2的混合溶剂为提取剂,料液比1∶20(g∶mL),时间100 min,温度70 ℃,浸提级数2的条件下,分别在不同pH值下提取,结果如图8所示。由图8可知,pH值为4.0时,总酚提取率达到最大(33.60 mg/g),继续增大pH值,总酚提取率降低,当pH<3.0,随着pH值的降低,总酚提取率反而增大,且提取液颜色逐渐变深,原因可能是提取液中的单宁等聚合态多酚在低pH值条件下发生降解,因此多酚提取时,提取液的pH值不能<3.0[16],因此,提取剂pH值调节为4.0为宜。
2.8 提取条件优化正交试验
为了得到最佳提取工艺条件,对影响因素及参数进一步优化,根据以上试验结果,设计了3因素3水平的正交试验,结果与分析见表3,方差分析见表4。
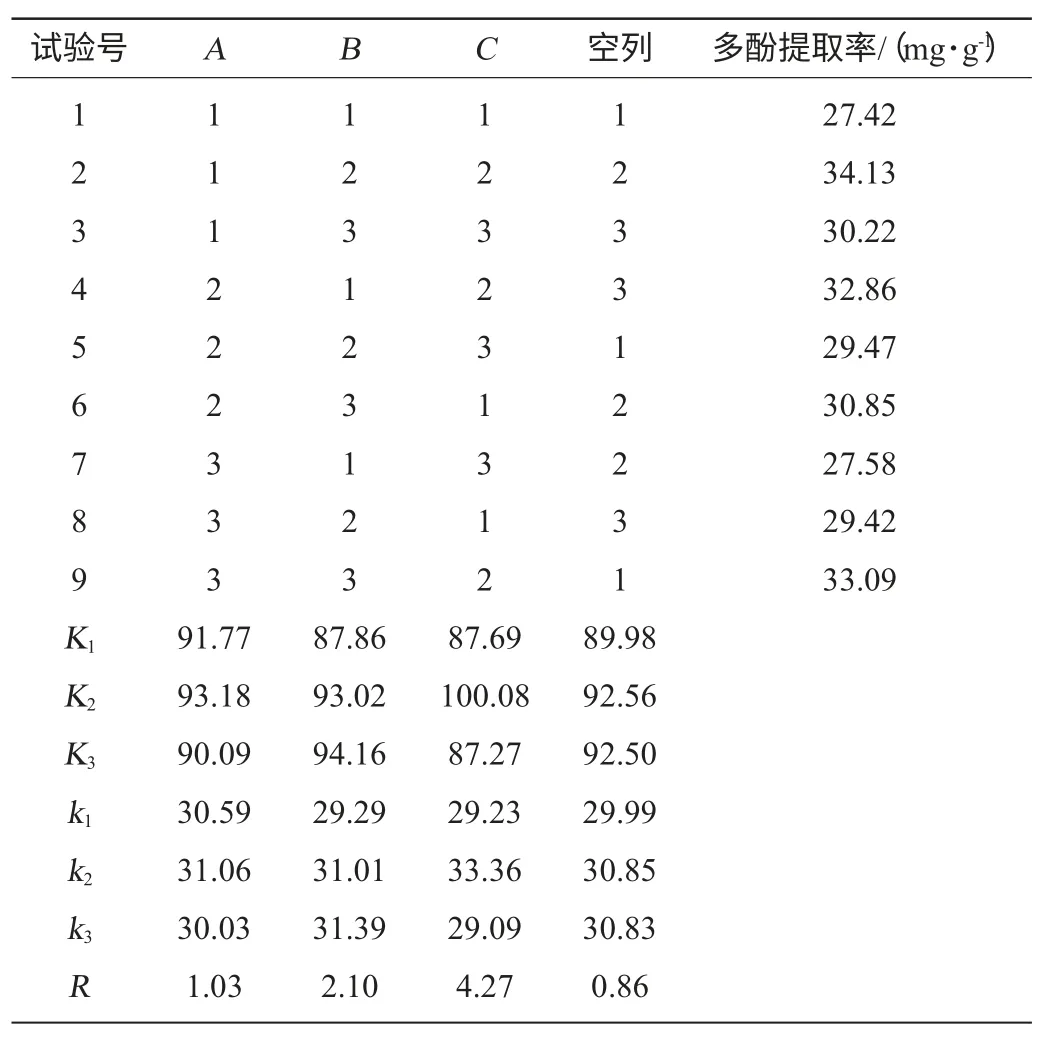
表3 提取条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for extraction conditions optimization
由表3可知,因素的主次顺序为C>B>A,即pH值>温度>时间。最优组合为A2B3C2,即提取条件为时间100 min,温度70 ℃,pH 4.0。在此最佳条件下进行验证试验,多酚提取率为34.46 mg/g。
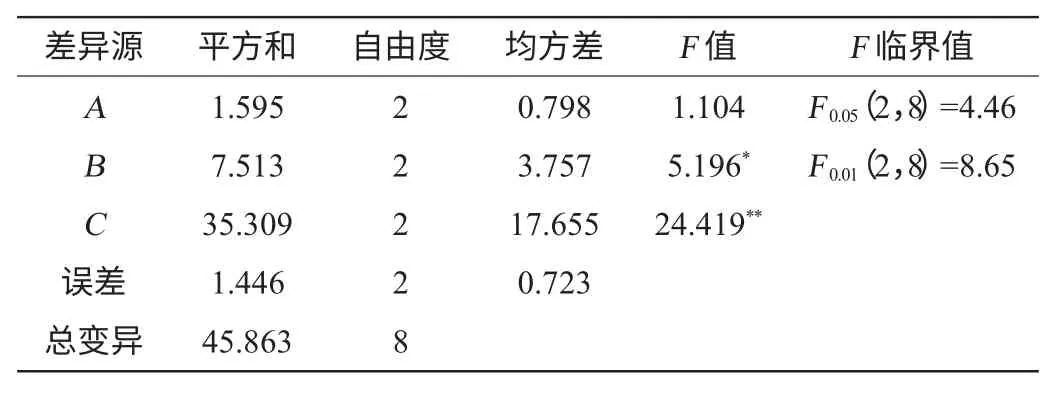
表4 正交试验结果方差分析Table 4 Variance analysis of orthogonal experiments results
由表4可知,因素C对槟榔总酚提取率影响极显著(P<0.01),因素B对槟榔总酚提取率影响显著(P<0.05),而因素A对槟榔总酚提取率影响不显著。
3 结论
在因素最少化条件下,为探讨槟榔多酚提取最佳条件,通过多级错流浸取工艺理论设计提取次数与料液比并进行实验验证,在单因素试验的基础上进行正交试验,得到最佳提取条件为:混合溶剂(甲醇∶丙酮∶水=1∶2∶2)为提取剂,料液比1∶20(g∶mL),浸提级数2,pH 4.0,温度70 ℃,时间100 min。在此最佳提取条件下,槟榔总酚的提取率为34.46 mg/g。该法不但提取率高,而且可以缩短提取时间,降低能耗,为植物功能成分的提取提供有益的借鉴。
[1]覃伟权,范海阔.槟榔[M].北京:中国农业大学出版社,2010.
[2]王 丹,庞玉新,胡 璇,等.海南省槟榔种植业发展现状及其动力分析[J].广东农业科学,2013(15):213-215.
[3]ZHANG W M,LI B,HAN L.Antioxidant activities of extracts from areca(Areca catectuL.) flower,husk and seed[J].Afr J Biotechnol,2009,16(8):3887-3892.
[4]UCHINO K,TOUKAIRIN T,KAWAGUCHI K,et al.The growth inhibition ofStreptococcus mutansby 5'-nucleotidase inhibitors fromAreca catechuL[J].Chem Pharm Bull,1991,39(5):1323-1324.
[5]何嘉泳,陈杰桃,辛志添,等.槟榔壳总酚类提取物抗抑郁作用研究[J].中国药师,2012,15(8):18-20.
[6]LEE K K,CHOY J J,PARK E J,et al.Anti-elastase and anti-hyaluronidase of phenolic substance fromAreca catechuas a new anti-ageing agent[J].Int J Cosmet Sci,2001(23):341-346.
[7]田文礼,孙丽萍,董 捷,等.Folin-Ciocaileu 比色法测定蜂花粉中的总酚[J].食品科学,2007,28(2):258-260.
[8]宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1997.
[9]杨同舟,于殿宇.食品工程原理[M].北京:中国农业出版社,2011.
[10]李安平,杨大伟.食品试验设计与分析[M].武汉:华中科技大学出版社,2013.
[11]石 碧,狄 莹.植物多酚[M].北京:科学出版社,2000.
[12]周向军,高义霞,李娟娟,等.乳苣多酚提取工艺及抗氧化研究[J].中国酿造,2011,30(9):118-121.
[13]赵国建,席东亮,段江莲.核桃青皮多酚提取工艺优化[J].陕西农业科学,2013(4):5-7.
[14]李西柳,庞 明,王俊儒,等.柿子渣中多酚的提取工艺及其抗氧化性研究[J].西北植物学报,2010,30(7):1475-1480.
[15]张春梅,陈朝银,赵声兰,等.核桃内种皮多酚提取工艺及其体外抗氧化性的初步研究[J].中国酿造,2014,33(7):130-134.
[16]任亚梅,李光辉,许永涛.石榴籽多酚的提取及其种壳仁抗氧化活性研究[J].食品科学,2012,33(4):31-35.

