青黄散治疗骨髓增生异常综合征DNA磷硫酰化探析
张姗姗,全日城,杨晓红,许勇钢,胡晓梅,刘 锋,麻 柔
(中国中医科学院西苑医院血液科,北京 100091)
青黄散治疗骨髓增生异常综合征DNA磷硫酰化探析
张姗姗,全日城,杨晓红,许勇钢,胡晓梅,刘 锋,麻 柔△
(中国中医科学院西苑医院血液科,北京 100091)
目的:研究硫化砷制剂青黄散对骨髓增生异常综合征(Myelodysplastic Syndromes,MDS)患者DNA双链结构的影响,硫元素是否可加入DNA骨架,是否有DNA结构的硫酰化修饰。方法:以持续服用青黄散6个月以上并有血液学改善的MDS患者骨髓DNA样本10例,以琼脂糖包埋,应用脉冲场凝胶电泳(PFGE)检测骨髓细胞DNA降解表型。利用BIO-RAD CHEF-DRⅢSystem脉冲电泳进行分析。结果:经过硫修饰后DNA构象发生变化,这种硫修饰结构对电泳过程阳极积累的Tris过酸衍生物敏感而遭到位点特异性攻击,引发DNA的双链切割反应出现DNA降解现象。电泳后标本DNA结构完好,在Tris缓冲液下未出现DNA降解现象。结论:青黄散治疗有效的患者骨髓细胞DNA骨架中没有磷硫酰化修饰现象,说明青黄散疗效机制不通过硫修饰系统。
骨髓增生异常综合征;青黄散;DNA磷硫酰化。
青黄散是一种硫化砷制剂,对血液恶性肿瘤细胞表现出抑制、诱导凋亡、去甲基化作用。本文主要研究青黄散对MDS患者DNA双链结构是否有影响,硫元素能否加入DNA骨架,有无造成DNA结构的硫酰化修饰。
1 资料与方法
1.1 一般资料
选取2011年5月至2012年12月西苑医院血液科门诊10例MDS患者,检测分析口服青黄散每日1粒,持续6个月以上并有血液学改善的10例MDS患者的骨髓样本。
1.2 诊断标准
参照2007年张之南主编的《血液病诊断及疗效标准》[1],分型标准参照世界卫生组织于2008年颁布的《MDS分型标准》[2]。
1.3 纳入和排除标准
纳入标准:符合骨髓增生异常综合征诊断标准;口服青黄散6个月以上并获得血液学进步;没有严重心肝肾合并症;年龄在18~75岁;自愿受试并签署知情同意书。排除标准:不符合上述纳入标准的病人;服药期间出现腹泻等不良反应暂停服药者;对该药过敏者;妊娠、哺乳期妇女及精神病患者。
1.4 治疗方法
所有患者均口服青黄散每日0.4 g,同时在辨证分型基础上,以健脾补肾中药(生熟地、山药、五味子、茯苓、丹皮、补骨脂、川萆薢、菟丝子、巴戟天、太子参、锁阳、生黄芪、当归等)为主,根据患者四诊加减变化,同时配合西药治疗。所有患者加用司坦唑醇或十一酸睾酮,司坦唑醇6~12 mg/d,每日3次,肝功能偏高者换用十一酸睾酮120~160 mg/d,每日3次,同时以葡醛内酯片100~200 mg/d保肝。当患者合并感染时可根据四诊辨证加减中药,或短期配合抗生素治疗;患者因血小板低而有鼻衄、肌衄等出血症状时,按中医辨证加用凉血止血或收涩止血药,必要时输注机采血小板,同时使用止血药物;若患者有严重贫血可适当输注红细胞改善症状,6个月为1个疗程。
1.5 临床疗效标准
采用国际工作组疗效标准血液学进步的修订建议[1]。
1.6 观察指标与方法
血常规:检测治疗前后WBC(109/L)、HGB(g/ L)、PLT(109/L)计数;脉冲场凝胶电泳(PFGE)检测:符合纳入标准的MDS患者抽取骨髓2ml。首先分离、纯化DNA,制备琼脂糖包埋的DNA样品,送至中国农业大学分子生物学实验室,利用BIO-RAD CHEF-DRⅢSystem脉冲电泳检测DNA降解表型。
1.7 统计学方法
应用SPSS STATISTICS 17.0软件进行统计分析,数据以均数!标准差(±s)表示,计量资料应用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共有10例患者入组,其中7例男性,3例女性,年龄14~47岁,中位年龄(26.32±10.70)岁,病程10~120个月。其中气阴两虚、毒瘀阻滞型3例,脾肾两虚、毒瘀阻滞型6例,热毒炽盛、毒瘀阻滞型1例。10例患者西医分型均为MDS-RCMD型,染色体核型分析正常者9例,异常者1例。
2.2 临床疗效
表1显示,为检测磷硫酰化修饰,此次纳入的10例患者均选自经青黄散治疗获得血液学进步的病例,治疗前后血常规粒系、红系、血小板指标均有显著上升,经t检验治疗前后差异有统计学意义(P<0.05)。因人为挑选有效病例,故不做疗效分析依据,只作为下一步硫酰化实验研究的病例基础资料来描述。
表1 10例患者治疗前后血常规指标变化比较(±s)

表1 10例患者治疗前后血常规指标变化比较(±s)
注:与治疗前比较:*P<0.05
血象治疗前 治疗后WBC(1 09/L) 3.90±1.74 5.20±2.52*HGB(g/L) 73.70±26.58 104.20±19.40*PLT(1 09/L) 32.10±20.34 57.50±28.5*
2.3 硫酰化结果分析
将10例琼脂糖包埋的骨髓DNA利用BIO-RAD CHEF-DRⅢSystem脉冲电泳进行分析,结果如下。
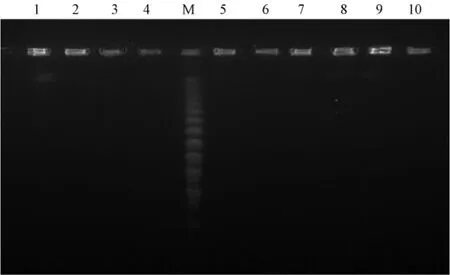
图1 脉冲场凝胶电泳(PFGE)图
M泳道为分子量标准品,编号1至10为试验标本DNA,可见标本DNA完好,在Tris缓冲液下未出现DNA降解现象(见图1)。
3 讨论
我科室在20世纪70年代就已经开始以青黄散为中心治疗各类恶性血液病并有良好疗效。尤其近几年对骨髓增生异常综合征的疗效研究取得了显著成绩,发现青黄散治疗MDS疗效确切,患者血液学改善明显,安全性高,治疗费用低。
青黄散[2]由雄黄和青黛组成,雄黄主要成分为二硫化二砷(As2S2,As4S4),辛、苦、性温、有毒,归心、肝、胃经,具有解毒杀虫、燥湿祛痰、截疟的功能。雄黄为硫化砷矿石,多分布于泥板岩或干页岩中,与砒石、雌黄、铅石等有毒矿石共存。由于采矿时净选不严,常与共存的有毒矿石夹杂,其炮制过程采用超细颗粒研磨外还采用水飞法,可以洗去大部分As2O3,降低雄黄毒性,保证用药安全。青黛咸、性寒,归肝、肾经,具有清热解毒、凉血消斑、清肝泻火功效,其有效成分靛玉红据现代研究具有抗菌及抗肿瘤作用。两药配合组方相辅相成,增加解毒功效的同时,寒热并用,互为佐制,制约和消减彼此毒性,使整体药性趋于平和,组方后具有解毒化瘀之功效,临床疗效显著说明此方案的有效性[3]。
前期从细胞遗传学以及表观遗传学去甲基化等领域对青黄散的疗效机制进行了研究,研究证实青黄散疗效显著,具有明显的去甲基化作用。麻柔[4]用青黄散、补肾健脾汤药及雄性激素治疗MDS 106例,显效(CR+HI)44例(41.51%),稳定53例(50%),无效9例(8.49%),不同细胞遗传学组对于青黄散治疗反应比较差异无统计学意义。刘锋[5]等用益髓青黄散治疗骨髓增生异常综合征36例,总有效率83.33%。疗效机制研究方面,在青黄散治疗6个月后,骨髓增生异常综合征患者与正常对照比较甲基化基因由1063个明显减少至75个,治疗前的癌症通路、细胞黏附通路、趋化因子信号通路、MAPK信号通路、钙信号通路的基因甲基化已消失,表明青黄散治疗有明显去甲基化作用。
DNA的组成元素碳(C)、氧(O)、氢(H)、磷(P)、氮(N)是生命必需元素。在研究生物体DNA分子的过程中,科学家发现除这5种元素外,DNA分子还有另一种组成元素即硫元素。这个发现源自于磷硫酰化研究,磷硫酰化修饰就是DNA的磷酸二酯键出现了构象变化,磷酸二酯键羟基上的氧原子被硫原子所替代,形成了RP构象的硫代磷酸二酯键。这是首次在DNA骨架上发现的一种新修饰。2005年王连荣等进一步证明,DNA磷硫酰化修饰在细菌基因组中广泛分布且量化存在,对于DNA硫修饰研究来说是一次重大突破,它从基因层面阐述了硫酰化机制。
目前国内外均未见报道哺乳动物中是否存在磷硫酰化。青黄散治疗MDS总有效率达80%,青黄散中含有硫化砷,长期服用青黄散并从中受益的患者,体内是否存在DNA硫修饰?自然界多种药物如博莱霉素等抗生素对DNA会形成损伤断裂,磷酸二甲酯、肼也对DNA在特定位置上有特异性切割,含铁离子的EDTA作为寡聚核苷酸配基对DNA也有位点特异性切割。青黄散作为砷制剂,对DNA双链结构有无损伤?本文围绕这一研究目的展开。结果显示,利用BIO-RAD CHEF-DRⅢSystem脉冲电泳对琼脂糖包埋的骨髓DNA进行分析,未发现DNA降解现象,说明服用青黄散治疗有效的患者,骨髓细胞DNA骨架中没有磷硫酰化修饰现象,这也说明青黄散疗效机制不是通过硫修饰系统。本研究有10例病例入组,虽然样本量不算充足,但对磷硫酰化定性实验研究来说是比较充分的。
[1] 张之南,沈悌.血液病诊断及疗效标准[M].北京:科学出版社,2007:25-28.
[2] 何广胜,邵宗鸿.骨髓增生异常综合征维也纳诊断标准解读[J].北京:中国实用内科杂志,2008,28(10):885-887.
[3] 张姗姗,麻柔.青黄散治疗骨髓增生异常综合征DNA磷硫酰化初探[D].北京:中国中医科学院博士研究生论文,2013: 13-15
[4] 徐述,刘峰,麻柔.青黄散加补肾健脾中药治疗骨髓增生异常综合征的临床观察[J].中国中西结合杂志,2008,28(3):216-218.
[5] 刘峰.益髓青黄散治疗骨髓增生异常综合征36例[J].中医杂志,2011,52(3):24-242.
R285.6
B
1006-3250(2015)10-1278-02
2015-02-10
张姗姗(1977-),女,山西人,副主任医师,医学博士,从事中西医结合血液病的临床与研究。
麻 柔,主任医师,博士研究生导师,Tel:010-62835362。

