18F-脱氧葡萄糖PET-CT在鉴别周围性非小细胞肺癌阳性前哨淋巴结中的价值
郝少雨 韩丹 张百江 宋平平 刘希斌 宋峥峥 付政
18F-脱氧葡萄糖PET-CT在鉴别周围性非小细胞肺癌阳性前哨淋巴结中的价值
郝少雨1韩丹2张百江1宋平平1刘希斌1宋峥峥1付政3
目的 分析18F-脱氧葡萄糖(18F-FDG)正电子发射型计算机断层显像(PET-CT)诊断的阳性淋巴结与应用染料法诊断的前哨淋巴结(SLN)在周围性非小细胞肺癌(NSCLC)淋巴结转移中的灵敏度、特异度和准确性以及两者间的关联性,探讨PET-CT在肺癌SLN中的应用价值及对纵隔淋巴结清扫的影响。方法 选择2012年7月至2014年6月期间在山东省肿瘤医院可手术切除的周围性NSCLC患者60例,所有患者手术前行PET-CT检查判断淋巴结转移情况。术中肺癌SLN应用亲脂的异舒泛蓝染料法进行识别后单独送快速病理检验。常规行肺切除术,再将所探测的非前哨淋巴结分别切除,行常规苏木精-伊红(HE)病理检查及免疫组织化学检查,PET-CT和SLN最终以病理诊断为金标准。结果
癌,非小细胞肺; 体层摄影术,发射型计算机; 淋巴结; 诊断
完全性肺原发癌切除及系统规范的纵隔淋巴结清扫是非小细胞肺癌(non-small cell lung cancer,NSCLC)外科手术治疗的基本原则。在NSCLC手术中,淋巴结清扫的方式与患者的预后密切相关。尽管完全系统性淋巴结清扫术被列为肺癌根治性手术治疗规范,但对于淋巴结清扫的范围和方式,在临床实践中仍存在不少问题和争论[1]。术中选择何种淋巴结清扫术直接关系到患者术后并发症发生率的高低及患者预后。因此,本研究创新性地将正电子发射型计算机断层显像(positron emission computed tomography,PET-CT)和肺癌前哨淋巴结(sentinel lymph node,SLN)结合,探讨两者在预测肺癌淋巴结转移准确性以及指导淋巴结清扫方式中的应用价值。
资料与方法
一、临床资料
选择2012年7月至2014年6月在山东省肿瘤医院行手术治疗的NSCLC患者。入选标准:患者病例资料完整,并经病理学确诊,按照2009年国际肺癌TNM分期标准[2],评估术前TNM分期为ⅢA期内;糖尿病患者血糖浓度≤8 mmol/L;术前均未接受辅助放疗和化疗。最后共入组60例NSCLS患者,其中男性34例,女性26例;年龄34~71岁,平均(61.2±3.4)岁。检查前征得患者及家属同意并签署知情同意书后进入本研究。
二、PET-CT检查
PET-CT中心的PET-CT(Discovery LS型)由GE公司出品,包括回旋加速器(Minitrace,GE公司出品)、FDG合成模块(Tracerlab,GE公司出品)等配套设备。PET由18环探测器组成,采用BGO晶体,横断层中心分辨率为 4.8 mm,轴向分辨率为4.0 mm。配置四螺旋CT。显像剂为18-FDG,由美国GE公司生产的Minitrace型医用回旋加速器生产,放化纯>95%,pH值为5.6。患者于PET-CT定位前禁食4~6 h,静脉注射前常规检测空腹血糖浓度,血糖浓度控制在8 mmol/L内,安静、避光、平卧15 min后肘静脉注射显像剂(18F-FDG,5.55~7.40 MBq/kg),平静休息40~60min后开始螺旋CT增强扫描,床速22.5 mm/s、0.8 s/周,矩阵512×512,图像融合时转换128×128,胸部采集一般为2~3个床位,PET发射扫描采用二维扫描,矩阵128×128,每个床位采集4~6 min,每个床位断层面为35层,两相邻床位间有一个断层面迭代,每个床位扫描长度为14.6 cm,采用有序子集最大期望值(ordered subset expectation maximization,OSEM)法重建图像,层厚5 mm,利用CT透射扫描数据对PET图像进行衰 减 校 正 (computed tomography attenuationcorrected,CTAC),校正后的PET图像与CT图像融合后分别得到横断面、矢状面和冠状面的PET、CT及PET-CT图像,同时测定相应部位的CT值与PET的标准摄取(standardized uptake value,SUV)值。SUV以2.5为界值来确定肿瘤良恶性及淋巴结有无转移,其中SUV≥2.5临床诊断为恶性肿瘤或淋巴结转移;SUV<2.5为阴性)。
三、应用染料法检测肺癌SLN
常规开胸后,术中沿肺肿瘤边缘分4点(3、6、9、12点)注入异舒泛蓝(isosulfan blue)溶液1 ml,然后进行SLN识别。将术中观察到的最先蓝染的淋巴结或术后在台下继续解剖发现的蓝染淋巴结,无论其术后病理证实是否转移,都定义为SLN,术中单独送快速病理检验。术中记录各淋巴结站的蓝染顺序及蓝染淋巴结的数目。手术方式采用肺癌标准手术,即肺叶切除加纵隔淋巴结清扫,术中分别阻断处理肺动脉、肺静脉和支气管。肺切除后,将所探测的淋巴结分别切除,所有切除标本均行常规苏木精-伊红(HE)病理检查,必要时行免疫组织化学检查。
四、统计学分析
采用SPSS 17.0统计软件包进行分析,计数资料以百分率表示。采用筛查试验方法,以应用染料法检测肺癌SLN为金标准,比较分析不同方案的灵敏度、特异度、阳性预测值和阴性预测值等。
结果
一、一般资料
本组60例患者中,肺叶切除56例,全肺切除4例(其中3例淋巴结浸润侵犯肺动脉干,1例左主支气管受侵犯,表1)。按照2009年国际肺癌新TNM分期标准进行术后病理分期:其中Ⅰa期15例,Ⅰb期13例,Ⅱa期10例,Ⅱb期7例,Ⅲa期15例。术后病理证实均为NSCLC患者。
二、PET-CT分期与术后病理结果的关系
PET-CT分期与术后病理结果一致者49例,PET-CT使18.3%(11/16)的患者临床分期发生改变,其中分期升高者4例,下降者7例。PET-CT分期的准确度为81.7%(49/60),使11.7%(7/60)的患者治疗计划发生改变。
三、SLN的分布情况
60例手术患者在术中瘤周被注射异硫蓝染料后未发生相关不良反应,从注射染料到成功辨认出SLN的时间为15~60 min,平均42 min,在术中有37例应用异硫蓝染料法成功识别出蓝染SLN,包括鳞癌9例,腺癌23例,其他5例,其中左肺上叶12例,左肺下叶3例,右肺上叶6例,右肺中叶6例,右肺下叶10例(表2)。有10例SLN发生跳跃性转移,跳跃性转移率为27.0%(10/37),由多至少依次发生于右肺上叶﹑左肺上叶﹑右肺中叶和右肺下叶,左肺下叶未见跳跃性转移;23例患者的SLN无法进行探测或探测失败,SLN检出率达61.7%(37/60,图1、2)。

表1 非小细胞肺患者一般资料
四、PET-CT诊断SLN灵敏度、特异性和准确性
伴SLN检出的37例NSCLC包括鳞癌9例,腺癌23例,其他5例,共清扫蓝染SLN 85枚,平均2.30枚/例。术中所有清扫的淋巴结行常规H-E病理学检查及免疫组织化学检查,有18例患者中共52枚SLN未查到转移癌细胞,有4例(22.2%)发生非前哨淋巴结(non-sentinel lymph node,non-SLN)转
移;15例患者在术前经PET-CT诊断为N0(表3)。有19例患者中共33枚SLN查到转移癌细胞(其中有15例患者共25枚SLN在术前经PET-CT诊断为阳性),其中4例SLN单独转移,15例(78.9%)合并其他淋巴站转移(表4)。经统计,PET-CT诊断SLN的灵敏度为78.9%(15/19),特异度为83.3% (15/18),阳性预测值为83.3%(15/18),阴性预测值为78.9%(15/19),符合率为81.1%(30/37)。
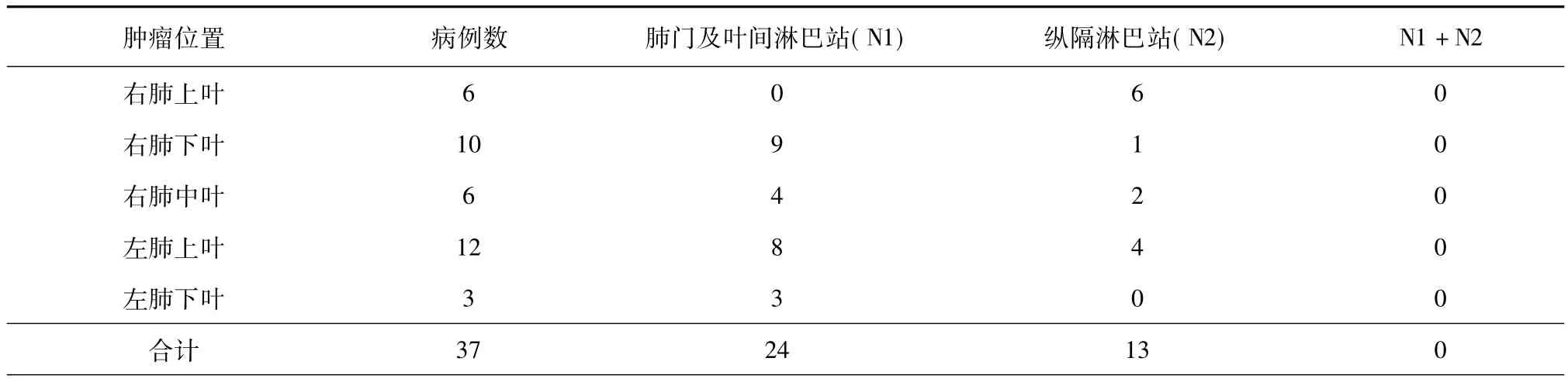
表2 非小细胞肺癌患者前哨淋巴结SLN的分布情况(例)

图1 患者左肺上叶腺癌,术后病理示前哨淋巴结伴4L、7组转移。1A为术前行PET-CT检查,示左肺上叶软组织灶伴主-肺动脉窗区淋巴结FDG高摄取;1B为术中瘤周注射染料后主-肺动脉窗区淋巴结首先发生蓝染成为前哨淋巴结(白色箭头),可见蓝染的引流淋巴管(黑色箭头) 图2 患者右肺上叶鳞癌,术后病理示前哨淋巴结及非前哨淋巴结均无转移。2A为术前行PET-CT检查示腔静脉前淋巴结无FDG摄取;2B为术中瘤周注射染料后5 min,腔静脉前淋巴结发生蓝染(白色箭头),奇静脉弓前方可见通向SLN的蓝染浅表条索状淋巴管(黑色箭头)

表3 经病理诊断SLN阴性病例中PET-CT与non-SLN的符合情况(例)

表4 经病理诊断SLN阳性病例中PET-CT与非SLN的符合情况(例)
讨论
当前,系统性纵隔淋巴结清扫术作为NSCLC根治手术治疗的标准术式,能够为患者术后的治疗提供准确分期的依据。在接受淋巴结清扫术的NSCLC(pT1-T2,N0,M0)患者中,近40%的患者术后发生转移或肿瘤复发[3-6]。其重要原因一方面是未能在早期发现局部淋巴结的微转移外,另一方面是未能行合理淋巴结清扫[7]。但是,到底有多少NSCLC患者(尤其是Ⅰ期)能从系统性纵隔淋巴结清扫术中得到根本获益,据Nomori等[8]报道在接受系统纵隔淋巴结清扫术的Ⅰ期NSCLC患者中,只有5%的患者会从中根本受益。如何从接受手术切除的众多NSCLC患者中区分适合接受系统纵隔淋巴结这一部分受益人群呢?
肿瘤淋巴结转移一般遵循先转移至SLN再向远处转移的规律。Moton等[9]采用术中在肿瘤周围注射异舒泛蓝的方法寻找蓝染淋巴结,取出后送病理检查,根据SLN的病理诊断结果决定是否行颈淋巴结清扫术。Albertiai等[10]在报告中指出 SLN组织学检查的准确率为95%,SLN阴性的患者颈淋巴结转移的可能性小于2%。我们在肺癌患者术中应用异舒泛蓝淋巴显像及SLN活检的方法,探讨PETCT在肺癌SLN中的应用价值及对纵隔淋巴结清扫的影响。
CT诊断淋巴结转移主要是依据淋巴结的大小和形状,一般以淋巴结长径>10 mm且无明显钙化作为肺癌淋巴结转移的诊断标准,其诊断的敏感度和特异度都不高,Webb等[11]在1991年研究表明,单独用CT诊断淋巴结,其假阴性和假阳性分别高达21%和40%,尽管如此,Al-Sarraf等[12]在分析淋巴结微转移的高危因素研究中,对215例患者临床资料进行分析后认为:N2组淋巴结若在CT影像上明显肿大(>10 mm),即使在PET-CT上无FDG高摄取,也是N2容易发生微转移的高危因素,其他高危因素还包括原发肿瘤的位置,尤其肿瘤发生于右肺上叶,由于解剖结构的特殊,其早期就很容易发生跳跃性转移造成4组和7组淋巴结发生转移[13],这与我们的研究一致,也能很好地解释在本研究中发生于右肺上叶的肿瘤为何多伴有跳跃性转移。
PET-CT在预测N1转移方面的价值仍存在着争论,其对N1识别准确率的报道由42%到80%不等[14],远高于CT对N1识别的准确率13%[15]。在本研究中,PET-CT识别肺门淋巴结的准确率高达91.9%(34/37),但对N1组(11、12组)识别的准确率为37.8%(14/37),低于其他有关报道,可能与本研究选择的患者中有较多的11组和12组转移,容易受肺间血管的部分容积效应影响,导致PET-CT检测效应丧失。然而,PET-CT在识别N2淋巴结转移的优势已被广泛肯定[16-18]。本研究中,PET-CT对N2识别的准确率达91.9%(34/37),有3例患者N2组发生隐匿性转移(术前PET-CT无高摄取),其中有两例N2组术中被蓝染,分别作为第1(SLN)和第2蓝染组被清扫,假阴性率被纠正了66.7%(2/ 3),其假阴性原因可能是这些N2组作为肿瘤淋巴引流的优先“接收站”,起初只含有微小的癌细胞转移灶,未能达到PET-CT的分辨率,但其淋巴引流通畅,容易快速发生蓝染,提示SLN作为淋巴引流第1站更容易早期发生转移,因此,术中将有FDG高摄取和SLN以及其他发生蓝染的淋巴结均做清扫,可以明显提高阳性淋巴结清除率,避免遗漏。
SLN探测技术应用于肺癌有助于提高淋巴结隐匿性转移的检出率,并有可能使部分早期NSCLC患者避免接受创伤较大的广泛淋巴结清扫术,减少术后并发症的发生率,也促进了对肺癌手术治疗禁忌证的重新评估,使一部分肺功能较差的尤其是肺气肿的患者获得手术治疗机会。Kitagawa等[19]学者同样认为,在不影响治疗效果或患者生存期的前提下,应尽可能缩小淋巴结清扫范围。本研究借助PET-CT术前诊断的淋巴结转移信息,结合术中SLN的探测引导技术做淋巴结清扫,结果显示经PET-CT诊断的SLN的总符合率为81.1%;在19例经病理证实为阳性SLN的患者中(包括隐匿性转移3例),4例SLN单独转移,有15例(78.9%)患者合并其他淋巴站转移。以上结果提示我们,当SLN在术中行快速冰冻切片病理结果为阳性时,其他淋巴站很可能也伴有转移,应该行系统纵隔淋巴结清扫术。在18例经病理证实为阴性SLN的患者中,有15例患者在术前经PET-CT诊断为N0,病理证实无淋巴结转移的11例,有4例(22.2%)腺癌患者发生其他淋巴站转移,肿瘤长径>3 cm。以上提示当SLN在术中行快速冰冻切片病理结果为阴性,尤其是肿瘤长径<3 cm,病理类型为鳞癌时[20-21],其他淋巴站伴有转移的可能性很小,可减少系统性淋巴结清扫范围,但术前CT显示纵隔淋巴结有明显肿大(>10 mm)、融合或PET-CT检查示纵隔淋巴结有明显FDG高摄取时,建议可采取选择性纵隔淋巴结清扫,但对于7组淋巴结,Kim等[22]认为它是上下纵隔淋巴结汇集处,也可能是向对侧转移的“突破口”,下叶肺癌向隆突转移更为多见,该处应行根治性淋巴结切除。
本组结果显示,肺腺癌纵隔淋巴结转移多于鳞癌以及其他类型肺癌,这是由于腺癌患者发生转移较早且较多,也容易发生跳跃性转移。有文献显示,腺癌纵隔淋巴结转移率为57.1%(40/70),鳞癌为29.6(74/250)[23]。本组腺癌纵隔淋巴结转移率为52.2%(12/23),高于鳞癌的11.1%(1/9),虽然病例数较少,但结果也强烈提示腺癌纵隔淋巴结转移率高于鳞癌。
综上所述,PET-CT能较准确地鉴别阳性SLN,借助PET-CT术前诊断的淋巴结转移信息结合术中SLN的探测引导技术,可以丰富对肺癌淋巴结转移规律的认识,为术中选择合理淋巴结清扫术式提供依据;同时,又能使外科医师缩小非治疗作用的淋巴结清扫范围,进而减少并发症的发生。但SLN在肺癌领域的研究和应用比起在乳腺癌和黑色素瘤仍有较大差距,还有许多问题需要解答。除了进一步消除SLN概念适用于肺癌的疑虑外,在病例的选择、示踪剂的选择、注射途径和方法、获取SLN的时间等技术方面都有待完善。
1 ZhongW, Yang X, BaiJ, etal. Complete mediastinal lymphadenectomy:the core component of multidisciplinary therapy in resectable non-small cell lung cancer[J].Eur J Cardiothorac Surg,2008,34(1):187-195.
2 Detterbeck FC,Boffa DJ,Tanoue LT.The new lung cancer staging system[J].Chest,2009,136(1):260-271.
3 Melfi MA,Chella A,Mencon GF,et al.Intraoperative radioguided sentinel lymph node biopsy in non-sm all cell lung cancer[J].Eur J Cardio-thoracic Surg,2003,23(2):214-220.
4 Soltesz EG,Kim S,Laurence RG,et al.Intraoperative sentinel lymph node mapping of the lung using near-infrared fluorescent quantum dots[J].Ann Thorac Surg,2005,79(1):269-277.
5 Pulte D,Li E,Crawford BK,et al.Sentinel lymph node mapping and molecular staging in non-small cell lung carcinoma[J].Cancer,2005,104(7):1453-1461.
6 Atinkaya C,Ozlem Kücük N,Koparal H,et al.Mediastinal intraoperative radioisotope sentinel lymph node mapping in nonsmall-cell lung cancer[J].Nucl Med Commun,2005,26(8): 717-720.
7 Tsang GM,Watson DC.The practice of cardiothoracic surgeons in the perioperative staging of non-small cell lung cancer[J].Thorax,1992,47(1):3-5.
8 Nomori H,Iwatani K,Kobayashi H,et al.Omission of mediastinal lymph node dissection in lung cancer:its techniques and diagnostic procedures[J].Ann Thorac Cardiovasc Surg,2006,12(2):83-88.
9 Morton DL,Wen DK,Wong JH,etal.Technicaldetails of Tntraoperatine lymphatic mapping for early stage melanoma[J].Arch surg,1992,127(4):392-399.
10 Albertiai JJ, CruseCW, RaparortD, etal.Imtraoperative radiolymphoscintigraphy improves sartinel lymph made identification for patients with melanoma[J].Avn Surg,1996,223(2): 217-224.
11 Webb WR,Gastonis C,Zerhouni EA,et al.CT and MR imaging in staging non-smallcellbronchogeniccarcinoma: reportofthe radiologic diagnostic oncology group[J].Radiology,1991,178(3): 705-713.
12 Al-Sarraf N,Aziz R,Gately K,et al.Pattern and predictors of occult mediastinal lymph node involvement in non-small cell lung cancer patients with negative mediastinal uptake on positron emissiontomography[J].Eur J Cardiothorac Surg,2008,33(1):104-109.
13 Kotoulas CS,Foroulis CN,Kostikas K,et al.Involvement of lymphatic metastatic spread in non-small cell lung cancer according to the primary cancer location[J].Lung Cancer,2004,44(2):183-91.
14 Cerfolio RJ,Ojha B,Bryant AS,et al.The accuracy of integrated PET-CT compared with dedicated PET alone for the staging of patients with non-small cell lung cancer[J].Ann Thorac Surg,2004,78(3):1017-1023.
15 Halter G,Buck AK,Schirrmeister H,et al.Lymph node staging in lung cancer using FDG-PET[J].Thorac Cardio Surg,2004,52(2): 96-101.
16 Cuaron J,Dunphy M,Rimner A.Role of FDG-PET scans in staging,response assessment and follow up care for non-small cell lung cancer[J].Front Oncol,2012,2:208.
17 杨文锋,于金明,付政,等.18F-脱氧葡萄糖PET-CT与强化CT对非小细胞肺癌区域淋巴诊断价值的评价[J].中华肿瘤杂志,2009,31(12):925-928.
18 吴仪仪,张建,左长京,等.PET/CT与增强CT对肺癌淋巴结诊断及分期的比较[J].临床肺科杂志,2014,19(10):1846-1848.
19 Kitagawa Y,Ohgami M,Fujii H,et al.Laparoscopic detection of sentinel lymph nodes in gastrointestinal cancer:a novel and minimally invasive approach[J].Ann Surg Oncol,2001,8(9 Suppl):86S-89S.
20 Sakurai H,Asamura H,Watanabe S,et al.Clinicopathologic features of peripheral squamous cell carcinoma of the lung[J].Ann Thorac Surg,2004,78(1):222-227.
21 Asamura H,NakayamaH, KondoH, etal.Lymphnode involvement,recurrence,and prognosis in resected small peripheral non-small-cell lung carcinoma:are these caicinomas candidates for video-assisted lobectomy?[J]Thorac Cardiovasc Surg,1996,111 (6):1125-1134.
22 Kim AW.Lymph node drainage patterns and micrometastasis in lung cancer[J].Semin Thorac Cardiovasc Surg,2009,21(4):298-308.
23 王论青,张哲,尹志伊,等.原发性肺癌淋巴结转移清除临床价值的探讨[J].中华肿瘤防治杂,2008,15(18):1408-1410.
Application of18F-deoxyglucose PET-CT in diagnosingpositivesentinel lymph nodesofperipheral non-small cell lung cancer
Hao Shaoyu1,Han Dan2,Zhang Baijian1,Song Pingping1,Liu Xibin1,Song Zheng-zheng1,Fu Zheng3.1Department 6 of Thoracic Surgery,2Department of Radiation Oncology,3PET/CT Center,Shandong Province Cancer Hospital,Jinan 250117,China
Zhang Baijiang,Email:zhbaijiang@sina.com
Objective To analyze the sensitivity,specificity and accuracy as well as correlation of positive lymph nodes diagnosed by18F-deoxyglucose positron emission computed tomography(PET-CT)and sentinel lymph nodes(SLN)detected using blue dyes in lymph node metastasis of peripheral non-small cell cancer(NSCLC),and investigate the value of PET-CT in SLN of lung cancer and its significance with mediastinal lymph nodes dissection.Methods Sixty patients with resectable peripheral NSCLC were randomly selected from Shandong Province Cancer Hospital between July 2012 and June 2014 in this study.All patients underwent integrated PET-CT before operation for lymph node staging.The first lymph nodes to stain blue with oleophilic isosulfan blue dye defined as SLN were sent separately for fast pathological examination at thoracotomy,then all the non-SLN detected intraoperatively were also sent for hematoxylin-eosin(H-E)staining and immunohistochemical examination after pneumectomy.Pathological diagnosis was served as golden standard for comparing PET-CT with SLN.Results Atthoracotomy,SLNs were successful identified in 37 of 60 peripheral NSCLC patients injected with isosulfan blue dye,and the rate of SLN detection was 61.7%.Eighty-five blue-stained SLNs were resected.Of them,52 SLNs in 18 patients were proved negative,while 15 of these 18 patients were diagnosed N0 by PET-CT before operation,and 4 patients(22.2%)had only non-SLN metastasis.Thirty-three SLNs in 19 patients were proved positive,while 15 patients including 25 SLNs were diagnosed positive by PET-CT before operation,with the sensitivity,specificity,positive predictive value,negative predictive value and coincidence rate of PET-CT for SLN diagnosis of 78.9%(15/19),83.3%(15/18),83.3%(15/18),78.9%(15/19)and 81.1%(30/ 37),respectively.Conclusions Integrated PET-CT diagnoses SLN quite precisely.PET-CT shows high coincidence rate for clinical staging and postoperative pathological staging in NSCLC.Combined PET-CT and SLN procedure facilitates the precise estimation of localized lymph node involved as well as the determination of relevant pattern of lymphadenectomy,which may accordingly have important impact on the prognosis and postoperative treament in NSCLC patients.
Carcinoma,non-small cell lung; Tomography,emission-computed; Lymph node; Diagnosis
2015-01-09)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2015.01.009
山东省自然科学基金项目(ZR2013HL046)
250117 济南,山东省肿瘤医院外六科1,放射肿瘤科2,PET/CT中心3
张百江,Email:zhbaijiang@sina.com
在60例接受手术切除的周围性NSCLC患者中,术中有37例应用异舒泛蓝染料法成功识别出蓝染SLN,SLN检出率达61.7%(37/60)。共清扫出蓝染SLN 85枚,有18例患者中共52枚SLN未查到转移癌细胞,其中有15例患者在术前经PET-CT诊断为N0,有4例患者(22.2%)发生非前哨淋巴结(non-SLN)转移;有19例患者中共33枚SLN查到转移癌细胞,其中有15例患者共25枚SLN在术前经PETCT诊断为阳性,PET-CT诊断SLN的灵敏度为78.9%(15/19),特异度为83.3%(15/18),阳性预测值为83.3%(15/18),阴性预测值为78.9%(15/19),符合率为81.1%(30/37)。结论 PET-CT能较准确的鉴别阳性SLN。PET-CT对NSCLC的临床分期和术后病理分期的符合率高。将PET-CT和SLN技术结合,可以促进对区域淋巴结转移的准确评估和淋巴结清扫术的正确选择,从而对患者预后和术后治疗方式产生重要影响。
郝少雨,韩丹,张百江,等.18F-脱氧葡萄糖PET-CT在鉴别周围性非小细胞肺癌阳性前哨淋巴结中的价值[J/CD].中华胸部外科电子杂志,2015,1(1):48-54.

