晚发型抑郁症伴轻度认知损害患者脑白质胆碱能通路的对照研究
潘园园 刘 羽 孙 剑△ 李 宁
①中国.江苏大学临床医学院(江苏镇江) 212013 ②解放军102 医院精神二科 △通讯作者 E-mail:pizza4771@aliyun.com
晚发型抑郁症(Late-onset depression,LOD)是老年期抑郁症的一个特殊亚型,指首次起病于60 岁以后的原发性抑郁症,以区别于早发型老年期抑郁症。除临床有较多激越、躯体性焦虑表现外,LOD的一个最显著特点常伴有认知功能的损害,即使在临床症状缓解期也是如此[1-2]。严重者可出现轻度认知功能损害(Mild cognitive impairment,MCI)。MCI 是一种介于正常衰老与轻度痴呆之间的认知功能缺损状态,以获得性认知功能障碍、但不伴有显著的日常生活能力下降为特点。MCI 是正常认知水平向阿尔茨海默病(AD)转化的临床过渡状态。MCI患者是AD 的高危人群[3],美国神经病学研究所报道每年有6%~25%MCI 患者转变为AD,而正常老年人每年仅1%~2%发展为AD。
前期我们对LOD 患者脑白质胆碱能神经通路的神经影像学改变,进行了比较观察[4]。初步结果发现,与性别、年龄匹配的健康老年人相比,LOD 患者存在脑白质胆碱能通路受损,其程度与LOD 患者整体的认知功能改变有一定的相关性。但作为探索性研究并受限于样本量,该项研究并未对LOD 患者脑白质胆碱能神经通路改变、按其认知水平作进一步的分层分析。为进一步了解脑白质胆碱能神经通路与LOD 患者认知损害、特别是在LOD 患者伴有的MCI 发病机制中的作用,进行了本项研究,旨在通过对伴有/不伴有MCI 的抑郁症患者脑白质胆碱能神经通路半定量评价结果的对照、比较,并分析其与伴有MCI 的LOD 患者不同认知领域受损的关系,以进一步推进相关研究。
1 对象与方法
1.1 对象
来自本院2012年9月-2014年9月门诊或住院的抑郁症患者。均符合:①根据中国精神障碍分类及诊断标准第3 版诊断标准诊断为抑郁症;②年龄60~75 岁,首次抑郁发作时年龄≥60 岁;③24 项汉密尔顿抑郁量表(HAMD-24)得分≥20 分;③近2 周内未使用过抗抑郁药治疗、电抽搐治疗;④配合检查、非文盲(受教育程度>1年);⑤Hachinski 缺血指数(HIS)<4 分。排除:①神经系统疾病,如帕金森病、脑卒中、感染性或退行性脑病、脑肿瘤等;②严重内科疾病,如心肺功能不全、甲状腺功能低下、严重糖尿病等;③有酒依赖及其它精神活性物质滥用病史;④使用可能影响认知功能的药物,如抗胆碱能药物、胆碱脂酶抑制剂等。
所有入组患者,根据是否伴有MCI 分为研究组(LOD 伴MCI)、对照组(LOD 不伴MCI)。MCI 根据Petersen 等提出的诊断标准[5]:①有记忆障碍的主诉,至少3月,由患者本人、家属或知情人提供;②有记忆减退的客观检查证据,表现为听觉词语记忆测验(Auditory verbal memory test,AVMT)的延迟回忆成绩低于年龄、文化相匹配的常模1.5 个标准差[6];③一般认知功能正常,简易精神状态量表(Mini mental state examination,MMSE)小学≥20 分、初中及以上≥24 分[7];④日常生活能力保留;日常生活活动量表(Activities of daily living,ADL)≤26 分[8];⑤没有足够的认知障碍诊断为痴呆,临床痴呆评定量表(Clinical dementia rating,CDR)为0 分或0.5分。
共入组50例,研究组、对照组各25例。研究组男性10例、女性15例;平均(64.9±3.7)岁;平均首次起病年龄(62.3±2.0)岁;HAMD-24 评分(27.8±5.5)分;总病程(9.5±4.8)月;受教育年限(8.4±2.9)年。对照组男性12例、女性13例;平均(64.0±3.3)岁;平均首次起病年龄(63.0±2.4)岁;HAMD-24 评分(26.8±5.9)分;总病程(7.5±4.0)月;受教育年限(8.8±3.6)年。经检验,2组以上各项无显著差异(P 均>0.05)。本研究经解放军第102 医院医学伦理委员会批准,并获受试者本人及家属同时签署的知情同意书。
1.2 方法
本研究为横断面研究设计。
1.2.1 胆碱能通路高信号评分(Cholinergic pathways hyperintensities scale,CHIPS) 对照文献[4,9]进行。MRI(3.0T)常规扫描(T1、T2 序列)基础上,行FLAIR 序列扫描。CHIPS 评分方法为:左右半球分别计分,分别取外囊下部、外囊上部、放射冠和半卵圆中心4 个层面进行评分,0 分为无病变,1 分为病变面积小于该区域面积的50%,2 分为病变面积大于等于该区域面积的50%。其中外囊下部层面分为前部和后部,得分各按乘以权重计入总分;外囊上部层面分为扣带回、前部和后部,扣带回计权重为4,后二者加权计为3;放射冠层面分为前部、后部和扣带回,前二者计加权为2,扣带回计加权为1;半卵圆中心分为前部、后部,分别计加权1 计入总分。各部位加权后得分求和得到CHIPS 评分总分。
1.2.2 认知功能评估 与MMSE 相比,蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)对MCI 的敏感性显著较高[10],是评估轻度认知功能损害较新量表,评估的认知方面较全,包括视空间与执行功能(5 分)、命名(3 分)、延迟记忆(5 分)、注意及工作记忆(6 分)、语言(3 分)、抽象思维(2分)、定向(6 分)共7 个认知方面,总分共30 分,计算总分时,受教育年限≤12年者加1 分以校正受教育程度偏倚[11]。本研究采用的是MoCA 北京版;所有受试者统一由1名高年资心理测定人员负责进行检查,具体操作按该版本使用手册严格执行。
1.2.3 其它量表评定 AVMT、MMSE 由1名高年资心理测定人员负责进行,ADL 等量表评定由1名精神科主治医生负责进行。
1.3 统计处理
所有数据录入微机后,采用SPSS 16.0 软件进行分析。计量、计数资料的组间比较,分别采用t 检验、χ2检验;相关性分析采用简单相关系数法。
2 结 果
2.1 两组MoCA 评分和CHIPS 评分的比较
研究组MoCA 总分、视空间与执行功能、延迟记忆、注意及工作记忆得分,均显著低于对照组,差异有统计学意义,研究组CHIPS 评分显著高于对照组,差异有统计学意义,见表1。
表1 研究组与对照组MoCA、CHIPS 评分结果的比较(±s,n=25)
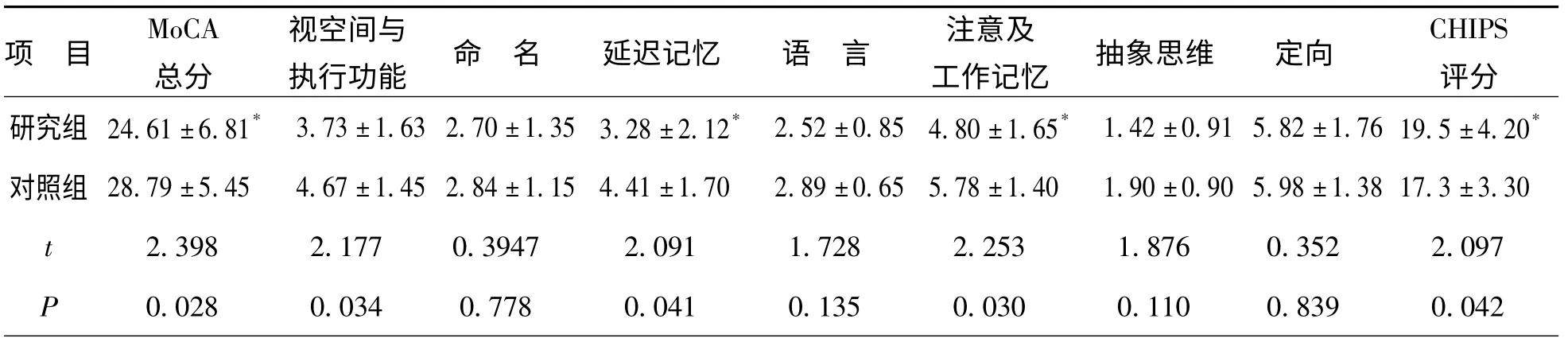
表1 研究组与对照组MoCA、CHIPS 评分结果的比较(±s,n=25)
注:* P <0.05
CHIPS项 目MoCA总分视空间与执行功能 命名 延迟记忆 语 言 注意及工作记忆 抽象思维 定向评分研究组 24.61±6.81* 3.73±1.63 2.70±1.35 3.28±2.12* 2.52±0.85 4.80±1.65* 1.42±0.91 5.82±1.76 19.5±4.20*对照组 28.79±5.45 4.67±1.45 2.84±1.15 4.41±1.70 2.89±0.65 5.78±1.40 1.90±0.90 5.98±1.38 17.3±3.30 t 2.398 2.177 0.3947 2.091 1.728 2.253 1.876 0.352 2.097 P 0.028 0.034 0.778 0.041 0.135 0.030 0.110 0.839 0.042
2.2 相关性分析
相关分析显示,研究组CHIPS 评分与MoCA 总分、视空间与执行功能、延迟记忆得分显著负相关(r=-0.434,-0.398,-0.483;P=0.030,0.046,0.015);与视空间与执行功能、命名、语言、抽象思维、定向的相关性不显著(r =-0.347,-0.199,-0.277,-0.285;P>0.05)。
3 讨 论
越来越多的研究观察到,LOD 与认知功能损害关系密切。横断面研究发现,LOD 患者的认知功能显著年龄、性别等匹配的同龄非抑郁老年人[12];LOD 患者认知功能的受损,甚至在抑郁症状缓解期也同样显著。前瞻性研究则进一步证实了上述观点,发现LOD 比早发抑郁患者出现MCI 或AD 的比例显著要高;故目前LOD 被认为是痴呆的危险因素之一[13]。本研究通过神经心理学测定发现,LOD 伴MCI 患者不仅有整体认知功能的下降及延迟记忆的受损,视空间与执行功能、注意及工作记忆水平也显著较对照组为低。既往也有大量研究发现,LOD 伴MCI 患者认知损害涉及各认知功能领域,除突出表现为回溯记忆障碍外[13],累及注意及视空间能力、执行功能甚为常见[14-15],本研究结果与此一致。
目前对LOD 患者出现MCI 甚至最后进展为痴呆的原因,尚存在不同的观点。其Alexopoulos 等提出的血管性抑郁假说得到了不少研究的支持。Alexopoulos 等认为,单独血管损伤或者持续性的小血管损伤积累,可造成前额叶系统的功能障碍,并引起患者相应情绪、认知能力的受损。大量影像学研究结果发现,LOD 患者存在脑部结构的器质性微病变,与血管性痴呆的前驱期改变相似[16],支持Alexopoulos 等的观点。在血管性抑郁假说的启发下,近年有不少研究关注到脑白质病变与LOD 的关系。如众所知,脑白质主要由细而长的深穿支动脉供血,其分支垂直且短,而侧脑室旁的白质又处于动脉分界区,故当局部或全身血流量异常改变时,这些部位更易于受损,出现深穿支小动脉硬化或闭塞,从而最后形成脑白质疏松,在MRI 检查中则表现为脑白质高信号(White matter hyperintensities,WMHs),并成为痴呆发生的基本病理机制之一,国外在大样本研究中证实,WMHs 与认知功能损害关系密切[13]。
CHIPS 评分是WMHs 的半估定量方法之一,较之总体脑白质高信号Schelten、Blennow、Fazeka 评分等,与认知功能有更为密切的关系[17],这是因为CHIPS 评分主要是针对脑白质胆碱通路WMHs,脑白质胆碱能通路则是公认的、与认知功能关系最为密切的神经环路之一,也是目前解释认知障碍最为重要的神经病理学基础[18]。本研究以此为工具,对LOD 患者发生MCI 的成因进行探讨。本研究结果显示,与对照组相比,存在MCI 的LOD 患者CHIPS评分显著性增高,提示脑白质胆碱能通路的受损,或是LOD 患者认知严重受损、发生MCI 的可能原因之一。在此基础上,我们进一步对CHIPS 评分与Mo-CA 总分、各认知领域得分的相关性进行了分析,结果提示,脑白质胆碱能通路受损越重者,其整体认知功能下降水平越为显著,特别是与视空间与执行功能、延迟记忆的受损。执行功能损害是LOD 患者最为常见的认知损害[19],视空间能力受损则在抑郁症状改善后的LOD 患者中也较有发现[20]。有在帕金森患者的研究中发现,尾状核头部至额叶背外胆碱能投射通路,与患者伴有MCI 时的出现执行功能异常有关[21],抗胆碱能药物可进一步加重这一损害过程,且与所服药物的剂量和时间呈正相关[22];侧脑室周围的胆碱能通路,或涉及空间视觉的形成机制[23];而基底核发出的通往皮质和杏仁核的Meynert 胆碱能通路与记忆的关系,已得到较为广泛的认同,上述研究结论,从不同方面支持本研究结果。
综上所述,本研究结果提示,脑白质胆碱能通路受损可能与LOD 患者伴有的MCI 有关,特别是与其视空间执行能力、记忆及延迟记忆的受损关系更为密切。由于MCI 被认为是早期干预LOD 患者的痴呆进程最佳时间窗[24],而包括胆碱能通路在内的WMHs,是MCI 向痴呆转化的一个重要预测指标[25],因此针对血管性因素加强干预力度,均有助于延缓LOD 患者认知功能的进一步恶化。
[1]Sexton C E,McDermott L,Kalu U G,et al.Exploring the pattern and neural correlates of neuropsychological impairment in late- life depression[J].Psychol Med,2012,42(6):1195-1202
[2]李俊福,于艳萍.青年期和老年期抑郁症患者抑郁自评量表的对照研究[J].中国健康心理学杂志,2012,20(4):497-499
[3]Ritchie L J,Tuokko H.Patterns of cognitive decline,conversion rates,and predictive validity for 3 models of MCI[J].Am J Alzheimers Dis Other Demen,2010,25:592-603
[4]潘园园,李宁,刘羽,等.晚发型抑郁症患者脑白质胆碱能通路的磁共振研究[J].中国健康心理学杂志,2014,22(6):806-808
[5]严春梅,邓青南,钟武装.代谢综合征与轻度认知功能障碍的相关性[J].中华医学杂志,2011,91(45):3193-3195
[6]高中宝,王炜,王振福,等.具有痴呆倾向的老年轻度认知障碍患者神经心理学特点[J].中华医学杂志,2012,92(3):152-155
[7]佟久芬,杨绍清,佟德桓,等.盐酸多奈哌齐治疗老年轻度认知障碍的疗效观察[J].中国健康心理学杂志,2013,21(11):1644-1646
[8]佟久芬,郭淑英,陶秀娟,等.唐山市社区老年轻度认知障碍患者的调查分析[J].中国健康心理学杂志,2013,21(11):1642-1644
[9]黄纯臣,李林昕,韩翔,等.胆碱能通路损伤在血管性认知功能障碍中的作用[J].中华神经科杂志,2010,43(9):612-616
[10]Nasreddine Z S,高晶.蒙特利尔认知评估量表:一个检测轻度认知功能障碍和早期痴呆的工具[J].中华神经科杂志,2012,45(2):135-137
[11]Bernstein I H,Lacritz L,Barlow C E,et al.Psychometric evaluation of the Montrea1 Cognitive Assessment(MoCA)in three diverse samples[J].Clin Neuropsychol,2011,25(1):119-126
[12]姜文颢,袁勇贵,周红,等.晚发性抑郁症和轻度认知障碍及阿尔茨海默病的关联[J].中华精神科杂志,2011,44(4):253-255
[13]Tam C W,Lam L C.Cognitive function,functional performance and severityof depression in Chinese older persons with late-onset depression[J].East Asian Arch Psychiatry,2012,22(1):12-17
[14]Sexton C E,McDermott L,Kalu U G,et al.Exploring the pattern andneural correlates of neuropsychological impairment in late- life depression[J].Psychol Med,2012,42(6):1195-1202
[15]Yeh Y C,Tsang H Y,Lin P Y,et a1.Subtypes of mild cognitive impairment among the elderly with major depressive disorder in remission[J].Am J Geriatr Psychiatry,2011,19(11):923-931
[16]Tam C W,Lam L C.Cognitive function,functional performance and severity of depression in Chinese older persons with late-onset depression.East Asian Arch Psychiatry,2012,22(1):12-17
[17]黄纯臣,李林昕,韩翔,等.胆碱能通路损伤在血管性认知功能障碍中的作用[J].中华神经科杂志,2010,43(9):612-616
[18]Benedict R H,Smerbeck A,Parikh R,et al.Reliability and equivalence of alternate forms for the Symbol Digit Modalities Test:implications for multiple sclerosis clinical trials[J].Mult Scler,2012,18(21):1320-1325
[19]Kim B S,Lee D H,Lee D W,et a1.The role of vascular risk factors in the development of DED syndrome among an elderly community sample[J].Am J Geriatr Psychiatry,2011,19(2):104-114
[20]Potter G G,Wagner H R,Burke J R,et al.Neuropsych0logical predictors of dementia in late-life major depressive disorder[J].Am J Geriatr Psychiatry,2013,21(2):297-306
[21]Aarsland D,Bronnick K,Williams- Gray C,et al.Mild cognitive impairment in Parkinson disease:A multicenter pooled analysis[J].Neurology,2010,75(3):1062-1069
[22]Ehrt U,Broich K,Larsen J P,et al.Use of drugs with anticholinergic effect and impact on cognition in Parkinson's disease:A cohort study[J].J Neurol Neurosurq Psychiatry,2010,81(1):160-165
[23]Apostolova L G,Green A E,Babakehanian S,et al.Hippocampal atrophy and ventricular enlargement in normal aging,mild cognitive impairment(MCI),and Alzheimer Disease[J].Alzheimer Dis Assoc Disord,2012,26(1):17-27
[24]Kohler S,Thomas A J,Lloyd A,et al.White matter hyperintensities,cortisol levels,brain atrophy and continuing cognitive deficits in latelife depression[J].Br J Psychiatry,2010,196(2):143-149
[25]Prasad K,Wiryasaputra L,Ng A,et al.White matter disease independently predicts progression from mild cognitive impairment to Alzheimer's disease in a clinic cohort[J].Dement Geriatr Cogn Disord,2011,31(2):431-434

