5 株根瘤菌接种紫花苜蓿的效果
石茂玲,邓 波,刘忠宽,刘 静,史经昂
(1.中国农业大学动物科技学院草业科学系,北京100193;2.河北省农林科学院农业资源环境研究所,河北 石家庄050051)
土壤盐碱化严重威胁着世界灌溉农业的发展。我国有广阔盐渍土地,其中黄淮海平原是以氯化钠为主的典型滨海盐渍区,土壤盐碱化面积大,土壤表层的含盐量最高达到3.0%。沧州地区具有大面积的中低产田和盐碱荒地需要改良,仅东部就有旱(盐)碱地20 万hm2以上[1]。
根瘤菌是一类在土壤中有广泛分布的可以与豆科植物共生固氮的革兰氏阴性细菌。苜蓿-根瘤菌的共生固氮可以提高苜蓿产量,改善品质。根瘤菌与豆科植物的有效共生受到共生体双方本质及环境的影响和控制[2]。研究表明,根瘤菌剂接种存在一些问题,如土壤中生存竞争性能不如土著根瘤菌,菌剂施用广谱性能不佳,菌剂对特定品种的豆科植物的专一性,菌剂施用的地域和环境差异[3]。为了获得最佳的增产效果,根瘤菌选种时需针对种植的生态环境及寄主植物两方面因素选择最佳匹配的根瘤菌[4-6]。以往的大多研究缺乏盐碱土壤中苜蓿―根瘤菌共生匹配性的田间试验研究。此外,为了获得稳定的接种效果,还开展了接种方式对豆科牧草产量与固氮效果影响的研究,表明在不同的地区和生产模式下选择不同的接种方式才能获得稳定的效果[7]。本研究以5株耐盐快生型苜蓿中华根瘤菌为材料,分别采用包衣接种和液体菌剂拌种方式对“中苜1 号”苜蓿(Medicago sativa cv. Zhongmu No.1)进行接种,于滨海盐碱地上开展田间试验,筛选适合滨海盐碱土壤与“中苜1 号”苜蓿的高效共生根瘤菌及其最佳接种方式,为根瘤菌剂的生产应用提供科学依据。
1 材料与方法
1.1 试验地概况
试验在河北省南大港国家牧草产业技术体系沧州综合试验地内进行。位于沧州市东北部,38°23'35″― 38°33'44″ N,117°18'15″― 117°38'17″E。试验地土壤理化性质如表1 所示。
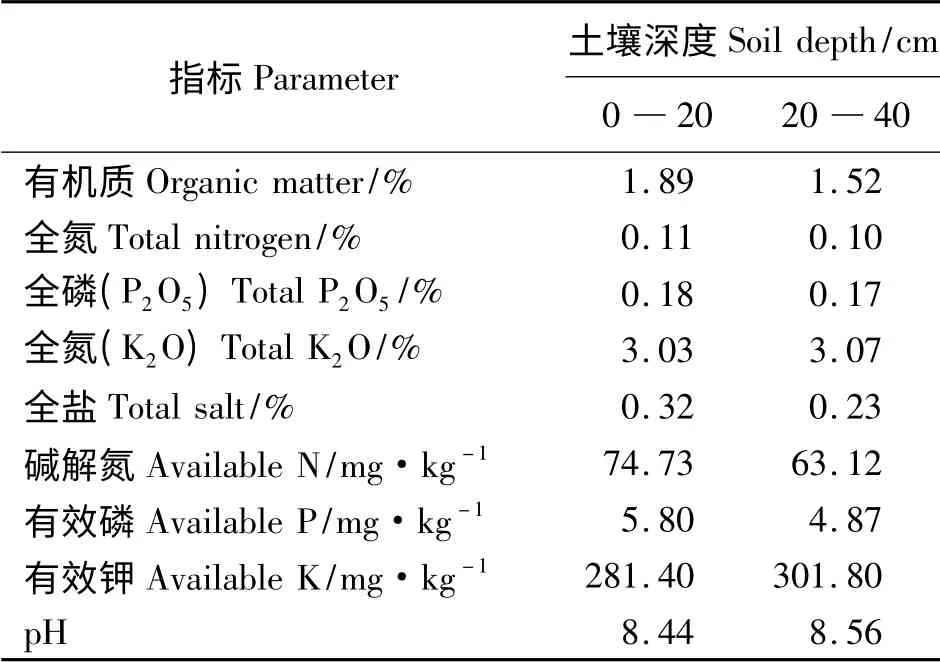
表1 试验地土壤理化性质Table 1 The properties of the soil in the experimental field
1.2 供试材料
选用在黄淮海平原、渤海湾一带广泛种植的耐盐紫花苜蓿品种“中苜1 号”,种子由中国农科院北京畜牧兽医研究所提供。所用菌株为耐盐快生型苜蓿中华根瘤菌,编号为ACCC17537、ACCC17558、ACCC17617、ACCC17631 和ACCC17676,由中国农业科学院中国农业微生物菌种保藏管理中心提供。5 菌株的菌落形态特征、生理生化反应及抗逆性见周冀琼等[8]的研究。
试验地为农用耕地,平整,肥力均匀。前茬作物为“中苜1 号”紫花苜蓿。
1.3 试验方法
1.3.1 根瘤菌培养 将供试菌株挑起单菌落接种在YMA 培养基上,28 ℃培养48 h 后,用无菌水洗脱菌体,接种到YMA 液体培养基中,28 ℃下,摇床中150 r·min-1震荡培养48 h,用漩涡打旋器混匀菌体,测定OD600nm值,保证田间接种时每粒种子的含菌量大于109。
1.3.2 包衣及拌种
包衣配方及制作。1)传统根瘤菌吸附剂配方(500 g)的制备:泥炭488.5 g;蔗糖1 g;过磷酸钙0.5 g;石灰10 g;钼酸钠(0. 5%)l mL;硼酸(0.5%)1 mL,121 ℃高压灭菌30 min。2)将制备好的菌液按1∶ 2的比例加入灭菌后的根瘤菌吸附剂中。3)取15 g 根瘤菌剂加入4 ~5 mL 浓度为4%的粘着剂(羟甲基纤维素钠),搅拌均匀,再加入100 g 种子,反复搅拌,使每粒种子上都粘有根瘤菌剂。4)最后加30 g 膨润土反复搅拌,使每粒种子都裹上一层丸衣材料,将丸衣种子置于通风处,阴干待用。
液体菌剂拌种:播种量为18 kg·hm-2,拌种时液体菌剂含活菌数不少于109mL-1,用量1 500 mL·hm-2,菌液与种子混匀后阴干,于当天播种。
1.3.3 田间试验设计 试验于2013 年5 -11 月进行,采用二因素(接种方式和根瘤菌菌株)随机区组设计,以不含根瘤菌的包衣处理和不含根瘤菌的液体菌剂拌种处理为对照,重复3 次,共36 个小区,小区面积为2.5 m×2 m,小区与小区间隔30 cm,四周各有1 m 的保护行。5 月18 日条播,行距为30 cm,播深为1 ~2.5 cm,每个小区播种量为9 g。将各处理种子按小区设计均匀撒入播种行后覆土。分别于苗期和每次刈割后人工拔除田间杂草,生长期内按大田管理进行正常灌水排水并及时消灭鼠害。
1.3.4 测定项目及内容
于2013 年8 月7 日,在紫花苜蓿初花期时,待植株结瘤后对每处理小区进行随机采样,测定各项指标。
地上生物量:进行定株试验,测得苜蓿单株地上干物质重量。
根瘤数:每一小区随机取10 株苜蓿,挖土深度为30 cm,用水仔细冲洗后计算单株总根瘤数和有效根瘤数。
干草产量:分别于2013 年8 月8 日,9 月29 日,11 月8 日选取生长均匀一致1 m2样方内植株进行收获测产。测定鲜草产量,取一部分样品在70 ℃烘箱中烘干24 h,计算干草产量,全年共刈割3 茬。
干草粗蛋白质:用凯氏定氮法[5]测定。
根瘤固氮酶活性用乙炔还原法[9]测定。
1.4 数据处理
采用Excel 2007、SAS 8.0 统计软件进行数据分析和处理,用平均值和标准误表示测定结果。为了使数据符合正态分布,统计分析前将各茬及全年干草产量数据进行lg 转换。
2 结果与分析
2.1 不同接种方式对苜蓿生长和共生固氮效率的影响
采用包衣接种和液体菌剂拌种根瘤菌菌株时,根瘤菌结瘤数量、苜蓿单株地上部分干重、苜蓿产量均表现为包衣接种显著大于液体菌剂拌种(P <0.05),表明包衣接种的效果优于液体菌剂拌种,有利于苜蓿生长和提高共生固氮效率(表2)。因此,采用包衣接种方式继续研究不同根瘤菌菌株对“中苜1 号”生长和共生固氮效率的影响。

表2 不同接种方式对苜蓿生长和共生固氮效率的影响Table 2 Effects of different inoculation methods on the growth and symbiotic nitrogen fixation efficiency of alfalfa
2.2 包衣接种根瘤菌对苜蓿生长和共生固氮效率的影响
2.2.1 接种根瘤菌对“中苜1 号”苜蓿各茬、全年产量及单株地上部分生物量的影响 5 株根瘤菌包衣接种后,全年苜蓿干草产量均有所提高。前两茬以及全年总产量各处理间无显著差异(P >0.05),但不同菌株在不同茬次提高幅度不同(表3)。刈割第1 茬时,接种ACCC17537、ACCC17558 和ACCC17617 菌株效果较好,比对照分别增产42.2%、60.6%和65.9%;刈割第2 茬时,接种ACCC17558、ACCC17617和ACCC17631菌后效果较好,比对照分别增产61.7%、27.7%和21.5%;刈割第3 茬时,ACCC17558 和ACCC17617 菌后效果最好,比对照分别增产41.9%和13.6%,但接种ACCC17558 与ACCC17631 间差异不显著(P >0.05)。从全年干草总产量情况看,菌株ACCC17537、ACCC17558 和ACCC17617 的增产效果较好,比对照分别增产28.2%、57.9%和50.0%。
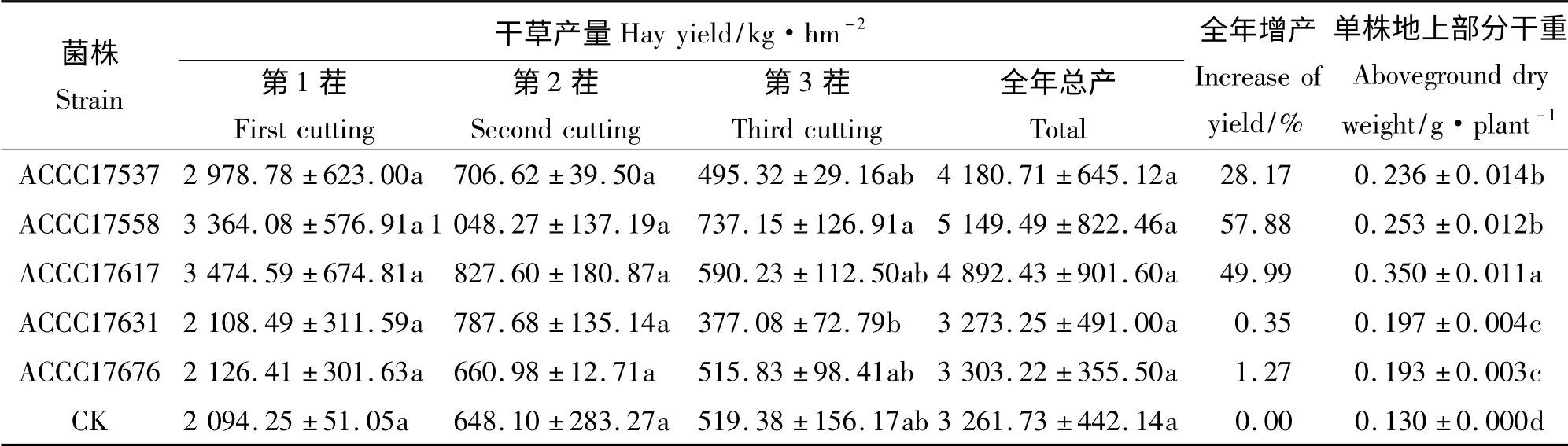
表3 包衣接种根瘤菌对中苜1 号各茬和全年干草产量及单株地上部分干重的影响Table 3 Effects of seed coating with different rhizobial strains on hay yield and aboveground dry weight of alfalfa
接种根瘤菌后,5 菌株处理与对照间单株地上部分干重差异显著(P <0.05)。对苜蓿单株地上部分生物量贡献最大的菌株是ACCC17617,单株地上部分干重为0. 350 g,显著高于其他菌株;其次是ACCC17558 和ACCC17537,分别为0.253 和0.236 g,显著高于ACCC17631 和ACCC17676。
说明“中苜1 号”分别接种菌株ACCC17558和ACCC17617 后,促进苜蓿生长的效果最好。
2.2.2 接种根瘤菌对“中苜1 号”苜蓿结瘤和固氮的影响 对于“中苜1 号”单株总根瘤数的影响,5菌株处理均与对照差异显著(P <0. 05)。ACCC17676 结瘤效果最好,单株总根瘤数为38.4 个,显著高于其他菌株;其次是ACCC17617 和ACCC17558,分别为30.7 个和29.5 个,显著高于ACCC17537 和ACCC17631;ACCC17537 与ACCC17631间差异不显著(P >0.05)。表明菌株ACCC17676、ACCC17617 和ACCC17558 接种能明显增加苜蓿单株总根瘤数(表4)。
对于单株有效根瘤数的影响,5 菌株处理均与对照间差异显著(P <0.05),ACCC17676 单株有效根瘤数最多,为34.2 个,显著高于其他菌株;其次是ACCC17617 和ACCC17558,分别为27.0 个和26.9个,显 著 高 于 ACCC17537 和 ACCC17631;ACCC17537 与ACCC17631 间差异不显著(P >0.05)。表明菌株ACCC17676、ACCC17617 和ACCC17558接种能明显增加苜蓿单株有效根瘤数。
从苜蓿有效根瘤数与总根瘤数上看,接种苜蓿比对照有显著的提高,且单株总根瘤数和单株有效根瘤数表现出一致性:ACCC17558、ACCC17617 和ACCC17676 是结瘤性能强的菌株。

表4 包衣接种根瘤菌对中苜1 号单株根瘤数、粗蛋白含量及根瘤固氮酶活性的影响Table 4 Effects of seed coating with different rhizobial strains on total and effective nodules,crude protein per plant and nitrogenase activity of nodules
与对照相比,包衣接种5 菌株后,苜蓿植株粗蛋白含量都显著增加(P <0.05),且各处理间差异较大。单株粗蛋白含量在18.26% ~21.00%,高于对照7.0% ~23.1%,以ACCC17537 含量最高,显著高于其他菌株;其次是ACCC17617 和ACCC17676,分别为19.16%和19.05%,显著高于ACCC17558和ACCC17631。表明接种菌株ACCC17537、ACCC17617 和ACCC17676 能明显提高苜蓿植株地上部分粗蛋白含量。
从固氮酶活性来看,包衣接种5 菌株与对照间以及各菌株间差异均不显著(P >0.05)。且根瘤固氮酶活性与单株地上部分干重、有效根瘤数、粗蛋白含量等生长性状指标的相关性不显著(表5)。
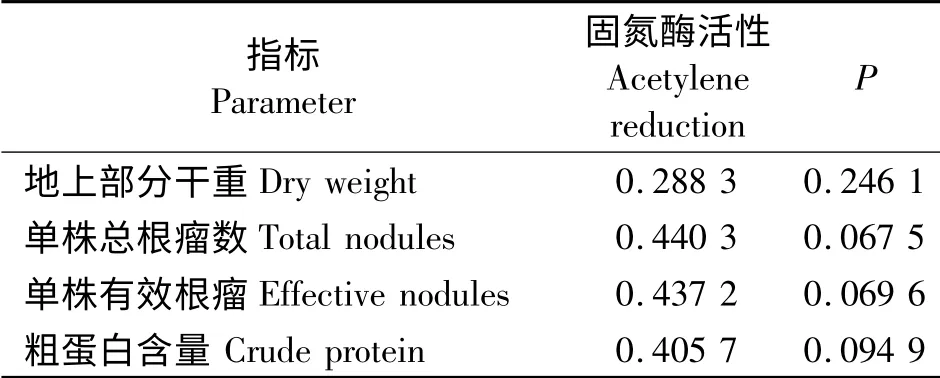
表5 固氮酶活与地上部分干重(DM)、单株总根瘤数(TN)、单株有效根瘤(EN)及粗蛋白含量(CP)的相关性分析Table 5 Correlation among the acetylene reduction and dry weight,total nodules,effective nodules and crude protein
3 讨论与结论
3.1 根瘤菌接种方式对苜蓿生长性状的影响
本研究结果表明,在河北南大港盐碱地区两种常用接种方式都有一定的促生、结瘤及固氮能力,但根瘤菌包衣的效果较好。其原因可能是在盐碱土壤环境下,液体菌剂中的根瘤菌缺乏载体的保护,暴露于盐碱环境,无法大量占领结瘤位点,而根瘤菌包衣由成膜剂、吸附剂和缓蚀剂等配套助剂包裹于种子表面,有逐渐释放过程,对根瘤菌产生一定的保护作用,保证了其成活率,有利于根瘤菌侵染苜蓿植株。
作为根瘤菌应用过程中的关键环节,接种方式极大地影响着根瘤菌接种效果。国内外的学者对不同接种方式的效果进行了研究,但研究结果并不完全一致。一些研究表明,液体菌剂更适合某些地区,或者液体菌剂处理种子和固体菌剂有相当的接种效果。如李涛等[10]在田间进行根瘤菌Bradyrhizobium japonicum 4302 和Sinorhizobium fredii 4822 拌种、喷施和种下接种3 种接种方式研究,结果表明大豆(Glycine max)根瘤菌的菌剂拌种方式更适用于黄淮海地区大豆种植;Tittabutr 等[11]进行大田试验,检测液体菌剂拌种的结瘤和固氮能力,发现液体菌剂和泥炭土为载体的菌剂的表现相似;张红侠等[12]在田间对根瘤菌Bradyrhizobium liaoningense 4345 和Sinorhizobium fredii 4338 进行3 种方式接种,发现黄土高原地区大豆根瘤菌的适宜接种方式是喷施和拌种。而另一些研究获得的结论和本研究一致,即颗粒剂如种衣剂的接种效果比液体菌剂更好[13-18]。
3.2 苜蓿生长对包衣接种根瘤菌的响应
不同菌株的接种效果存在差异,从对“中苜1号”苜蓿生产效果和品质有重要影响的产量、单株地上生物量和粗蛋白含量等方面衡量,菌株ACCC17558 和ACCC17617 表现优于其他菌株,具有良好的接种效果,是适合盐碱土壤和中苜1 号的高效共生菌株。而另一些菌株,如ACCC17537 接种后粗蛋白含量高,但中苜1 号结瘤效果较差;ACCC17676虽单株根瘤数多、根瘤固氮酶活性较强,但对中苜1号的生长效果较差。因此,这两种菌株不符合菌剂生产的标准,不能单独用于菌剂生产。这与刘晓云等[19]、康俊梅等[5]和Gibson 等[20]的研究结果类似。马晓彤[21]的研究表明,中苜1 号接种ACCC17676后植株干重低于对照植株干重,水培试验中匹配较好的组合是ACCC17676 ―阿尔冈金和ACCC17676―保定苜蓿。
有研究表明,接种的根瘤菌在土壤中生存定殖能力的强弱直接影响着接种的效果[22]。本研究中,干草产量随着苜蓿生长不断减少,且全年总产草量增长不明显。可见,相比接种根瘤菌的影响,土壤环境可能更显著影响盐碱地苜蓿的生长与发育。但接种根瘤菌对苜蓿的生长有一定的促进作用。
本研究中,根瘤菌接种后,全年干草增产最高达57.88%,粗蛋白含量增加最高达23.1%,接种效果较明显,这与喻文虎等[23]和陈利云等[24]研究结果类似。从各指标来看,根瘤固氮酶活性与单株地上部分干重、根瘤数及粗蛋白含量相关不显著,只可以作为参考指标。可见,中苜1 号苜蓿接种不同根瘤菌后,固氮酶活性可能在不同的菌系间表现出差异,但该差异最终也会体现在单株干重和粗蛋白含量之中。康俊梅等[5]的研究也得到了类似结果。因此,不能单纯地依据固氮酶活性的高低确定根瘤菌的固氮能力,必须综合考虑根瘤数、结瘤效率、地上部分干重和环境因素等指标。
[1] 马文,孔德平.田菁生物学特性及栽培技术[J].现代农村科技,2009(15):12.
[2] 陈文新,汪恩涛,陈文峰.根瘤菌―豆科植物共生多样性与地理环境的关系[J].中国农业科学,2004,37(1):81-86.
[3] Nangul A,Moot D J,Brown D,Ridgway H J.Nodule occupancy by Rhizobium leguminosarum strain WSM1325 following inoculation of four annual Trifolium species in Canterbury,New Zealand[J]. New Zealand Journal of Agricultural Research,2013,56(3):215-223.
[4] 赵士豪,王来福,陈文新.根瘤菌对紫花苜蓿接种效果的研究[J].安徽农业科学,2006,34(23):6258-6259.
[5] 康俊梅,张丽娟,郭文山,杨青川,魏窦兴.中苜1 号紫花苜蓿高效共生根瘤菌的筛选[J].草地学报,2008,16(5):497-500.
[6] 刘杰,王赟文,李颖,汤辉,汪玲玲.利用土壤筛选紫花苜蓿高效共生根瘤菌的初步研究[J].草业科学,2005,22(2):21-25.
[7] Bogino P,Banchio E,Bonfiglio C,Giordano W.Competitiveness of a Bradyrhizobium sp.strain in soils containing indigenous rhizobia[J].Current Microbiology,2008,56:66-72.
[8] 周冀琼,邓波,马晓彤,张英俊,周可.紫花苜蓿根瘤菌培养基的优化研究[J].草地学报,2013,21(3):607-611.
[9] 陈文新,李阜棣,闫章才.我国土壤微生物学和生物固氮研究的回顾与展望[J].世界科技研究与发展,2002(4):6-12.
[10] 李涛,关大伟,李俊,曹凤明,韦革宏,冯瑞华.黄淮海地区优良大豆根瘤菌株的筛选与接种方式研究[J]. 大豆科学,2010,29(4):645-650.
[11] Tittabutr P,Payakapong W,Teaumroong N,Singleton P W,Boonkerd N.Growth,survival and field performance of bradyrhizobial liquid inoculant formulations with polymeric additives[J].Science Asia,2007,33(1):69-77.
[12] 张红侠,冯瑞华,关大伟,李俊,曹凤明. 黄土高原地区优良大豆根瘤菌的筛选与接种方式研究[J]. 大豆科学,2010,29(6):996-1002.
[13] Rice W A,Clayton G W,Olsen P E,Lupwayi N Z.Rhizobial inoculant formulations and soil pH influence field pea nodulation and nitrogen fixation[J].Canadian Journal of Soil Science,2000,80(3):395-400.
[14] Clayton G W,Rice W A,Lupwayi N Z,Johnston A M,Lafond G P,Grant C A,Walley F.Inoculant formulation and fertilizer nitrogen effects on field pea:Crop yield and seed quality[J].Canadian Journal of Plant Science,2004,84(1):89-96.
[15] 樊晓东,孙在红,钞振华.影响牧草生物量形成的因素[J].草业科学,2004,21(10):33-36.
[16] 李旭军,贾小红,王克武.紫花苜蓿专用根瘤菌剂使用技术研究[J].草业科学,2005,22(5):28-31.
[17] 贾小红,周顺桂,李旭军,黄中乔,刘西莉. 北京地区紫花苜蓿根瘤菌接种剂的研制[J]. 应用基础与工程科学学报,2007,15(1):17-22.
[18] 唐颖,卢林纲,隋文志,梁成双,高爱红.根瘤菌不同接种方式对大豆根瘤分布及产量的影响[J].现代化农业,2002(4):13-14.
[19] 刘晓云,郭振国,李乔仙,刘桂霞,薛世明,王易鹏.南苜蓿高效共生根瘤菌土壤的筛选[J].生态学报,2011,31(14):4034-4041.
[20] Gibson A H,Curnow B C,Bergersen F J,Brockwell J,Robinson A C.Studies of field populations of rhizobium:Effectiveness of strains of Rhizobium trifolii associated with Trifolium subterraneum L. pastures in South-Eastern Australia[J].Soil Biology and Biochemistry,1975,7(2):95-102.
[21] 马晓彤.苜蓿根瘤菌与苜蓿品种共生匹配优良组合筛选的研究[D].北京:中国农业科学院,2009.
[22] 韩华君,张磊,谢德体,魏世清,李艳宾.耐酸苜蓿根瘤菌在酸性黄壤中的定殖研究[J].西南农业大学学报(自然科学版),2006,28(5):722-726.
[23] 喻文虎,杨鹏冀,贾德荣.红豆草、紫花苜蓿根瘤菌接种研究[J].草业科学,1995,12(3):22-25.
[24] 陈利云,张丽静,周志宇.耐盐根瘤菌对紫花苜蓿接种效果的研究[J].草业学报,2008,17(5):43-47.

