基于纤维素模板的聚合物空心微球作为药物载体的性能研究及分析
南静娅, 刘玉鹏, 陈 莹,2, 王春鹏,2*, 储富祥
(1.中国林业科学研究院 林产化学工业研究所; 生物质化学利用国家工程实验室; 国家林业局 林产化学工程重点开放性实验室; 江苏省 生物质能源与材料重点实验室,江苏 南京 210042; 2.中国林业科学研究院林业新技术研究所,北京 100091; 3.中国林业科学研究院,北京 100091)
·研究报告——生物质材料·
基于纤维素模板的聚合物空心微球作为药物载体的性能研究及分析
南静娅1, 刘玉鹏1, 陈 莹1,2, 王春鹏1,2*, 储富祥3
(1.中国林业科学研究院 林产化学工业研究所; 生物质化学利用国家工程实验室; 国家林业局 林产化学工程重点开放性实验室; 江苏省 生物质能源与材料重点实验室,江苏 南京 210042; 2.中国林业科学研究院林业新技术研究所,北京 100091; 3.中国林业科学研究院,北京 100091)
以羟丙基纤维素为模板材料,分别采用不同的聚合方法制备了2种不同形态和结构的聚合物空心微球——聚N-异丙基丙烯酰胺-co-聚丙烯酸(PNIPAm-co-PAA)微凝胶和聚N-异丙基丙烯酰胺-聚丙烯酸(PNIPAm-PAA)水凝胶微囊。以盐酸阿霉素(Dox)作为模型药物,考察了聚合物空心微球作为药物载体的载药能力和体外释放性能。研究表明,PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊和Dox分子能够通过正负电荷的相互吸引实现有效结合;载药微球具有良好的缓释性能,并对Dox的释放表现出明显的pH值敏感性和温度敏感性。体外细胞毒性实验表明,载药PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊具有很高的抗肿瘤活性,细胞相对存活率均可达20%左右。PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊在作为水溶性药物或蛋白类药物载体方面,具有潜在的应用价值,同时有望应用于木材胶黏剂防腐等。
聚合物空心微球;聚N-异丙基丙烯酰胺;聚丙烯酸;药物载体
近几十年来,聚合物微球作为一种新型的药物载体,在药物释放领域受到越来越多的关注和研究[1-3]。研究表明,聚合物空心微球作为药物载体,由于具有相对较低的材料密度、相对较大的比表面积、较方便的结构可调性,以及对客体分子较强的吸附和贮存能力等突出特点,因而在药物释放领域受到人们越来越多的关注和重视,具有巨大的市场发展空间[4-6]。将聚合物空心微球用作药物载体,拥有一般聚合物材料所具有的普遍优势:具有被动靶向性,可从循环系统进入到身体的各个靶向部位,从而达到靶向定位的功能;此外,利用表面修饰可使聚合物进一步具有主动靶向的特性。更重要的是,聚合物空心微球所具有的内部中空结构,使其作为药物载体具有如下显著特点:相对较低的材料密度与材料消耗,可在一定程度上减小载体的生理毒性;相对更大的载药空间;药物被包裹在聚合物空心微球内部,能有效防止外界因素的破坏和干扰,从而保证其药理特性[7-10]。本研究以具有良好生物相容性和可生物降解性的天然高分子羟丙基纤维素作为制备聚合物空心微球的模板材料,分别采用不同的聚合方法制备了2种不同形态和结构的聚合物空心微球——聚N-异丙基丙烯酰胺-co-聚丙烯酸(PNIPAm-co-PAA)微凝胶和聚N-异丙基丙烯酰胺-聚丙烯酸(PNIPAm-PAA)水凝胶微囊,研究和对比了2种中空微球作为药物载体的载药能力和体外释放性能。
1 实 验
1.1 材料
羟丙基纤维素(HPC,Mw=100 000 u)、 N,N′-亚甲基双丙烯酰胺(MBAAm)、 N-异丙基丙烯酰胺(NIPAm)购自Acros Organics Company;丙烯酸(AA)从上海光华试剂公司购买;盐酸阿霉素(Dox)由北京华丰联合技术公司生产提供;其他试剂均为分析纯且使用前未经任何处理;人肠癌细胞株LoVo购自中国科学院上海细胞生物学研究所。
1.2 PNIPAm-co-PAA微凝胶的制备
将0.20 g的HPC溶于50 mL蒸馏水中,在溶液中加入0.05 g的AA、0.20 g的单体NIPAm和0.15 g的交联剂MBAAm,于N2氛围下升温至35 ℃,然后加入0.1 mol/L的抗坏血酸(Vc)溶液和H2O2溶液各0.5 mL,引发NIPAm和AA的共聚交联。N2保护下于35 ℃条件下反应2 h,得到乳白色的PNIPAm-co-PAA/HPC聚合物微球分散液。然后用0.1 mol/L 的NaOH溶液调节体系的pH值至8.0,搅拌1 h,使HPC充分脱离聚合物微球。对上述溶液进行离心处理(12 000 r/min,20 min),除去上层清液。取下层沉淀,用蒸馏水反复洗涤3次后,加入蒸馏水超声分散。最终所得即为中空的PNIPAm-co-PAA微凝胶悬浮液。
1.3 PNIPAm-PAA水凝胶微囊的制备
将0.20 g的HPC溶于35 mL蒸馏水中,在溶液中加入0.20 g的AA,于N2氛围下升温至35 ℃,然后加入0.1 mol/L的Vc溶液和H2O2溶液各0.5 mL,引发AA的聚合反应。N2保护下于35 ℃条件下反应1 h,得到乳白色的HPC-PAA模板微粒分散液。将0.20 g的单体NIPAm、0.15 g的交联剂MBAAm及0.05 g的十二烷基硫酸钠(SDS)共混并溶于15 mL蒸馏水中。滴加上述溶液于HPC-PAA模板微粒溶液中, N2保护下于35 ℃条件下反应2 h,得PNIPAm-PAA-HPC复合物微粒水相分散液。然后用0.1 mol/L的NaOH溶液调节体系的pH值为8.0, 使HPC脱离复合物微粒。对上述溶液进行离心、水洗处理数次,最终所得即为PNIPAm-PAA水凝胶微囊悬浮液。
1.4 空心微球负载Dox
分别取上述PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊各10 mL,加入一定量的Dox,在37 ℃的恒温箱中反应24 h,使二者充分结合。对所得样品进行离心处理(12 000 r/min, 20 min),收集上层清液。取下层沉淀,加入10 mL蒸馏水超声分散,分别得到负载Dox的PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊。
1.5 载药量的测定
将1.4节所得的上清液用紫外-可见分光光度计在495 nm处测其吸光度,并根据工作曲线法及下列公式计算载药量:
E=m/m0×100 %
式中:E—载药量,%;m—样品中所含的药量,mg;m0—样品的总质量,mg。
1.6 载药微球的体外释放
分别将一定量的Dox载药微凝胶和载药水凝胶微囊放入透析袋中(截留相对分子质量为14 000),然后将透析袋完全浸入磷酸盐溶液(pH值7.4),整个释放实验在37 ℃下进行。每隔一定时间取出外液,并加入等体积新的磷酸盐溶液。然后根据工作曲线法测定出缓冲液中的药物浓度,并利用所测数据绘制出药物的体外释放曲线。
1.7 细胞毒性实验
人肠癌细胞株LoVo在含10%胎牛血清的RPMI-1640培养液中培养。实验时细胞接种在96孔培养板中,接种密度5 000个/孔,每孔200 μL,接种24 h后吸出培养液150 μL,加入载药微球,给药48 h后加噻唑蓝(MTT),4 h后吸干孔内溶液,加入二甲基亚砜(DMSO) 150 μL,振荡溶解,于560 nm下测其吸光度值,计算其相对存活率并以同样方法测定空白微球的相对存活率。
2 结果与讨论
2.1 聚合物空心微球对Dox的负载研究

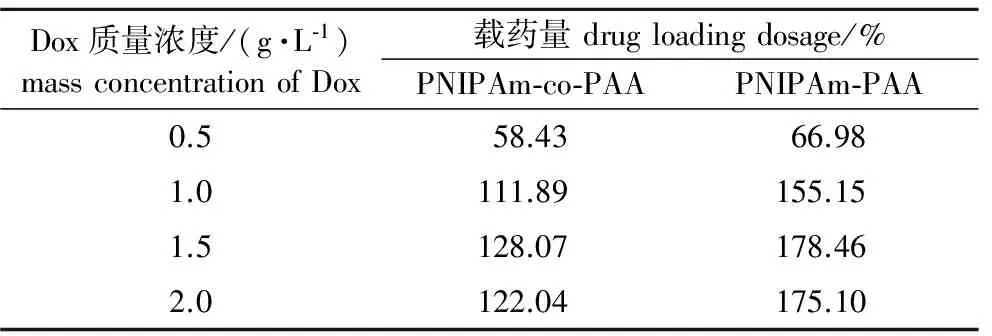
表1 中空微球与不同浓度Dox结合后的载药量
2.2 聚合物空心微球对Dox的体外释放
将负载Dox的PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊分别置于磷酸盐溶液中进行透析,考察了载药微球在不同释放条件下的体外释放行为。图1和图2分别为Dox载药微球在不同pH值的磷酸盐溶液中和不同温度下的体外释放曲线。由图1可知,与空白对照实验相比,载药微球具有明显的缓释效果。进一步观察载药微球的释放曲线,发现微球对Dox的体外释放行为可分为2个阶段:1)突释阶段,在释放初期的10 h内,微球的药物释放速率呈线性递增,这主要是吸附在微球表面的药物受浓度梯度影响快速向外扩散的结果;2)缓释阶段,在10~120 h内,药物从微球内部释放出来,微球的释放速率逐渐变慢,呈现出持续、缓慢的释放趋势。
对比载药微球在不同pH值下的释放曲线(图1)可知,PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊的药物释放速率均随缓冲溶液pH值的降低而增大,主要是由于空心微球与Dox分子间的静电引力对于pH值具有很好的响应性。在pH值7.4时,PAA分子链和Dox分子均完全电离并带相反电荷,二者间存在很强的静电引力作用,致使包覆在其中的Dox很难逃脱出来。当pH值减小时,微球中羧基的电离化程度不断减弱,致使微球与Dox分子之间的静电引力逐渐减小,从而更易释放出药物分子。由此可知,载药微球的pH值可控释放性能使其作为一种新型的抗癌药物载体,具有潜在的应用价值。在正常生理条件下(pH值7.4),大部分的Dox药物分子停留在微球内部;当载药微球进入肿瘤细胞时,肿瘤组织中较低的pH值(pH值5.7~7.8)[16]将加速药物分子的释放。尤其是在进入肿瘤细胞的内涵体或溶酶体时,其具有的弱酸环境(pH值4.0~5.0)[17-18]将促使载药微球的释放速率进一步增大。
观察PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊在不同温度下的药物释放曲线(图2)可知,当温度由25 ℃升至37 ℃时,载药PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊的释放速率均随温度的升高而增大。这种变化要归因于具有低临界溶解温度(LCST,34 ℃)的温敏聚合物PNIPAm。在LCST以下时,线型PNIPAm分子链呈亲水态,以自由线团的构象存在;当温度升高至LCST以上时,PNIPAm链发生相转变,由亲水态变为疏水态,使聚合物发生收缩而形成微球,从而有利于微球内药物分子的释放,致使释放速度加快。
上述分析表明,载药PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊具有良好的缓释性能,并对Dox药物分子的释放表现出明显的pH值敏感性和温度敏感性,因而将其作为一种新型的药物载体,具有广阔的市场应用前景。
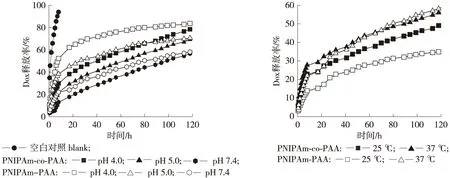
图1 Dox载药微球在不同pH值条件下的药物释放曲线
2.3 聚合物空心微球负载Dox前后的细胞毒性研究
为了研究PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊的潜在毒性和载药微球的药理活性,分别测试了空白未载药微球和Dox载药微球对LoVo细胞的细胞毒性。表2为不同浓度的空白微球及载药后的微球对LoVo细胞的相对存活率的影响。由表2可知,在不同浓度空白微球下细胞的相对存活率都维持在85%以上。即使当微球质量浓度高达64 mg/L时,LoVo细胞仍具有很高的细胞存活率。由此可知,空白PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊对LoVo细胞无毒性作用。对比负载同一Dox浓度的PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊的体外细胞毒性情况,可以看出,2种载药微球均显示了较强的细胞毒性。由此可知,PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊在吸附药物分子的过程中均未对药物的药理活性造成影响。以上分析表明,PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊作为药物载体,具有优良的生物安全性和较高的药理活性。
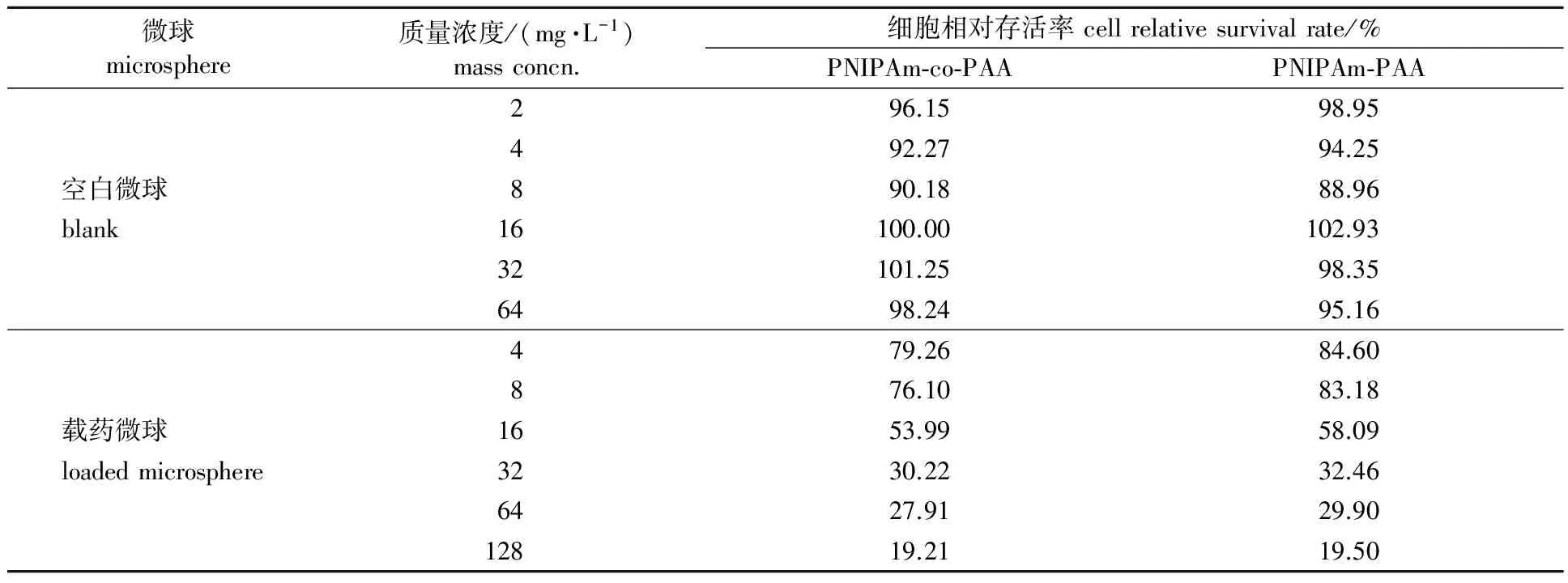
表2 聚合物空心微球栽药前后的体外细胞毒性研究结果
3 结 论
3.1 以羟丙基纤维素为模板材料,分别采用不同的聚合方法制备了2种不同形态和结构的聚合物空心微球——PNIPAm-co-PAA微凝胶和PNIPAm-PAA水凝胶微囊。以Dox作为模型药物,考察了空心微球作为药物载体的载药能力和体外释放性能。研究表明,PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊和Dox分子能够通过正负电荷的相互吸引实现有效结合;载药微球具有良好的缓释性能,并对Dox的释放表现出明显的pH值敏感性和温度敏感性。
3.2 体外细胞毒性实验表明,载药PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊具有很高的抗肿瘤活性,细胞相对存活率均可达20%左右。
3.3 PNIPAm-co-PAA微凝胶、PNIPAm-PAA水凝胶微囊在作为水溶性药物或蛋白类药物载体方面,具有潜在的应用价值,同时有望应用于木材胶黏剂防腐等。
[1]KATAOKA K,HARADA A,NAGASAKI Y.Block copolymer micelles for drug delivery:Design,characterization and biological significance[J].Advanced Drug Delivery Reviews,2001,47(1):113-131.
[2]KOLISHETTI N,DHAR S,VALENCIA P M,et al.Engineering of self-assembled nanoparticle platform for precisely controlled combination drug therapy[J].Proceedings of the National Academy of Sciences,2010,107(42):17939-17944.
[3]FAROKHZAD O C,LANGER R.Impact of nanotechnology on drug delivery[J].ACS Nano,2009,3(1):16-20.
[4]HOARE T R,KOHANE D S.Hydrogels in drug delivery:Progress and challenges[J].Polymer,2008,49(8):1993-2007.
[5]KOST J,LANGER R.Responsive polymeric delivery systems[J].Advanced Drug Delivery Reviews,2012,64:327-341.
[6]DELLA ROCCA J,LIU D,LIN W.Nanoscale metal-organic frameworks for biomedical imaging and drug delivery[J].Accounts of Chemical Research,2011,44(10):957-968.
[7]STOYCHEY G,PURETSKIY N,IONOV L.Self-folding all-polymer thermoresponsive microcapsules[J].Soft Matter,2011,7(7):3277-3279.
[8]SIVAKUMAR S,BANSAL V,CORTEZ C,et al.Degradable,surfactant-free,monodisperse polymer-encapsulated emulsions as anticancer drug carriers[J].Advanced Materials,2009,21(18):1820-1824.
[9]STADLER B,PRICE A D,CHANDRAWATI R,et al.Polymer hydrogel capsules:En route toward synthetic cellular systems[J].Nanoscale,2009,1(1):68-73.
[10]SUCH G K,JOHNSTON A P R,CATUSO F.Engineered hydrogen-bonded polymer multilayers:from assembly to biomedical applications[J].Chemical Society Reviews,2011,40(1):19-29.
[11]SOPPIMATH K S,AMINABHAVI T M,KULKAMI A R,et al.Biodegradable polymeric nanoparticles as drug delivery devices[J].Journal of Controlled Release,2001,70(1):1-20.
[12]YAN Er-yun,DING Yin,CHEN Chan-qing,et al.Polymer/silica hybrid hollow nanospheres with pH-sensitive drug release in physiological and intracellular environments[J].Chemical Communications,2009,19:2718-2720.
[13]HU Yong,DING Yin,DING Dan,et al.Hollow chitosan/poly (acrylic acid) nanospheres as drug carriers[J].Biomacromolecules,2007,8(4):1069-1076.
[14]ZHU Wen,LI Yan-li,LIU Li-xin,et al.Biamphiphilic triblock copolymer micelles as a multifunctional platform for anticancer drug delivery[J].Journal of Biomedical Materials Research Part A,2011,96(2):330-340.
[15]GUAN Ying,ZHANG Yong-jun.PNIPAM microgels for biomedical applications:from dispersed particles to 3D assemblies[J].Soft Matter,2011,7(14):6375-6384.
[16]MARTIN G R,JAIN R K.Noninvasive measurement of interstitial pH profiles in normal and neoplastic tissue using fluorescence ratio imaging microscopy[J].Cancer Research,1994,54(21):5670-5674.
[17]SCHMID S,FUCHS R,KIELIAN M,et al.Acidification of endosome subpopulations in wild-type Chinese hamster ovary cells and temperature-sensitive acidification-defective mutants[J].The Journal of Cell Biology,1989,108(4):1291-1300.
[18]STEINMAN R M,MELLMAN I S,MULLER W A,et al.Endocytosis and the recycling of plasma membrane[J].The Journal of Cell Biology,1983,96(1):1-27.
计量标准器具 竭诚欢迎使用检定
松香色度标准块
本产品具有国内行业中质量检验的权威性
长期、周到的售后服务让客户无后顾之忧
松香色度标准装置(又名《松香颜色分级标准》玻璃比色块),是符合我国松香光学特性具有完整体系的松香颜色分级标准。1982年荣获林业部科技成果二等奖。1987年至今,被《脂松香》、《松香试验方法》国家标准所采用,并多次经国家质量监督检验检疫总局复查考核合格。
Properties of Cellulose-based Polymeric Hollow Microspheres as Drug Carriers
NAN Jing-ya1, LIU Yu-peng1, CHEN Ying1,2, WANG Chun-peng1,2, CHU Fu-xiang3
(1.Institute of Chemical Industry of Forest Products,CAF; National Engineering Lab.for Biomass Chemical Utilization; Key and Open Lab.of Forest Chemical Engineering,SFA; Key Lab.of Biomass Energy and Material,Jiangsu Province, Nanjing 210042, China; 2.Research Institute of Forestry New Technology,CAF, Beijing 100091, China; 3.Chinese Academy of Forestry, Beijing 100091, China)
Hydroxypropylcellulose (HPC),a natural polymer,was chosen as a biocompatible and biodegradable template to prepare two kinds of polymeric hollow microspheres,i.e.,poly(N-isopropylacrylamide)-co-poly(acrylic acid) (PNIPAm-co-PAA) microgels and poly(N-isopropylacrylamide)-poly(acrylic acid) (PNIPAm-PAA) hydrogel capsules by using different polymerization methods.The drug loading capacity and releasing behaviors of PNIPAm-co-PAA microgels and PNIPAm-PAA hydrogel capsules as drug carriers were investigated by using anticancer drug,Doxorubicin hydrochloride (Dox),as hydrophilic model drug.The results indicated that Dox could be encapsulated in PNIPAm-co-PAA microgels and PNIPAm-PAA hydrogel capsules with high drug loading driven by the electrostatic interaction.The characteristic sustained-releases of Dox from these two kinds of microspheres were observed under physiological pH and temperature.More encouragingly,the release of Dox exhibited a dual-responsivity to temperature and pH.In vitro cytotoxicity assay indicated that Dox-loaded PNIPAm-co-PAA microgels and PNIPAm-PAA hydrogel capsules had high antitumor activity,and implied that they might be a potential drug delivery carrier especially for water-soluble or polypeptide drugs,as well as applying in the wood adhesive preservation,etc.
polymeric hollow microspheres;poly (N-isopropylacrylamide);poly (acrylic acid);drug carrier

联系地址:210042 南京市锁金五村16号中国林科院林产化学工业研究所电 话:(025)85482449,85482533联系人:谭卫红传 真:(025)85482450
10.3969/j.issn.1673-5854.2015.03.001
2014- 11- 13
中国林科院林业新技术所基本科研业务费专项资金(CAFINT2010K04);江苏省自然科学基金项目(BK20131071)
南静娅(1988—),女,山西运城人,硕士,主要从事高分子复合微球方面的研究工作
*通讯作者:王春鹏,研究员,主要从事生物质高分子材料、高分子乳液、环保型人造板胶黏剂等研究;E-mail:wangcpg@163.com。
TQ35
A
1673-5854(2015)03- 0001- 06

