四氯化碳构建慢性肝损伤兔胆石症模型
唐乾利,王兵,吕震,3,李辉,3,金萌,3,王宇,王澍,俞渊,黄欣
(1. 右江民族医学院/桂西高发病防治重点实验室,广西 百色 533000 E-mail:htmgx@163.com;2. 广西中医药大学第一附属医院,广西 南宁 530023;3. 广西中医药大学,广西 南宁 530001)
四氯化碳构建慢性肝损伤兔胆石症模型
唐乾利1,王兵2,吕震1,3,李辉1,3,金萌1,3,王宇1,王澍1,俞渊2,黄欣2
(1. 右江民族医学院/桂西高发病防治重点实验室,广西 百色 533000 E-mail:htmgx@163.com;2. 广西中医药大学第一附属医院,广西 南宁 530023;3. 广西中医药大学,广西 南宁 530001)
目的 研究四氯化碳构建慢性肝损伤兔胆石症模型的可行性。方法 将50只新西兰大白兔分为正常组10只、肝纤维化胆石症组20只、肝硬化胆石症组20只,其中肝纤维化胆石症组予20%的CCl4-橄榄油溶液0.2 ml/kg腹腔注射,肝硬化胆石症组予25%的CCl4-橄榄油溶液0.3 ml/kg腹腔注射,每隔3天一次,连续用药12周,同时投以高胆固醇、高热量致石饲料,正常组正常饮食。根据造模结果评判CCl4构建模型的可行性、安全性、重复性以及观察动物死亡率。结果 正常组未出现动物死亡,肝纤维化胆石症组、肝硬化胆石症组死亡率分别是20%、25%,两组动物模型成石率均为70%,两组的死亡率、成石率相比,差异无统计学意义(P>0.05)。病理检测、Masson染色提示肝纤维组织明显增多或假小叶形成,伴随着假小叶内中央静脉缺如,部分肝脏组织坏死。结论 四氯化碳联合高热量、高胆固醇致石饲料进行慢性肝损伤兔胆石症模型的构建,具有安全可行、成功率高、死亡率低、操作方便等优势,为胆石症相关研究提供了良好的动物模型。
CCl4;药物性肝损伤,慢性;兔胆石症;致石饲料
利用动物模型进行肝损伤研究,已被证明是一种有效的研究方法,但大都是大鼠肝损伤模型,而对兔肝损伤模型的研究相对较少。因大鼠的解剖特点缺少胆囊,无法进行胆囊结石的研究,而兔可以在肝损伤的基础上进一步进行胆结石的研究且适合建立肝组织病变、胆汁动态研究动物模型。四氯化碳(CCl4)又称四氯甲烷,大量研究资料显示,四氯化碳是能够引起人类严重急性肝损害的剧毒类化学药物。许多动物研究证明,四氯化碳除可以导致急性肝损伤外,多次反复的刺激可致使慢性肝损伤的发生,而慢性肝损伤主要表现为肝细胞的再生和纤维化。随着染毒时间和次数的增加,肝脏坏死程度逐渐加重可致肝硬化的发生。我们参考金博[1]设计的模型制备方法,用四氯化碳对新西兰大白兔进行腹腔注射,同时投以高胆固醇、高热量致石饲料,建立慢性肝损伤兔胆石症模型。
1 实验材料
1.1 实验动物 选取雄性4月龄新西兰大白兔50只,体重约2.5 kg左右(实验动物由右江民族医学院动物中心提供,实验动物使用许可证:SYXK桂2011-0010)。每笼饲养新西兰大白兔2只,饲养室内温度保持在20~24℃,湿度维持在42%~60%,适应性喂养7天后进行实验。
1.2 实验药物与试剂 ①四氯化碳(由天津市进丰化工有限公司生产);②橄榄油(由成都市科龙化工试剂厂生产,批号:20130513);③水合氯醛(成都市科龙化工试剂厂,批号:2014031102);④胆固醇(由上海通用药业股份有限公司生产,批准文号:国药准字H31021290);⑤胆酸(购自德国sigma公司,code:101335972);⑥Masson 三色染色试剂盒(福州迈新生物技术开发有限公司,批号:1310168003)。
1.3 主要实验仪器设备 病理图文分析系统(HPIAS-1000P)、电热恒温培养箱(DNP-9162)、轮转式组织切片机(HM315)等。
1.4 实验分组及造模方法 将50只新西兰大白兔分为正常组10只,肝纤维化胆石症组和肝硬化胆石症组各20只,各组间性别比较经Ridit分析、体重比较经方差分析,差异无统计学意义(P>0.05),组间可比性良好。其中肝纤维化胆石症组大白兔予20%的CCl4-橄榄油溶液0.2ml/kg腹腔注射,肝硬化胆石症组大白兔予25%的CCl4-橄榄油溶液0.3ml/kg腹腔注射,每隔3天一次,连续用药12周,同时对肝纤维化胆石症组、肝硬化胆石症组投以高胆固醇、高热量致石饲料(普通饲料加入1.2%胆固醇、0.1%胆酸、5%蔗糖及3.5%鱼肝油,适量鸡蛋),正常组正常饮食。造模过程中死亡的新西兰大白兔立即取肝脏组织待行病理学检测。
1.5 肝组织标本采集 造模12周后,根据病理诊断结果,将各组新西兰大白兔用10%水合氯醛麻醉后,取相同部位肝组织,切取大小为10mm×5mm×5mm的肝脏组织,将切取的肝组织投入10%的福尔马林固定液,固定至少24~48h后送检,行病理检测和Masson染色检查。
1.6 各组死亡率、成石率比较 注射CCl4-橄榄油溶液12周后,统计各组新西兰大白兔的死亡率、成石率。计算公式为:死亡率=(原始例数-剩余例数)/原始例数×100%,成石率=成石例数/原始例数×100%。
1.7 模型构建成功标准[2]
1.7.1 肝纤维化胆石症组模型成功标准 肝小叶汇管区及其周围纤维化较为明显,纤维间隔逐渐形成,但小叶结构仍保留;或肝小叶纤维间隔明显伴结构紊乱,未出现肝硬化;解剖发现胆囊内有泥沙样结石,程度不同。
1.7.2 肝硬化胆石症组模型成功标准 假小叶形成并增多,早期肝硬化;或见假小叶形成,小叶内中央静脉缺如,细胞排列紊乱,多数细胞水肿,局部气球样变,小胆管增生、伴有胆汁淤积;解剖后发现胆囊内有不规则或球状结石,数量较多,量不等。
1.8 伦理学处理 根据课题研究的目的、内容和要求,总课题组已经通过动物伦理学委员会的审批。
1.9 统计学方法 采用SPSS18.0统计软件进行数据分析,计数资料比较采用Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 慢性肝损伤胆石症模型的建立 连续腹腔注射CCl4-橄榄油溶液12周后,肝纤维化胆石症组新西兰大白兔精神稍差,运动减少,毛发粗糙,食欲减退,身体逐渐消瘦。对造模过程中死亡动物及最终处死解剖后肉眼观肝脏表面色泽稍暗,质地稍硬,出现不同程度肝损伤,胆囊内有少量泥沙样结石或不规则颗粒状结石形成,结石体积较小(一般<0.2cm)。肝硬化胆石症组新西兰大白兔精神差,呈嗜睡状态,毛发粗糙更甚,食欲明显减退,身体消瘦更为明显。解剖后观察,肝损伤严重,肝脏表面色泽较暗,质地稍硬,胆囊内见有不规则颗粒状结石形成,部分呈球状,体积较大(一般>0.2cm)。正常组新西兰大白兔精神状态、一般情况及解剖肝脏均未见明显变化。具体见以下图1~图6。

图1 正常组大白兔肝脏
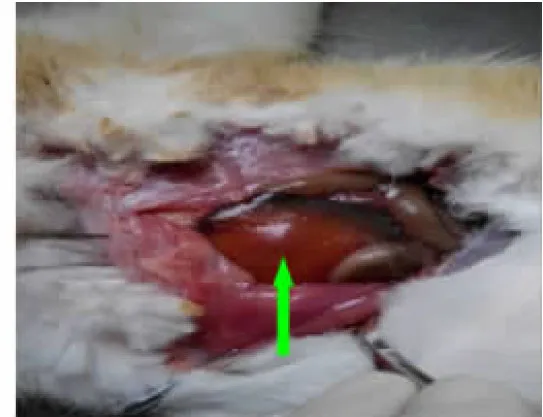
图2 肝纤维胆石症组大白兔肝脏

图3 肝硬化胆石症组大白兔肝脏
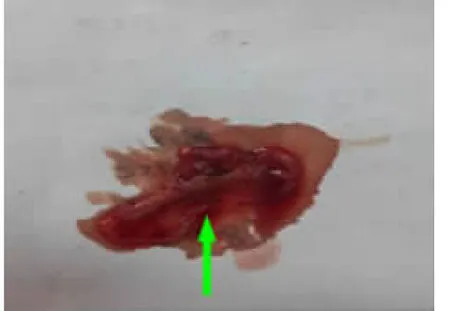
图4 正常组大白兔胆囊
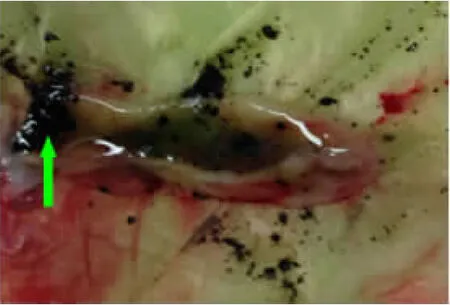
图5 肝纤维化胆石症组泥沙样结石

图6 肝硬化胆石病组胆囊结石
2.2 各组死亡率、成石率的比较 正常组未见死亡、未见结石形成,死亡率和成石形成率均为0%;肝纤维化胆石症组死亡4只、成石14只,死亡率、成石率分别是20%、70%;肝硬化胆石症组死亡5只、成石14只,死亡率、成石率分别是25%、70%;三组死亡率比较差异有统计学意义(χ2=20.656,P<0.001),三组成石率比较差异有统计学意义(χ2=17.717,P<0.001),肝硬化胆石症组死亡率、成石率与肝纤维化胆石症组相比,差异无统计学意义(P>0.05),见表1。
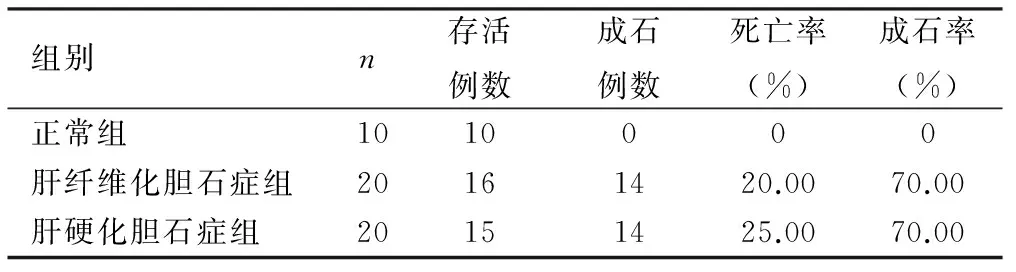
表1 各组死亡率、成石率统计表
2.3Masson染色及病理检测结果 病理采用HE染色后光镜下可见肝纤维化胆石症组、肝硬化胆石症组大白兔肝小叶结构遭到破坏,细胞排列紊乱,肝血窦间隙增大,部分肝细胞肿大并出现气球样变,炎性细胞浸润及纤维组织增多,局部见假小叶形成,表明肝损伤模型造模成功。部分模型组的新西兰大白兔肝脏区域呈现点状、片状坏死,少许形成桥接坏死(见图7、图8)。正常组未见明显病理变化,其余两组新西兰大白兔都存在不同程度肝损伤。Masson染色发现肝纤维化胆石症组、肝硬化胆石症组大白兔不同程度地出现肝脏纤维组织明显增多并呈现蓝色样改变,肝小叶汇管区表现尤为明显,肝硬化胆石症组大白兔个别可见到假小叶形成,对模型的构建成功具有重要的提示意义(见图9、图10)。
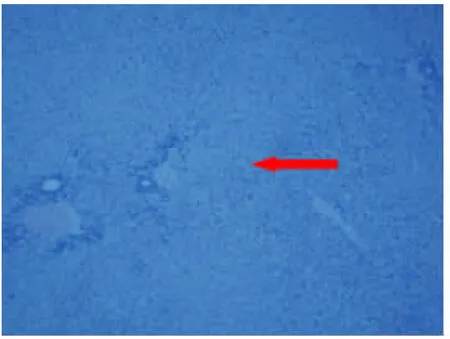
图7 肝纤维化胆石症组纤维组织增生(100×)

图8 肝硬化胆石症组假小叶形成(100×)
HE染色
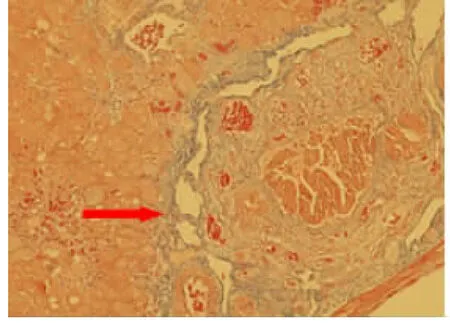
图9 肝纤维化胆石症组纤维增多(100×)

图10 肝硬化胆石症组假小叶形成(100×)
Masson染色
3 讨论
通过本次实验研究,我们发现注射CCl4-橄榄油溶液后,新西兰大白兔的精神逐渐变差,运动明显减少,毛发粗糙泛黄,食欲减退,身体逐渐消瘦,随用药剂量的逐步增加该现象越明显;对造模过程中死亡及最终处死的新西兰大白兔进行解剖,探明肝纤维化胆石症组、肝硬化胆石症组大白兔均出现不同程度的肝损伤,肝脏表面色泽较暗,质地逐渐变硬,肝硬化胆石症组肝脏损害表现尤为明显;Masson染色和病理检测发现镜下可见肝纤维化胆石症组、肝硬化胆石症组新西兰大白兔肝脏纤维组织明显增多,肝细胞排列紊乱,部分出现脂肪变性、气球样变,甚或坏死,这些情况在肝小叶汇管区表现较为突出,肝硬化胆石症组可见到假小叶形成,证明慢性肝损伤兔胆石症模型的构建成功。
四氯化碳(CCl4) 是最常用的化学性肝损伤模型诱导剂,诱发的肝损伤实验动物模型是一种经典的化学性肝损伤模型,其所致的肝损伤一般分急、慢性两种。四氯化碳引起的肝损伤的主要表现是血清中转氨酶活性增加,肝细胞脂质出现过氧化或者坏死[3-4]。四氯化碳进入机体后,被肝微粒体细胞色素P450激活,生成三氯甲基自由基(CCl3+),促使细胞膜和细胞器膜脂质过氧化,致使细胞因子和氧自由基释放,引起内质网、线粒体及高尔基体甚至细胞膜的变性和坏死,进而导致蛋白质合成与能量代谢的障碍[5];同时,激活枯否细胞和中性粒细胞,进而影响肝细胞的DNA合成与分裂,引起肝损伤[6-7]。一系列的动物研究证明,四氯化碳除致急性肝损伤外,反复多次的刺激可导致慢性肝损伤的发生,而慢性肝损伤的主要表现为肝细胞再生和纤维化[8]。随着染毒时间和次数的增加,肝脏坏死程度逐渐加重可致肝硬化的发生。
许多研究表明:肝损伤与胆结石形成紧密相关,肝脏不仅仅是唯一产生正常胆汁的器官,同时也是产生致石性胆汁的场所[9-10]。肝细胞功能是否正常,对胆结石的形成具有相当重要的影响。胆结石的形成机制主要与胆汁中主要成分的改变密切相关,如非结合性胆红素增多,血清中胆汁酸合成减少等,肝细胞所分泌的各种胆汁酸成分的比例在正常生理状态下始终维持在一个相对恒定的范围内[11-12]。肝细胞受损,引起胆汁代谢成分的改变、分泌致石性胆汁主要是由于各种致石性因素在肝脏的综合作用所导致[13]。在坏死性组织、糖蛋白及自由基等促成核因子的作用下或在胆道梗阻、胆汁淤积的环境中能加快致石性胆汁结晶析出,然后经过较为复杂的理化反应最终形成结石[14]。由于肝脏与胆囊的解剖关系密切,功能相互协调,在病理状态下两者亦互相影响或互为因果,而胆结石的逐渐形成同样会对肝脏、肝细胞产生损害,彼此之间相互作用的结果所形成的恶性循环可能是致使胆结石难以根治的原因之一[9]。
四氯化碳对肝脏有明显的损害作用,促使肝细胞分泌胆汁成分改变,产生致石性胆汁,进而经过复杂变化最终形成结石。高热量、高胆固醇致石饲料促进胆固醇结石的形成,胆囊结石的病变可引起感染及梗阻,使肝内胆管压力升高瘀胆,肝细胞损害不同程度加重,病情复杂化。二者相互影响、互相作用,对兔慢性肝损伤胆石症模型的构建具有安全可行、成功率高、死亡率低、简单易行、操作方便等优势,为慢性肝损伤胆石症动物模型的构建奠定理论基础,以期对相关临床与基础研究提供一定的借鉴和指导作用。
[1]JinB,AlterHJ,ZhangZC,etal.Reversibilityofexperimentalrabbitlivercirrhosisbyportalcollagenaseadministration[J].LabInvest,2005,85(8): 992-1002.
[2] 张笑,宁冰冰,任爽,等.消癖丸干预二甲基亚硝胺诱导大鼠肝维化的效应及其机制[J]. 中西医结合学报,2012 ,10(11):1286-1292.
[3]NieY,RenD,LuX,etal.DifferentialprotectiveeffectsofpolyphenolextractsfromapplepeelsandfleshesagainstacuteCCl4-inducedliverdamageinmice[J].FoodFunct,2015,6(2): 513-524.
[4]ParkM,KimYH,WooSY,etal.Tonsil-derivedMesenchymalStemCellsAmeliorateCCl4-inducedLiverFibrosisinMiceviaAutophagyActivation[J].SciRep,2015,5: 8616.
[5]ZhangC,HanC,ZhaoB,etal.Theprotectiveeffectsofaqueousextractsofwild-growingandfermentedRoyalSunmushroom,AgaricusbrasiliensisS.Wasseretal. (higherbasidiomycetes),inCCl4-inducedoxidativedamageinrats[J].IntJMedMushrooms,2012, 14(6):557-561.
[6]MatsumuraH,KondoT,OgawaK,etal.Kupffercellsdecreasemetastasisofcoloncancercellstotheliverintheearlystage[J].IntJOncol,2014, 45(6): 2303-2310.
[7]WenfengZ,YakunW,DiM,etal.Kupffercells:increasinglysignificantroleinnonalcoholicfattyliverdisease[J].AnnHepatol,2014,13(5): 489-495.
[8]ZigmondE,Samia-GrinbergS,Pasmanik-ChorM,etal.Infiltratingmonocyte-derivedmacrophagesandresidentkupffercellsdisplaydifferentontogenyandfunctionsinacuteliverinjury[J].JImmunol, 2014, 193(1): 344-353.
[9]ShertsingerAG,Manuk'ianGV,Manuk'ianVG,etal.Pathogenesisofesophagealandgastricvaricoseveinsformationinpatientswithlivercirrhosis[J].EkspKlinGastroenterol,2011(6): 73-78.
[10] 张中文.胆石症的流行病学和危险因素[J].外科理论与实践,2011, 16(4): 408-412.
[11]ZhangY,WangF,ZongG,etal.Riskfactoranalysisofpostoperativecomplicationsingastriccarcinomapatientscomplicatedwithlivercirrhosis[J].ZhonghuaWeiChangWaiKeZaZhi,2015,18(1): 30-32.
[12]BielefeldtK.Blackbileofmelancholyorgallstonesofbiliarycolics:historicalperspectivesoncholelithiasis[J].DigDisSci,2014, 59(11): 2623-2634.
[13] 俞渊,唐乾利,赫军,等.慢性肝损伤家兔胆石症模型制作及成石因素研究[J].中国医药导报,2007,4(34):106-108,161.
[14] 黄名威,唐乾利,赫军,等.慢性肝损伤与胆结石形成的相关性研究[J].广西医科大学学报,2008, 25(6): 876-878.
Carbon tetrachloride in developing cholelithiasis rabbit model of chronic liver injury
Tang Qianli1, Wang Bing2,Lü Zhen1,3,Li Hui1,3,Jin Meng1,3,Wang Yu1,Wang Shu1,Yu Yuan2,Huang Xin2
(1.YoujiangMedicalUniversityforNationalities/WesternGuangxiKeyLaboraroryforHighIncidentDiseaseControlandPrevention,Baise533000,Guangxi,ChinaE-mail:htmgx@163.com;2.TheFirstAffiliatedHospitalofGuangxiUniversityofChineseMedicine,Nanning530023,Guangxi,China;3.GuangxiUniversityofChineseMedicine,Nanning530001,Guangxi,China)
Objective To study the feasibility of carbon tetrachloride (CCl4) for developing rabbit cholelithiasis model of chronic liver injury. Methods Fifty New Zealand white rabbits were randomly divided into 3 groups: a blank control group (10 rabbits), a liver fibrosis cholelithiasis group (20 rabbits) and a cirrhosis cholelithiasis group (20 rabbits). Among these groups, the rabbits of the liver fibrosis cholelithiasis group received 20% CCl4-olive oil solution (0.2 ml/kg) by intraperitoneal injection, and the liver cirrhosis cholelithiasis group received 25% CCl4-olive oil solution (0.3 ml/kg) by intraperitoneal injection, once every 3 days for 12 weeks; at the same time the rabbits of the liver fibrosis cholelithiasis group and the liver cirrhosis cholelithiasis group were fed high cholesterol and high calorie lithogenic diet. The rabbits in the blank control group were given normal diet. Then according to the model building results, an evaluation of the feasibility, the safety, the repeatability of CCl4for building the rabbits models, and observed the animal death rate. Results No rabbits died in the blank control group, the animal death rates of the liver fibrosis cholelithiasis group and the cirrhosis cholelithiasis group were 20% and 25%, respectively, and both the stone formation rate of the two groups was 70%. HE staining and Masson staining results mainly presented that liver fibrous tissues increased significantly or false flocculus was formed, and the false flocculus central vein was absent, part of the liver tissues was necrosis. Conclusion The use of CCl4combined with high cholesterol and high calorie lithogenic diet can build a cholelithiasis model in rabbits with chronic liver injury, which has the advantages of safety, feasibility, high successful rate, low death rate and easy performance, and will provide fair animal models for cholelithiasis study.
carbon tetrachloride; drug-induced liver injury, chronic; rabbit cholelithiasis; lithogenic diet
2014年国家自然科学基金面上项目(项目批准号:81470198)及2014年广西科学研究与技术开发计划项目(项目批准号:桂科能14123006-3)
R
A
1001-5817(2015)06-0765-04
10.3969/j.issn.1001-5817.2015.06.001
2015-12-01

