姜黄素-胡椒碱复方自微乳结肠稳定性研究
李秋萍 蒋俏丽 翟文文 戴俊东
姜黄素(Curcumin)是中药姜黄Curcuma longa L.中的主要活性成分,具有抗炎[1-2]、抗氧化[3-4]、抗抑郁[5-6]、改善记忆力[7-8]、抑制肿瘤生长[9-10]、保肝等药理作用[11-12]。大量临床前[13-14]和临床研究[15-16]表明姜黄素安全性较高,耐受水平可达12 g/天。姜黄素价格低廉、来源广泛、疗效可靠,可作为治疗多种疾病的潜在开发药物,但是姜黄素水溶性和稳定性差、易被肠道和肝脏酶系统代谢,导致其口服血药浓度低、体内生物利用度差,大大限制了其临床应用[17]。胡椒碱(Piperine)作为胡椒科植物荜茇Piper longum L.中的主要活性成分,可以从吸收、代谢等多种途径提高药物的生物利用度,与一些药理作用好、吸收困难、容易代谢的药物联合应用具有重要的临床意义[18-19]。借助微粒粒径小、黏膜亲和性好的自微乳给药系统(self-microemulsifying drug delivery system,SMEDDS)联合包载姜黄素和胡椒碱有望在显著改善姜黄素溶解性的同时提高其体内稳定性,增加局部药物浓度,有效增强对结肠炎、结肠癌等结肠局部疾病的治疗效果。
国内外学者对姜黄素的稳定性进行了广泛研究,主要涉及到光照、温度、pH值、表面活性剂等对姜黄素稳定性的影响,但对其在体外生物样品中的稳定性考察甚少,本研究通过HPLC测定姜黄素的含量,体外考察并比较姜黄素溶液、姜黄素—胡椒碱混合溶液及姜黄素—胡椒碱复方自微乳溶液在人工结肠液及小鼠结肠组织匀浆液中的稳定性,探讨自微乳给药系统及胡椒碱对姜黄素在结肠部位稳定性的改善作用,为研制新型姜黄素-胡椒碱复方自微乳结肠靶向制剂的可行性提供实验依据。
1 材料与方法
1.1 实验动物
SPF级KM小鼠,雄性45只,体质量35~38 g,由北京斯贝福实验动物科技有限公司提供,许可证号SCXK京2011-0004。
1.2 主要仪器和试剂
高效液相色谱仪(SPD-20A,日本岛津);色谱柱(Purospher STAR LP C18,4.6 mm × 250 mm,5μm,德国默克);十万分之一电子分析天平[BT125D,赛多利斯科学仪器(北京)有限公司];超级恒温水浴器(501 A型,上海实验仪器有限公司);点加热磁力搅拌器(RT10 Power IKA®-WERKE,上海大迈仪器有限公司);高速组织匀浆机(IKA®T10,德国IKA集团);台式高速冷冻离心机(TGL-20M,上海卢湘仪离心机仪器有限公司)。
姜黄素对照品(中国食品药品检定研究院,批号:110823-201004);胡椒碱对照品(中国食品药品检定研究院,批号:110775-201104);姜黄素(天津市福晨化学试剂厂,批号:20140324);胡椒碱(西安宜昌生物制品有限公司,批号:61003780);Capryol 90(法国嘉法赛公司,批号:144603);Transcutol HP(法国嘉法赛公司,批号:143339);Cremophor RH40(德国BASF公司,批号:87712168E0);乙腈、甲醇(色谱纯,Fisher公司);水为纯化水,其他试剂均为分析纯。姜黄素-胡椒碱复方自微乳(自制)。
1.3 色谱条件
色谱柱:Purospher STAR LP C18色谱柱(4.6 mm×250 mm,5μm);流动相:乙腈-4%冰醋酸溶液(55∶45);流速:1 mL/min;紫外检测波长:342 nm;柱温:30℃;进样量:5μL。姜黄素和胡椒碱的理论塔板数均大于4000。
1.4 样品的制备
姜黄素—胡椒碱复方自微乳:取聚氧乙烯氢化蓖麻油(Cremophor RH40)6.0 g;二乙二醇单乙基醚(Transcutol HP)3.0 g;丙二醇单辛酸酯(Capryol 90)1.0 g,精密称定,置于 50 mL烧杯中,70℃、100 rmp/min磁力搅拌10分钟,得空白自微乳,精密称取空白乳1.0 g,加入姜黄素60.0 mg,胡椒碱1.0 mg,37℃、50 rmp/min磁力搅拌15分钟使之完全溶解,得姜黄素—胡椒碱复方自微乳。
姜黄素和胡椒碱对照品储备液:取姜黄素对照品5.0 mg和胡椒碱对照品1.0 mg,精密称定,分别置于10 mL和100 mL棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
姜黄素对照品溶液:精密量取姜黄素对照品储备液1 mL,置于10 mL棕色容量瓶中,加甲醇稀释至刻度,摇匀,即得。
姜黄素—胡椒碱混合对照品溶液:精密量取姜黄素和胡椒碱对照品储备液各1 mL,置于10 mL棕色容量瓶中,加甲醇稀释至刻度,摇匀,即得。
姜黄素溶液:取姜黄素60.0 mg,精密称定,置于10 mL棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
姜黄素—胡椒碱混合溶液:取姜黄素60.0 mg,胡椒碱1.0 mg,精密称定,置于10 mL棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
1.5 不同介质中姜黄素的结肠稳定性
1.5.1 不同介质中姜黄素在人工结肠液中的稳定性 参照《中华人民共和国药典》(2010年版)二部附录XIXD规定,选择pH 7.8~8.0的磷酸盐缓冲液作为人工结肠液。
1.5.2 不同介质中姜黄素在人工结肠液中的稳定性试验 精密量取姜黄素溶液和姜黄素-胡椒碱混合溶液各2 mL;另外取姜黄素-胡椒碱复方自微乳0.25 g,精密称定。分别置于50 mL棕色容量瓶中,加入(37±0.5)℃的人工结肠液稀释至刻度,摇匀,置于(37±0.5)℃ 恒温水浴中孵育,分别于0、2、3、4、6、8、12、24 小时取样1 mL 于 5 mL 棕色容量瓶中,冰浴终止反应,加入甲醇适量超声处理10分钟,冷却至室温,加入甲醇稀释至刻度,摇匀,立即取5μL,注入液相色谱仪,依法测定,记录峰面积,计算药物含量。
1.5.3 不同介质中姜黄素在小鼠结肠组织匀浆液中的稳定性 空白小鼠结肠匀浆液的制备:取KM小鼠禁食不禁水36小时,脱颈椎处死,剖开腹腔,取出整段结肠,沿肠系膜边缘剖开肠腔,用预冷的pH 7.4磷酸盐缓冲液将上述结肠反复冲洗干净,用清洁滤纸吸干水分,准确称重后,立即用眼科剪剪碎,置于冰浴的组织匀浆器中,加入预冷的pH 7.4磷酸盐缓冲液,按重量体积比为2∶8加匀浆介质,冰浴条件下制备成20%的组织匀浆。将上述组织匀浆在4℃条件下12000 rmp/min离心15分钟,取上清液作为空白小鼠结肠组织匀浆液。所有空白小鼠结肠组织匀浆液临用前新鲜制备,所有实验操作均应在4℃以下条件进行。
1.5.4 不同介质中姜黄素在小鼠结肠组织匀浆液中的稳定性试验 精密量取姜黄素溶液和姜黄素-胡椒碱混合溶液各2 mL;另外取姜黄素—胡椒碱复方自微乳0.25 g,精密称定。分别置于25 mL棕色容量瓶中,加入(37±0.5)℃的小鼠结肠组织匀浆液稀释至刻度,摇匀,置于(37±0.5)℃恒温水浴中孵育,分别于 0、0.2、0.5、1、2、4、6、8 小时取样1 mL于5 mL棕色容量瓶中,冰浴终止反应,加入甲醇适量超声处理10分钟,冷却至室温,加入甲醇稀释至刻度,摇匀,4℃条件下3000 rmp/min离心15分钟,平行处理3份,立即取5μL上清液,注入液相色谱仪,依法测定,记录峰面积,计算药物含量。
1.6 统计分析
结果用SPSS 17.0统计软件分析,实验数据以均值±标准差±s)表示,采用单因素方差分析,LSD检验比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 姜黄素在小鼠生物样品中分析方法的建立
方法专属性考察试验结果表明,在前述液相条件下,小鼠结肠匀浆液中姜黄素的保留时间与姜黄素对照品保留时间基本一致,小鼠结肠匀浆液中内源性物质对姜黄素的检测无干扰,方法专属性良好,结果见图1;以药物浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,得姜黄素在小鼠生物样品中的得回归方程为Y=7632.8X-33685,R2=0.999,线性范围为9.88~197.6μg/mL,药物浓度与峰面积线性关系均良好;小鼠生物样品中姜黄素低、中、高3个浓度的提取回收率介于93~97%之间(见表1),精密度、重复性和稳定性RSD均小于2%,说明建立的分析方法符合生物样品检测要求。
2.2 不同介质中姜黄素的结肠稳定性
2.2.1 不同介质中姜黄素在人工结肠液中的稳定性 37℃人工结肠液中孵育24小时后,姜黄素溶液、姜黄素—胡椒碱混合溶液和姜黄素—胡椒碱复方自微乳中姜黄素的降解百分率分别为19.93%、12.67%和10.50%,姜黄素—胡椒碱混合溶液组、姜黄素—胡椒碱复方自微乳组与姜黄素溶液组相比均有极显著性差异(P<0.01),降解趋势见表2。三种不同介质中姜黄素的降解均在12小时后基本保持稳定,在12小时内以lgC对时间t作图为一直线,表明姜黄素的降解过程符合一级动力学方程,根据一级反应的反应速率方程及半衰期计算公式:
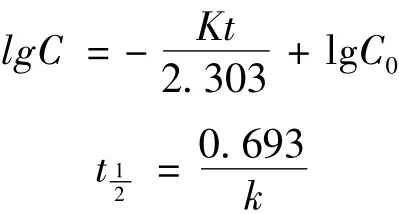
计算得姜黄素在姜黄素溶液、姜黄素—胡椒碱混合溶液和姜黄素—胡椒碱复方自微乳中,经37℃人工结肠液孵育后半衰期分别为19.67小时、57.87小时和75.23小时。
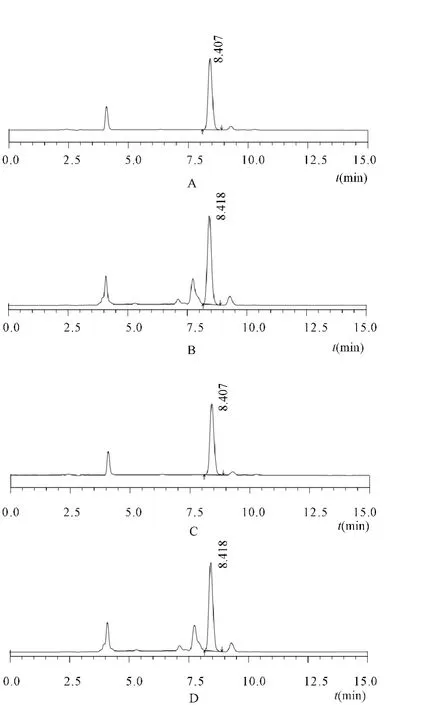
图1 小鼠结肠匀浆液中姜黄素的HPLC图
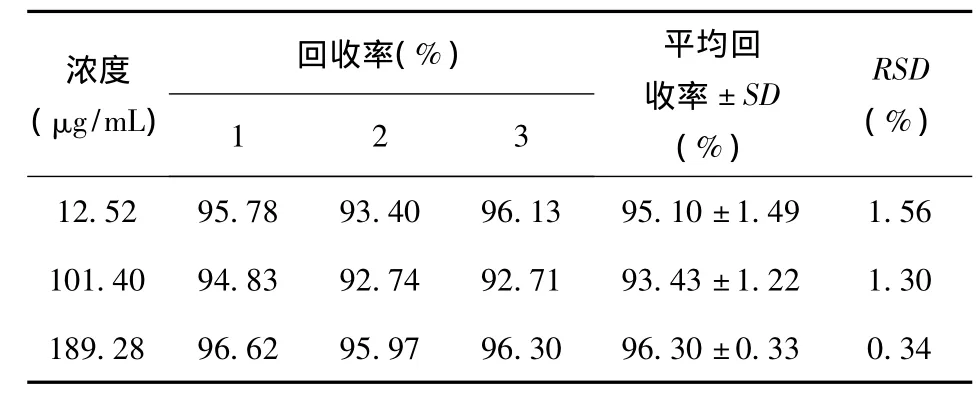
表1 提取回收率试验结果(n=3)
2.2.2 不同介质中姜黄素在小鼠结肠组织匀浆液中的稳定性 37℃小鼠结肠组织匀浆液中孵育8小时后,姜黄素溶液、姜黄素—胡椒碱混合溶液和姜黄素—胡椒碱复方自微乳中姜黄素的降解百分率分别为19.96%、14.49% 和4.63%,姜黄素—胡椒碱混合溶液组、姜黄素—胡椒碱复方自微乳组与姜黄素溶液组相比均有显著性差异(P<0.05),降解趋势见表3。三种不同介质中姜黄素的降解均在8小时后基本保持稳定,但降解过程并不符合一级动力学方程。
表2 人工结肠液中不同介质中各时间点姜黄素百分含量的比较±s,%,n=3)
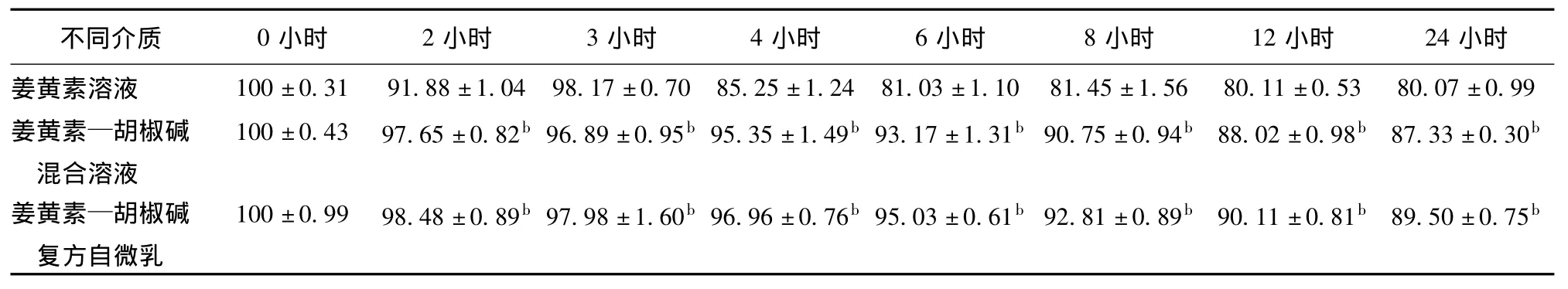
表2 人工结肠液中不同介质中各时间点姜黄素百分含量的比较±s,%,n=3)
注:与姜黄素溶液相比较a P<0.05,b P<0.01。
小时姜黄素溶液 100±0.31 91.88±1.04 98.17±0.70 85.25±1.24 8不同介质 0小时 2小时 3小时 4小时 6小时 8小时 12小时 24 1.03±1.10 81.45±1.56 80.11±0.53 80.07±0.99姜黄素—胡椒碱混合溶液100±0.43 97.65±0.82b 96.89±0.95b 95.35±1.49b 93.17±1.31b 90.75±0.94b 88.02±0.98b 87.33±0.30b姜黄素—胡椒碱复方自微乳100±0.99 98.48±0.89b 97.98±1.60b 96.96±0.76b 95.03±0.61b 92.81±0.89b 90.11±0.81b 89.50±0.75b
表3 结肠组织匀浆液中不同介质中各时间点姜黄素百分含量的比较±s,%,n=3)
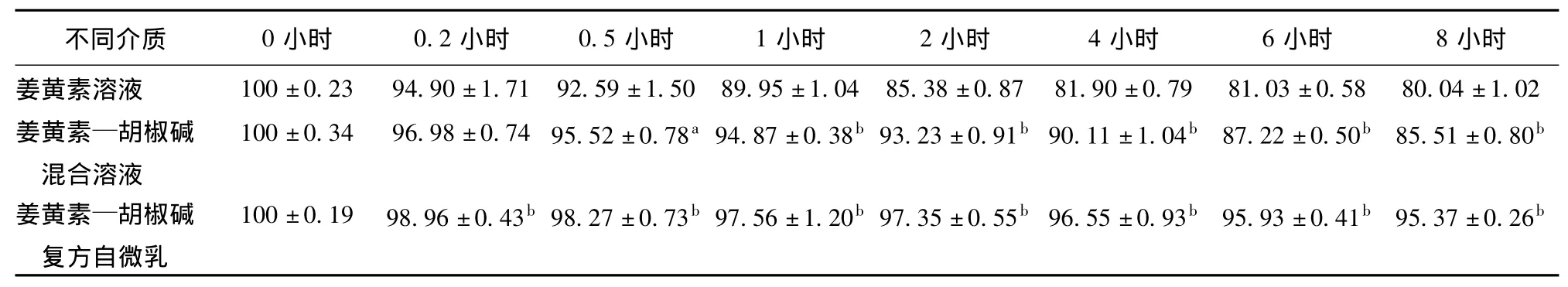
表3 结肠组织匀浆液中不同介质中各时间点姜黄素百分含量的比较±s,%,n=3)
注:与姜黄素溶液相比较a P<0.05,b P<0.01。
小时姜黄素溶液 100±0.23 94.90±1.71 92.59±1.50 89.95±1.04 8不同介质 0小时 0.2小时 0.5小时 1小时 2小时 4小时 6小时 8 5.38±0.87 81.90±0.79 81.03±0.58 80.04±1.02姜黄素—胡椒碱混合溶液100±0.34 96.98±0.74 95.52±0.78a 94.87±0.38b 93.23±0.91b 90.11±1.04b 87.22±0.50b 85.51±0.80b姜黄素—胡椒碱复方自微乳100±0.19 98.96±0.43b 98.27±0.73b 97.56±1.20b 97.35±0.55b 96.55±0.93b 95.93±0.41b 95.37±0.26b
3 小结与讨论
本实验结果表明,姜黄素在人工结肠液及小鼠结肠组织匀浆液中稳定性较差,当加入胡椒碱后其稳定性显著增加,制备成姜黄素—胡椒碱复方自微乳后姜黄素的稳定性进一步增加,说明复方自微乳可以显著改善姜黄素在结肠部位的稳定性,避免其在结肠部位的大量降解和代谢,增加姜黄素在结肠黏膜表面的滞留时间,其原因可能是胡椒碱对结肠部位酶系统的抑制作用及自微乳将姜黄素包载其中的保护作用。由此可知,姜黄素—胡椒碱复方自微乳显著改善了姜黄素在结肠部位的稳定性。
大量研究表明[20-21],胡椒碱可以通过增加膜流动性及改变酶动力学,抑制药物转运蛋白P-糖蛋白、药物代谢酶CYP3A4和葡萄糖醛酸酶等途径改善姜黄素的体内吸收程度和稳定性。Shoba等[22]给8名志愿者同时口服姜黄素和胡椒碱,45分钟后姜黄素的生物利用度增加了2000%;当给大鼠口服2 g/kg姜黄素的同时服用20 mg/kg胡椒碱1~2小时后,姜黄素的血清浓度增加了154%,表明胡椒碱作为肝脏和肠道葡萄糖醛酸酶抑制剂,可以显著改善姜黄素在人体和大鼠体内的吸收程度和稳定性,从而提高姜黄素的体内生物利用度。但笔者在制备复方自微乳过程中发现,当加入胡椒碱后,自微乳给药系统中姜黄素的稳定性有所增加,即胡椒碱的加入可以有效改善姜黄素的体外稳定性,本实验也证实了此结论,该结论国内外文献鲜有报道,可能与胡椒碱分子结构中含有烯醇结构和多个不饱和共轭双键,具有较强的还原性有关。
pH值是影响姜黄素稳定性的重要因素之一,研究表明姜黄素的降解呈pH依赖性,当pH≤5时姜黄素稳定,当处于中性或碱性环境时,姜黄素就会快速降解[23]。韩刚等[24]将姜黄素置于磷酸盐缓冲体系中孵育,结果表明pH=7时,t1/2=433.1小时,pH=8时,t1/2=52.8小时。因此,在对姜黄素进行研究时,应注意溶液pH值对其稳定性的影响。人工结肠液中姜黄素的稳定性主要受pH值的影响,而在小鼠结肠组织匀浆液中除受pH值的影响外还受肠道酶系统的影响。通过比较发现姜黄素—胡椒碱复方自微乳在小鼠结肠组织匀浆液中的稳定性要稍强于人工结肠液中,可能是由于人工结肠液的pH值稍高,破坏了自微乳的稳定性,使得姜黄素泄露,加速其降解。
本实验的目的是通过体外实验近似模拟小鼠体内结肠的真实环境,通过姜黄素在人工结肠液和小鼠结肠组织匀浆液中的稳定性研究,探讨姜黄素—胡椒碱复方自微乳对姜黄素稳定性的改善作用,为姜黄素—胡椒碱复方自微乳结肠靶向制剂的研究提供实验基础。如何最大限度的保持肠道酶系统的活性对该实验至关重要,因此所有空白小鼠结肠组织匀浆液临用前必须新鲜制备,所有有关小鼠结肠匀浆液中稳定性实验操作均应在4℃以下条件进行。实验过程中发现,姜黄素在小鼠结肠液中的降解在1小时内较明显,之后降解速率逐渐降低,可能与肠道酶系统的活性逐渐减弱有关。
目前,大量研究表明姜黄药材中存在着姜黄素的天然稳定剂[25-26],提示采用姜黄素提取物制备姜黄素新型制剂,可提高制剂中姜黄素的体外稳定性,但对其体内稳定性和药效作用的影响还有待进一步研究。
[1] Wang YF,Zu JN,Li J,et al.Curcumin promotes the spinal cord repair via inhibition of glial scar formation and inflammation[J].Neurosci Lett,2014,560:51-56.
[2] SinglaV,Mouli VP,Garg SK,et al.Induction with NCB-02(curcumin)enema for mild-to-moderate distal ulcerative colitis-A randomized,placebo-controlled,pilot study [J].J Crohns Colitis,2014,8(3):208-214.
[3] Zhao WC,Zhang B,Liao MJ,et al.Curcumin ameliorated diabetic neuropathy partially by inhibition of NADPH oxidase mediating oxidative stress in the spinal cord[J].Neurosci Lett,2014,560:81-85.
[4] Yu CW,Wei CC,Liao VH.Curcumin-mediated oxidative stress resistance in Caenorhabditis elegans is modulated by age-1,akt-1,pdk-1,osr-1,unc-43,sek-1,skn-1,sir-2.1 and mev-1 [J].Free Radic Res,2014,48(3):371-379.
[5] Zhang L,Luo JX,Zhang MH,et al.Effects of curcumin on chronic,unpredictable,mild,stress-induced depressive-like behaviour and structural plasticity in the lateral amygdala of rats[J].Int J Neuropsychopharmacol,2014,17(5):793-806.
[6] Sanmukhani J,Satodia V,Trivedi J,et al.Efficacy and Safety of Curcumin in Major Depressive Disorder:A Randomized Controlled Trial[J].Phytother Res,2014,28(4):579-585.
[7] Wang P,Su C,Li R,et al.Mechanisms and Effects of Curcumin on Spatial Learning and Memory Improvement in APPswe/PS1dE9 Mice[J].JNeurosci Res,2014,92(2):218-231.
[8] 冯慧利,李瑞晟,王虹,等.姜黄素对APP/PS1双转基因小鼠海马IRS-1和p-IRS-1表达的影响[J].中国中药杂志,2013,38(9):1290-1294.
[9] Lim TG1,Lee SY,Huang Z,et al.Curcumin suppresses proliferation of colon cancer cells by targeting CDK2[J].Cancer Prev Res(Phila),2014,7(4):466-474.
[10] 郭立达,薛佳伟,渠开跃,等.姜黄素联合奥沙利铂对人结肠癌 LoVo细胞裸鼠移植瘤的抗癌作用研究[J].中草药,2013,16:2261-2266.
[11] Zheng J,Wu C,Lin Z,et al.Curcumin up-regulates phosphatase and tensin homologue deleted on chromosome 10 through microRNA-mediated control of DNA methylation-a novel mechanism suppressing liver fibrosis[J].FEBSJ,2014,281(1):88-103.
[12] Nabavi SF,Daglia M,Moghaddam AH,et al.Curcumin and Liver Disease:from Chemistry to Medicine[J].COMPR REV FOOD SCI F,2014,13(1):62-77.
[13] Qureshi S,Shah AH,Ageel AM.Toxicity studies on Alpinia galanga and Curcuma longa[J].Planta Med,1992,58:124-127.
[14] Shankar TN,Shantha NV,Ramesh HP,et al.Toxicity studies on turmeric(Curcuma longa):Acute toxicity studies in rats,guineapigs & monkeys[J].Indian J Exp Biol,1980,18(1):73-75.
[15] Cheng AL,Hsu CH,Lin JK,et al.Phase I clinical trial of curcumin,a chemopreventive agent,in patients with high-risk or premalignant lesions [J].Anticancer Res,2001,21(4B):2895-2900.
[16] Lao CD,Rufn MT,Normolle D,et al.Dose escalation of a curcuminoid formulation[J].BMCComplement Altern Med,2006,6:10-13.
[17] Prasad S,Tyagi AK,Aggarwal BB.Aggarwal,Recent Developments in Delivery,Bioavailability,Absorption and Metabolism of Curcumin:the Golden Pigment from Golden Spice[J].Cancer Res Treat,2014,46(1):2-18.
[18] Oliveira RG,Alencar-Filho EB,Vasconcellos MLAA.The influence of piperine on the bioavailability of drugs:a molecular approach[J].Química Nova,2014,37(1):69-73.
[19] Tu YS,Fu JW,Sun DM,et al.Preparation,characterisation and evaluation of curcumin with piperine-loaded cubosome nanoparticles[J].JMicroencapsul,2014,31(6):551-559.
[20] Sharma V,Nehru B,Munshi A,et al.Antioxidant potential of curcumin against oxidative insult induced by pentylenetetrazol in epileptic rats[J].MethodsFind Exp Clin Pharmacol,2010,32(4):227-232.
[21] Suresh D,Srinivasan K.Tissue distribution & elimination of capsaicin,piperine & curcumin following oral intake in rats[J].Indian JMed Res,2010,131(5):682-691.
[22] Shoba G,Joy D,Joseph T,et al.Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers[J].Planta Med,1998,64(4):353-356.
[23] Wang Y J,Pan M H,Cheng A L,et al.Stability of curcumin in buffer solutions and characterization of its degradation products[J].J Pharm Biomed Anal,1997,15(12):1867-1876.
[24] 韩刚,霍文,李秋影,等.姜黄素的稳定性研究[J].中成药,2007,29(2):291-293.
[25] 韩刚,董月,原海忠,等.姜黄中脱甲氧基姜黄素和双脱甲氧基姜黄素对姜黄素稳定性的影响[J].中草药,2009,40(9):1411-1413.
[26] 韩刚,刘正猛,王晓雁,等.姜黄不同提取部位对姜黄素的稳定作用[J].中国中药杂志,2007,32(10):915-917.

