基于空心微针阵列的连续监测葡萄糖传感器
刘 尚,岳瑞峰
(清华大学 微电子学研究所,北京100084)
0 引 言
近年来能够实时连续检测血糖浓度的植入式传感器,特别是可以做到微痛或无痛的传感器已经成为研发的热点,如Ahyeon Koh 等人设计的超微孔聚氨酯涂覆的针形植入式葡萄糖传感器[1],RA Croce Jr 等人设计的绕线型经皮测试系统[2]。相对于体外检测,植入式葡萄糖传感器无疑将面临更多挑战[3,4],例如:连续检测的检测液通常是成分不断变化的血液或组织液,且其中的抗坏血酸等多种电活性成分都会对检测结果造成很大的干扰,为此,要求传感器的响应时间快、抗干扰能力强、植入及使用时无痛或微痛。
针型葡萄糖传感器因为其易于制造和适合植入的特性而受到广泛关注[5]。现有的针形葡萄糖传感器多采用双电极结构,为应对复杂多变的体内环境,增强传感器抗干扰能力,通常需要进行多层膜修饰,无疑增加了传感器的制作难度和复杂程度,同时也降低了传感器的响应值和灵敏度;对参比电极有较强的依赖性,而且传感器制作多采用电极集成的方式,将多电极整合到单根针上,这使得传感器难以实现小型化,在植入和使用时给患者带来很大痛苦[1,2,6]。为避免植入过程中传感器工作区域与皮肤组织直接接触带来的应力与摩擦对膜层造成的破坏和损伤,也需要专门的植入装置[7,8],患者难以自行佩戴,存在很大的不便利性。植入后的传感器工作区域与创口组织直接接触,容易造成细胞粘附和炎症发应[9],不利于血液或组织液与工作区域的大面积接触,导致植入后传感器响应值和灵敏度的降低。
本文提出的葡萄糖传感器采用了3 根微针组成的三电极结构,其利用工作电极和辅助电极的差分来消除工作时的共模干扰以提高抗干扰性能,同时降低了传感器背景电流和参比电极电位变化对测试的影响,而且响应时间较快。
1 传感器工作原理与设计
1.1 传感器工作原理
如图1 所示,基于葡萄糖氧化酶(glucose oxidase,GOD)对葡萄糖的如下酶促反应


图1 酶电极工作原理图Fig 1 Working principle diagram of enzyme electrode
葡萄糖的浓度和生成的H2O2的量之间的当量关系,在一定电位下,金属Pt 对H2O2具有催化分解作用

电荷转移至酶电极产生电流信号,电流大小与H2O2浓度呈正比,故与葡萄糖浓度也存在当量关系,可通过检测产生电流的大小来反映被检测葡萄糖的浓度。
1.2 结构设计
设计的传感器采用由3 根微针组成的三电极结构,分别用作工作电极(working electrode,WE)、辅助电极(counter electrode,CE)和参比电极(reference electrode,RE)。其中,工作电极和辅助电极均采用针尖通孔处的内外表面淀积了Ti/Pt 薄膜的空心不锈钢微针,参比电极采用直径为200μm的Ag/AgCl 实心微针来测量其它电极的电位。将酶固定在空心微针楔形针尖上的通孔里,这样在刺入人体过程中既能够确保其不会脱落,又可使微针内的空心管道与大气相通以提供充足的氧。辅助电极与工作电极的结构相同,区别仅在于辅助电极上固定的酶失去了活性。使用时对它们加以相同的电位,理论上干扰物质将会产生同样的响应,通过差分的形式就可以非常方便地去除这些电活性物质的干扰,得到很高的抗干扰性能,同时降低传感器背景电流和参比电极电位变化对测试的影响,而且不会对响应时间带来明显影响。
2 制 作
2.1 溅射与电极的预处理
将去油、洁净后的空心不锈钢微针(外、内径分别为300,100 μm)的底端固定、针尖一端垂直向上,在其表面采用直流溅射淀积了一层厚度约为20 nm/120 nm 的Ti/Pt 薄膜用作电极。将电极超声清洗后,在电极前端(>2 mm)的外表面(包括针尖楔形表面,注意保持通孔畅通)均匀涂覆一层尽可能薄的单组分医用环氧树脂溶液并加热至120 ℃固化,随后将电极浸入磷酸盐缓冲液(phosphate buffered saline,PBS)中加一定电压进行循环扫描,使电极中电活性杂质溶出,直至响应电流稳定时为止。
2.2 葡萄糖氧化酶的固定
采用比较成熟的戊二醛—牛血清白蛋白交联法进行葡萄糖氧化酶的固定。配比如下:取GOD(Heowns,250U/mg)2 mg,加PBS(0.01 mol/L,pH=7.4,北京鼎国)90 μL,酶含量为5.56 U/μL;取牛血清白蛋白(bovine serum albumin,BSA)(Sigma)7 mg,加PBS 70 μL;取2%的戊二醛(25%,汕头西陇),将GOD,BSA,戊二醛溶液按体积比5︰5︰1 的比例混合、摇匀。将预处理后的微针电极针尖楔形处浸入混合液3 ~5 s,重复3 次后,置于洁净的培养皿中,室温静置2h晾干后用去离子水清洗残余未固定的酶再晾干,一批置于4 ℃冷藏备用,一批置于室温下洁净的培养皿中。
2.3 Ag/AgCl 参比电极的制备
取直径为200 μm 的实心Ag 线,打磨后清洁表面。将Ag 线分为2 段,一段作阳极,一段作阴极,浸入浓度0.1 mol/L的盐酸溶液中。在两极间加5 V 电压,避光电解10 min 后将阳极的Ag 线取出清洗,即可制备出致密均匀的白色Ag/AgCl 微针电极,并置于饱和KCl 溶液中避光保存。
2.4 传感器的组装
取室温下(约25 ℃)已存放15 天的固定酶后的微针电极进行葡萄糖滴加测试,电极对葡萄糖无特异反应,说明固定的酶已失活。取冷藏的微针电极用作工作电极,常温存放酶已失活的微针电极用作辅助电极,与Ag/AgCl 参比电极按照正三角形排布(边长2 mm)并用快固型双组分环氧树脂固定,露出电极高度2 mm。静置2 h 待环氧树脂完全固化后,用导电胶在微针后端将引线引出以备测试,并确保微针后端的通孔与大气畅通。
3 测试与分析
3.1 循环伏安扫描
为了确定电极工作的最佳电位,先将电极阵列浸入1 mmol·L-1的葡萄糖溶液,在工作电极和参比电极间加扫描范围为0.4 ~0.9 V、变化速度为100 mV/s 的三角波进行循环伏安扫描,所得氧化还原曲线如图2 所示。从图中可知,氧化还原峰出现在0.7 V,所以,传感器工作电位取值为0.7 V。
3.2 台阶测试

图2 循环伏安曲线Fig 2 Cyclic voltammetric curve
测试采用电流时间曲线法在37 ℃下进行,对工作电极和辅助电极均施加0.7 V 工作电压(WE vs RE;CE vs RE)。将电极浸入6mL PBS 溶液中,待响应稳定后开始计时,每隔一定时间滴加一定量的浓度为30 mmol·L-1的葡萄糖溶液,被测试溶液每次浓度变化1 mmol·L-1,并记录输出的变化情况。电流时间曲线如图3 所示,传感器至第21 次滴加时均响应良好,阶差明显,此后继续滴加溶液,传感器响应趋于饱和,整体符合Michaelis-Menten 的酶传感器特征,传感器线性范围应在20 mmol·L-1左右。

图3 滴加响应曲线Fig 3 Dropwise response curve
3.3 线性范围与灵敏度测试
先将电极浸入PBS 中,等系统响应稳定后,对不同浓度的葡萄糖溶液进行测试,结果如图4 所示。采用线性拟合的方法对响应值进行处理,所得拟合曲线方程为Y=0.118+0.575 X,(R2=0.998)。从而得到葡萄糖传感器的零位为0.118 μA,灵敏度(S)达到0.575 μA/(mmol·L-1),线性范围在21 mmol·L-1以上,传感器检出限(LOD)为6.58 μmol·L-1(LOD=3 σ/S,σ 取11 次测量PBS 基液响应的标准偏差),米氏常数KM=11.856 mmol·L-1。
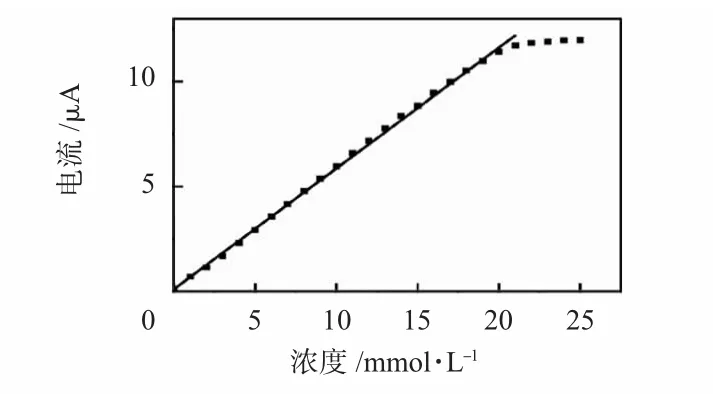
图4 不同浓度葡萄糖溶液响应Fig 4 Response of glucose solution with different concentration
3.4 响应时间测试
待传感器的响应在低浓度溶液里稳定一段时间后,迅速将传感器移至较高浓度的溶液中,此过程中一直保持电流表对响应电流的持续测量。所得响应曲线如图5 所示,从移动传感器浸入高浓度溶液即图中出现上升阶跃开始,到在高浓度溶液中响应值基本稳定为止,所经历时间约为16 s,即响应时间约为16 s。

图5 响应时间曲线Fig 5 Response time curve
3.5 抗干扰性测试
基于H2O2电极的葡萄糖传感器最大的挑战在于消除生理条件下人体电活性物质带来的干扰[4]。在0.7 V 的工作电位下,人体内的电活性物质如抗坏血酸、尿酸等均会在Pt 电极催化作用下发生氧化分解,人常用的退烧药必理通(主要成分对乙酰氨基酚)也同样会发生氧化分解,产生响应电流。测试选用抗坏血酸和必理通两种药品,所用浓度抗坏血酸取为0.15 mmol·L-1,对乙酰氨基酚0.2 mmol·L-1(均略高于生理水平),测试底液葡萄糖浓度5.6 mmol·L-1,所得响应曲线如图6 所示。从测试结果可以看出,除滴加溶液时造成的机械干扰,整体响应无明显变化。

图6 干扰物对三电极工作体系的影响Fig 6 Effect of chaff interferent on working system of three-electrode
对双电极系统进行同样测试,所得响应曲线如图7 所示。滴加对乙酰氨基酚溶液和抗坏血酸溶液对双电极系统的传感器性能均有明显影响,产生的稳态干扰电流分别为0.439 μA 和0.362 μA。

图7 干扰物对双电极工作体系的影响Fig 7 Effect of chaff interferent on working system of double electrode
对比三电极工作体系和双电极工作体系测试结果可发现,二者对5.6 mmol·L-1的葡萄糖溶液产生的稳态电流变化均在3.25 μA 左右,所加干扰物质对三电极体系无明显影响。可见三电极工作体系具有很强的抗干扰能力,而且不会降低传感器对检测物的有效响应。
3.6 回收率测试
回收率主要考察传感器的准确度,通过传感器对所加标准浓度底物的检出能力来表征。传感器回收率测试对同一工艺步骤和条件参数的7 只传感器进行,标准曲线取为线性范围和灵敏度测试中的线性区拟合曲线(按拟合方程Y=0.118+0.575 X),所得响应曲线如图8 所示,传感器在线性范围内(<21 mmol·L-1)具有较好的一致性,随着浓度增加响应电流差异性变大。在整个线性工作范围内,传感器回收率为0.93 ~1.07。

图8 不同传感器响应曲线Fig 8 Response curve of different sensors
3.7 传感器存储和工作稳定性
传感器的存储和工作稳定性通过测试期间传感器的线性范围和灵敏度变化来体现。对于存储稳定性测试,为避免干湿交替对传感器性能的影响,将传感器存储于4 ℃的PBS 中。存储8 天后进行测试,传感器仍能保持原有线性范围(>21 mmol·L-1),灵敏度无明显变化(<1%);存储15 天时间的传感器在24 mmol·L-1内的响应电流仍可达到初始响应电流的80%。传感器工作性能随时间变化曲线如图9 所示,非测试时段传感器存放于37℃下浓度为5.5 mmol·L-1的葡萄糖溶液中(不加电压)。可以看出:传感器性能变化明显,线性范围和灵敏度分别从初始的21 mmol·L-1,0.575μA/(mmol·L-1)下降到第4 天时的8 mmol·L-1,0.244μA/(mmol·L-1),这和传感器未经过任何修饰,固定的氧化酶可能部分回溶至溶液和在葡萄糖溶液中存放时生成的H2O2使固定酶变性有关[10]。
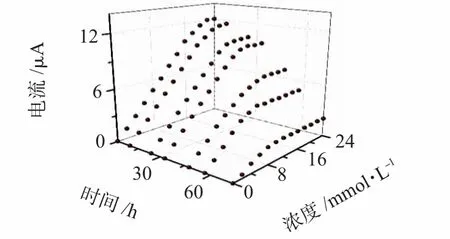
图9 传感器性能随时间变化Fig 9 Sensor performance change with time
4 结 论
本文采用空心微针制造的葡萄糖传感器,在不加修饰膜的情况下,线性范围为0 ~21 mmol·L-1,灵敏度为0.575 μA/(mmol·L-1),检出限为6.58 μmol·L-1,响应时间为16 s,传感器回收率在0.93 ~1.07 之间。采用三电极结构,可很好地排除抗坏血酸对传感器性能的影响。由于微针纤细短小,可望实现植入式微痛快速实时测量血糖值。
[1] Koh A,Lu Y,Schoenfisch M H.Fabrication of nitric oxide-releasing porous polyurethane membranes-coated needle-type implantable glucose biosensors [J].Analytical Chemistry,2013,85(21):10488-10494.
[2] Croce Jr R A,Vaddiraju S S,Kondo J,et al.A miniaturized transcutaneous system for continuous glucose monitoring[J].Biomedical Microdevices,2013,15(1):151-160.
[3] Vaddiraju S,Burgess D J,Tomazos I,et al.Technologies for continuous glucose monitoring:Current problems and future promises[J].Journal of Diabetes Science and Technology,2010,4(6):1540-1562.
[4] Nichols S P,Koh A,Storm W L,et al.Biocompatible materials for continuous glucose monitoring devices[J].Chemical Reviews,2013,113(4):2528-2549.
[5] Yang Q,Atanasov P,Wilkins E.Development of needle-type glucose sensor with high selectivity[J].Sensors and Actuators B:Chemical,1998,46(3):249-256.
[6] Bindra D S,Zhang Y,Wilson G S,et al.Design and in vitro studies of a needle-type glucose sensor for subcutaneous monitoring[J].Analytical Chemistry,1991,63(17):1692-1696.
[7] Moussy F,Harrison D J,O’Brien D W,et al.Performance of subcutaneously implanted needle-type glucose sensors employing a novel trilayer coating[J].Analytical Chemistry,1993,65(15):2072-2077.
[8] 美敦力.CGMS 产品介绍[EB/OL].[2013—07—12].http:∥medtronicdiabetes.com.cn/product/83.html.
[9] 沙宪政.皮下植入式葡萄糖传感器的研究进展[J].国外医学:生物医学工程分册,2003,26(1):42-48.
[10]Tse P H S,Gough D A.Time-dependent inactivation of immobilized glucose oxidase and catalase[J].Biotechnology and Bioengineering,1987,29(6):705-713.

