粗毛栓菌原生质体UV诱变漆酶高产菌株的选育*
赵 颖 孙崇然 王宇飞 张 莹 王晓丽 朱友双
(济宁医学院生物科学学院,山东 日照276826)
漆酶作为一种环保型酵素,在有机物合成、造纸业废液的处理及纸浆的漂白等方面具有很高的应用价值[1]。在自然界中,粗毛栓菌是重要的产漆酶 菌 株[2-3]。 前 期 研 究 表 明 粗 毛 栓 菌 Trametes hirsuta lg-9能够高效合成非典型漆酶,该漆酶表现出比普通漆酶应用前景更好的特征,如热稳定性高,最适pH值偏低,能够在不存在介体的情况下氧化甲基红和茜素红等[4-6]。然而,该菌漆酶产量较低,远达不到工业要求,因此,对其进行基因突变改良成为一种必然要求。然而,该菌无性阶段为多核菌丝体,不能形成分生孢子,有性孢子的获得条件高、周期长[7],因此,为单基因型细胞进行菌株的基因突变改良则宜选择单核的原生质体。本文以粗毛栓菌Trametes hirsuta lg-9为出发菌株,对原生质体的制备方法进行优化,并通过国内外广泛采用的紫外诱变方法获得漆酶高产菌株,为进一步构建非典型漆酶工程菌提供出发菌株。
1 材料和方法
1.1 材料
本实验所用 Trametes hirsuta lg-9(CGMCC No.2422)为山东大学微生物国家重点实验室惠赠。
培养基:PDA固体培养基;PDA液体培养基;液体菌丝生长培养基(液体PDA另加数十颗直径为5mm的玻璃球);上层软洋菜培养基(马铃薯汁20%,葡萄糖0.5%,琼脂2%,pH自然值)。
试剂:0.8MMgSO4溶液(由pH7.4磷酸缓冲液制备 );0.8mol/L Sorbitol溶液(Sorbitol 1.2M,CaCl20.05M,Tris.CC pH 7.5 0.01M);β-葡聚糖酶(Glucanase solarbio公司);蜗牛酶(上海源叶生物科技有限公司);ABTS(成都艾科达化学试剂有限公司 )。
1.2 方法
1.2.1 原生质体的制备 将新鲜活化的菌株转接液体菌丝生长培养基,30℃,120rpm培养58~60h,用无菌纱布过滤,收集菌丝体,先无菌水洗涤3次,后0.8M的MgSO4溶液洗涤1次。将菌体均分于6个无菌三角瓶中,分别加入以MgSO4溶液为溶剂配置的6种酶解液(1%蜗牛酶溶液;0.5%蜗牛酶+0.5%β-葡聚糖酶溶液;1%β-葡聚糖酶溶液;2%蜗牛酶溶液;1%蜗牛酶+1%β-葡聚糖酶溶液;2%β-葡聚糖酶溶液)。酶解液震荡30℃,120rpm,×40显微镜下间断性观察原生质体的释放情况。待酶解充分后,加入等体积的Sorbitol溶液。8层纱布过滤即可得到去除菌丝片段的纯化原生质体。
1.2.2 原生质体的再生及紫外诱变 血球计数板计算原生质体数量,并用Sorbitol溶液将原生质体稀释到一定浓度,将稀释的溶液分成6份,以其中以一份进行原生质体再生实验,不进行紫外照射;其它5份分别进行40、50、60、70、80s紫外照射,照射后进行10min暗处理。分别取400μL原生质体溶液与1ml的上层软洋菜培养基混合均匀,平铺于固体PDA平板上,30℃培养5d。根据PDA平板上单菌落的生成情况计算原生质体再生率及原生质体紫外诱变致死率。
再生率(%)=A/α×100% 致死率(%)=(A-B)/A×100%
注:A-每份400μL稀释后原生质体溶液在再生培养基上生长的菌落数;α-血球计数板计算求得的每份400μL稀释后溶液中原生质体数;B-每份样品经紫外照射后在再生培养基上生长的菌落数。
1.2.3 UV诱变菌株漆酶活性和胞外总蛋白的测定 选取紫外诱变平板单菌落至PDA固体平板,30℃,培养5d后用无菌打孔器转接至100ml液体PDA培养基,30℃,120rpm,培养3d后,每隔24h,离心取上清。以Trametes hirsutalg-9为对照,进行粗酶液漆酶活力和总蛋白的测定,连续测定5d。每个菌株各做3个重复,共完成3次平行实验。上清总蛋白的测定使用Folin酚法:取300μL上清,加入4ml 4%NaCO3和0.5ml folin酚溶液37℃静置60min后测OD500。漆酶活性测定是采用ABTS法:将上清适当稀释后取30μL加入2.9ml 0.1M 醋酸缓冲液和75μL 20MABTS溶液,37℃静置30min后测 OD420[8]。
2 结果
2.1 原生质体制备的酶解条件
酶解液的浓度、配比和酶解时间是影响原生质体制备的重要因素。白腐真菌以混合酶液(1%蜗牛酶+0.5%β-葡聚糖酶)酶解效果最好,2%蜗牛酶次之,以酶解4h为最佳酶解时间,结果见表1、图1。

表1 酶解液的浓度及配比对原生质体形成数的影响
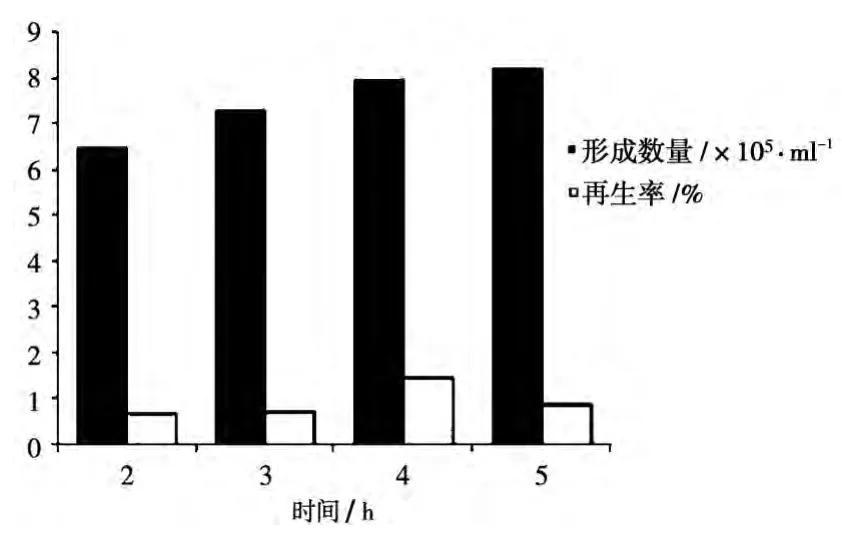
图1 酶解时间对原生质体形成数和再生率的影响
2.2 原生质体的紫外诱变
将稀释一定浓度的原生质体在发光稳定波长254nm,15W紫外灯下距离30cm处对原生质体分别进行了40、50、60、70、80s的紫外灯照射,照射后分别进行10min暗处理,30℃培养5d。根据PDA平板上单菌落的生成情况计算原生质体紫外诱变致死率。结果见表2。

表2 不同紫外照射时间对原生质体致死率的影响
2.3 诱变菌株的功能检测
挑取70s诱变平板上的18个分离、生长状态良好的单菌落,培养发酵。发酵3d后,每隔24h测定各菌株漆酶活力,同时,为检测诱变对菌体生长情况的影响,我们同时检测了上清发酵液的总蛋白活力,用以监测菌株的生长状况。最终以出发菌株Trametes hirsuta lg-9为对照从中挑选5株漆酶活力有明显变化的菌株。对于诱变的菌株,其遗传稳定性有极其重要的作用,为此将筛选到的诱变菌株进行3次连续传代培养并进行发酵检测。由表3与图2结果最终确定诱变菌株JM-70S3和JM-70S8为漆酶活力提高稳定菌株。
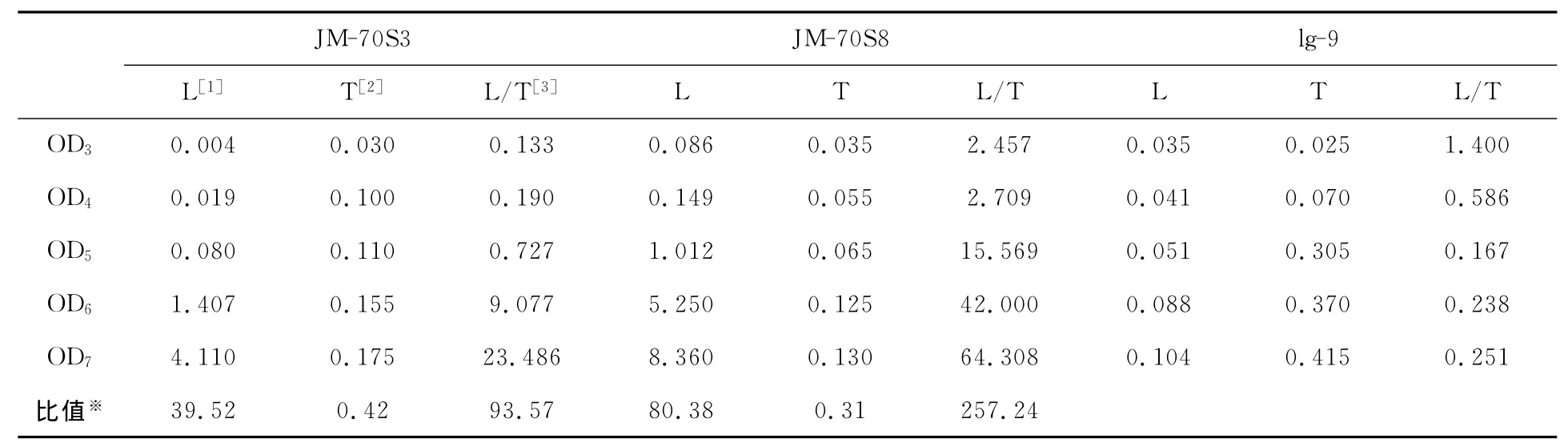
表3 诱变菌株漆酶的分泌活性和上清中总蛋白分析

图2 不同菌株培养第7天漆酶与上清总蛋白的OD值
3 讨论
3.1 酶解条件对原生质体的影响
酶解液的浓度及配比是影响原生质体制备的重要因素,若酶浓度过大,酶中常常会含有对原生质体有害的酶类(例如过氧化物酶、核糖核酸酶等),伴随着酶量的持续增加,杂酶的浓度也会紧随之而增加,若酶量达到一定浓度,势必将会影响原生质体的活性。此外,在酶浓度过大时,菌体易发生凝集,使得原生质体的生成变得困难[9]。本文结果显示:白腐真菌是以混合酶液(1%蜗牛酶+1%β-葡聚糖酶)酶解效果最好,2%蜗牛酶次之。
随着酶解时间延长,粗毛栓菌Trametes hirsuta lg-9细胞脱壁会愈加完全,而原生质体的再生是以细胞壁的酶解残余物作引物,所以酶解时间过长,必然影响到原生质体的再生率。由不同的酶解时间的单因素实验可得,粗毛栓菌Trametes hirsuta lg-9以混合酶液(1%蜗牛酶+1%β-葡聚糖酶)酶解时,原生质体数量在前4个小时里,随着时间线性增加,第5个小时原生质体数量增加速率放缓,酶解4h时的原生质体数量8×105个/ml,5h时为8.2×105个/ml,而原生质体再生率4h时最高为1.44%,5h时仅为0.86%,因此,粗毛栓菌Trametes hirsuta lg-9以混合酶液(1%蜗牛酶+1%β-葡聚糖酶)酶解4h为最佳的酶解时间。
3.2 原生质体紫外诱变条件的确定
通过表2可得在紫外照射时间为70s时,致死率为78.26%,据有关报道可知,诱变的最佳致死率在70%~80%之间[10],而紫外诱变70s符合实验要求,因此,本实验选择70s为粗毛栓菌Trametes hirsuta lg-9的紫外诱变时间。
3.3 漆酶高产诱变菌株的确定
由表3中数据可知:出发菌株lg-9上清总蛋白和JM-70S8与JM-70S3在第3天和第4天时很接近,而在第5天以后,特别是在第7天时JM-70S8与JM-70S3的总蛋白比lg-9明显小很多;第7天时漆酶的产量JM-70S8为出发菌株的80.38倍,JM-70S3是39.52倍;而JM-70S8第7天漆酶OD值与上清总蛋白OD值比是出发菌株的257.24倍,JM-70S3菌株是93.57倍。所以,无论是单纯从漆酶活力比较,还是从漆酶与上清总蛋白比值来比较,都能很明显地看出JM-70S8与JM-70S3是经过紫外诱变后突变的漆酶高产白腐真菌菌株。
综上所述,粗毛栓菌Trametes hirsuta lg-9原生质体紫外诱变育种的最佳条件为:菌龄为58h,采用1%蜗牛酶+1%β-葡聚糖酶(1∶1)混合液,30℃酶解4h,并用0.8M的MgSO4溶液作渗透压稳定剂,原生质体再生率为1.44%;通过对原生质体进行70s紫外照射,在原生质体致死率为78%的条件下,筛选出较出发菌株漆酶高产菌株JM-70S8与JM-70S3。试验结果表明:原生质体诱变育种技术跨过某些菌不能形成分生孢子的瓶颈,可作为单核基因育种的重要手段;并且原生质体可以作为单个细胞单位而便于控制,并避免后代过多的分离现象。
接下来可进一步对高产菌株尤其是JM-70S8进行培养研究:一方面,在用传统的PDA液体培养基探讨突变株功能时,通过发酵液上清总蛋白的跟踪检测发现该培养基特别是在第5天以后不适合突变菌株JM-70S8与JM-70S3的菌量的生长,从而可对发酵培养基进行优化从而将JM-70S8与JM-70S3的漆酶产量进一步提高;另一方面,出发菌株Trametes hirsuta lg-9为非典型漆酶生产菌株,而经紫外诱变后漆酶高产菌株产生的漆酶是否还具有非典型性,需要进行进一步的验证;再一方面对高产菌株进行基因分析,找到突变基因,并探讨哪些基因的变化引起漆酶活力的提高,从而对基因稳定的非典型漆酶高产菌株进行定点突变,从而得到非典型漆酶高产工程菌株。
[1] Elisashvili V,Kachlishvili E.Physiological regulation of laccase and manganese peroxidase production by white-rotBasidiomycetes[J].J Biotechnol,2009,144:37-42.
[2] 朱友双.碳源氮源对杂色云芝产漆酶的影响[J].济宁医学院学报,2014,37(5):305-308.
[3] Eggert C,Temp U,Erikssion K E.Laccase is essential for lignin degrar dation by the white rot fungus Pvenoporus cinnaharinus[J].FEBS Lett,1997,407(1):89-92.
[4] Zhang H B,Zhang Y L,Huang F,et al.Purification and characterization of a thermostable laccase with unique oxidative characteristics from Trametes hirsute[J].Biotechnol Lett,2009,31(6):837-843.
[5] 司静,李伟,崔宝凯,等.真菌漆酶性质、分子生物学及其应用研究进展[J].生物技术通报,2011,27(2):48-55.
[6] 陈辉,张剑波,刘小鹏,等.漆酶催化降解氯酚类有机污染物[J].北京大学学报(自然科学版),2005,51(4):605-611.
[7] 梅凡、江义、赵超,等.漆酶高产菌株的筛选及诱变育种[J].贵州农业科学,2014,41(2):128-131.
[8] 吴涓,肖亚中,王怡平,等.蜜环菌胞外漆酶酶活力的分光光度法测定[J].厦门大学学报(自然科学版),2001,71(4):893-898.
[9] 王丽宁,赵妍,张宝粉,等,利用原生质体紫外诱变技术选育耐高温香菇菌株[J].微生物学通报,2014,41(7):1350-1357.
[10]张红梅,徐淑霞,吴坤.漆酶产生菌的原生质体诱变选育[J].郑州轻工业学院学报(自然科学版),2005,20(2):14-16.

