农业土壤生态功能稳定性的影响因素及其相关性分析
陈欣瑶,陈楸健,李敏,牛晓丛,周阳,赵乔,张园
苏州科技学院环境科学与工程学院,江苏苏州215009
农业土壤生态功能稳定性的影响因素及其相关性分析
陈欣瑶,陈楸健,李敏,牛晓丛,周阳,赵乔,张园*
苏州科技学院环境科学与工程学院,江苏苏州215009
本文以全国13种不同区域农业土壤为研究对象,通过对CO2呼吸速率、土壤理化性质、香农指数的测定来描述不同土壤类型的生物性抵抗力和恢复力特征,探索影响土壤功能抵抗力和恢复力的关键因子,从而实现土壤质量评价的量化表征。研究表明,在加铜(Cu)胁迫的情况下,不同土壤类型中微生物的抵抗力、恢复力(试验组/控制组的比值f(t))存在先降低后增加的趋势或者呈完全下降的趋势,表明土壤受到铜胁迫后总会出现功能稳定性下降的现象,但对于自身生态系统稳定性好的土壤,会恢复铜胁迫带来的毒性危害。理化性质与生物功能稳定性的关系通过相关性的回归分析得到:pH与抵抗力有正低度相关性,与恢复力和稳定性不相关;CEC与抵抗力之间的关系为正相关;C/N与抵抗力、恢复力、稳定性均为不相关关系;DOC的浓度与抵抗力和恢复力不相关,与稳定性的低度相关;砂粒百分比与土壤对铜胁迫的恢复力呈指数下降关系,指数方程为y=259.42e-0.022x,R2=0.6468,表明,砂粒百分比越高,土壤应对铜胁迫所体现的恢复力越弱。香农指数表明,铜胁迫能够减少土壤微生物的种群密度和均匀度,改变微生物群落结构,降低微生物活动,降低生物群落多样性。
土壤性质;土壤生物;抵抗力;恢复力
随着人口增长速度和城市化进程的加快和现代工农业的发展,大量污染物质以废水、废气、废渣的形式在人为开采利用的过程中进入土壤生态系统并不断累积,在近年来带来严重的污染问题,其中耕地土壤污染问题与人类生存健康最为息息相关。由于土壤生态系统具有一定的稳定性,在经受污染或者剧烈环境变化后,系统的一些组成和功能随着时间的推移可能会部分或者完全恢复。研究土壤生态系统稳定性及其内在机理,对于科学评价土壤污染对生态系统的影响具有重要意义[1]。稳定性同时也是评价土壤健康和土壤质量的重要指标[2]。土壤生态系统稳定性是生态系统赖以存在和演化的基本前提,区别于外在影响因素,生态系统稳定性的控制因子被认为是一种内在的机制[3-5]。McCann认为生态学研究中稳定性有两种内涵:一种是生态系统的动态稳定性;另一种是系统对抗干扰所带来系统变化的能力,包括抵抗力和恢复力两个方面[6]。土壤生物功能稳定性可以通过抵抗力和恢复力来衡量[2,7,8],抵抗力和恢复力的程度反映了生物功能在染毒过程中的变化[9,10],因此评价土壤的质量和健康程度需要在胁迫状况下的土壤抵抗力和恢复力来把握,从而预测出土壤受到污染等不利因素之后,生态功能能否迅速复原。也就是说,对土壤生态系统稳定性的研究主要围绕土壤微生物群落及其生态学功能对抗胁迫维持不变的能力[1]。
微生物活性在维持土壤生产力可持续性方面起着十分关键的作用,因为土壤中有机质的周转和矿化、养分转化以及有机废弃物的循环等均依赖于土壤微生物的代谢活动[11]。因此,土壤微生物活性可以反映出土壤中微生物的活动及其降解污染物质的能力。微生物活性的具体表现为微生物对有机质矿化所引起的呼吸作用[12]。土壤基础呼吸是在培养期间单位质量土壤平均每天所矿化的有机碳量,反映了土壤生物活性与物质代谢的强度[13]。土壤环境受到胁迫或干扰条件下,微生物为了维持生存可能需要更多的能量,而使土壤微生物的代谢活性发生不同程度的反应[11]。一般认为,重金属污染能引起微生物生物量的下降,而土壤呼吸量的增加则被认为是微生物对逆境的一种反应机理[11]。英国Macaulay牧场土壤的研究发现,随铜(Cu)浓度的升高,微生物呼吸速率迅速上升[14]。郭星亮等研究表明,低剂量Cu能提高微生物群落对聚合物类碳源的转化与利用的能力,高剂量Cu对微生物群落利用中间代谢物和复杂大分子类碳源产生一定的抑制作用[15]。杨元根等研究表明,受Cu污染的早期阶段,土壤微生物呼吸强度升高,微生物代谢熵增大,但土壤对Cu高强度的结合使该效应随时间延长而减弱;Cu胁迫使微生物对碳源的优先利用种类发生转移,碳源消耗量增加,消耗速度变快,且这种损伤效应具有长期性[14]。秦永生、刘振乾[16]研究了Cu和Pb单一污染对土壤呼吸强度的影响,认为其随污染物的浓度和培养时间而变化,DMRT法检验表明,在后期各处理与对照间的呼吸强度都存在显著差异,前期则差异不显著。
许多研究表明[17,18]群落的多样性有利于提高生态系统的稳定性、生产力和可持续性,充分强调了微生物多样性高低对生态系统功能维持的重要作用。除了土壤中微生物对土壤稳定性能产生影响外,土壤自身的物理性质也能发挥一定的作用。Griffiths[19]等采用砂质土壤和粘壤土,研究了土壤质地对于生物稳定性的影响,实验施加Cu胁迫和热胁迫,以土壤诱导呼吸强度为生物稳定性指标。结果显示土壤质地对生物稳定性的影响显著。对此李小方[1]等认为土壤质地的差异导致了土壤一系列理化性质的差异,如粘壤土比表面积大,吸附有机质多,而砂质土壤持水量低,土壤孔隙中氧气含量高,从而造成了生物稳定性的差异。张斌等[21]将高度降解的泥炭作为有机物添加到土壤中,结果发现添加有机物能显著提高机械压实后土壤结构的恢复。这是由于有机质被土壤吸附之后,具有类似于弹簧的作用,能够促进了土壤受到压缩之后的反弹。
虽然越来越多的研究表明微生物多样性的下降是对土壤生态系统的一个严重威胁,对于重金属胁迫下土壤微生物群落的变化取得了一定的进展,也进一步研究了微生物群落与土壤稳定性之间的作用关系,但多集中在某几种重金属对特定酶的作用机理,而对于重金属胁迫机制并不明确,表征指标仍比较混乱未形成统一体系。但由于土壤系统自身的复杂性,还难以定量描述土壤微生物对抗环境胁迫所起的作用,对其中作用机制的理解也还比较模糊。此外,多数研究通过稀释强行降低多样性的方法存在严重缺陷;对于土壤理化因素影响抵抗力和恢复力具有共识,但是对重金属胁迫下土壤的理化性质对土壤抵抗力与恢复力变化影响效果没有给出直观的量化判断。因此本研究将选取全国13种不同区域农业土壤,通过对CO2呼吸速率、土壤理化性质(pH、C/N、土壤粒径、CEC、DOC等)的测定,来描述不同类型土壤对Cu胁迫的抵抗力和恢复力特征,其中,本研究假设土壤抵抗过程与污染物扩散过程有关,恢复过程与污染物老化和微生物生长有关,而污染物扩散过程和老化过程是土壤结构、有机质和pH等影响因素的函数。因此通过测定理化性质等因素对土壤的抵抗力和恢复力的影响,并对显著因子采取数学建模进行量化表征;借助香农指数来分析生物多样性与土壤生物功能稳定性的关系,从而实现土壤质量评价,为土壤污染修复提供全新角度的理论依据。
1 材料与方法
1.1 试验设计
试验采用容量250 mL的白色塑料瓶做培养试验,为了捕获土壤样品的矿化气体,在塑料瓶内放置装有NaOH的小玻璃瓶(见图1)。处理A:土壤样品加Cu胁迫;处理B:土壤样品无胁迫;空白组:无土样无胁迫。
1.2 试验材料
本实验的土壤样品取自我国13个不同农业土壤类型的区域(见图2)取得土样,取样时,除去表层1 cm左右的浮土,采集适量表层0~20 cm深度的洁净泥土。用来测试底物诱导呼吸速率试验的土样风干并过2 mm筛网,其余土壤样品密封好置于冰箱4℃保鲜。
样品采集的地理坐标和土壤类型如表1所示。
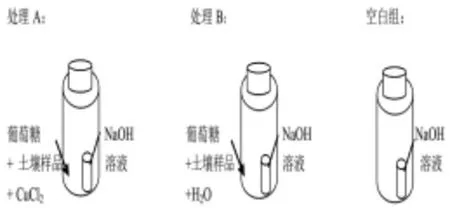
图1 试验设计Fig.1 Design of reactor
图2 土样采集点示意图Fig.2 Map of soil sampling
1.3 测定方法
1.3.1 pH值的测定称取风干土样10 g于50 mL烧杯中,加入25 mL无二氧化碳水,用玻璃棒快速搅动1~2 min后静止30 min。风干土样pH测定,做五个平行,取平均值。
1.3.2 含水率的测定准确称取鲜土样5 g(m1)于锡箔纸,包裹完好后放入105℃烘箱中烘烤12 h,称重得m2,利用公式计算:含水率=(m2-m1)/m1×100%[21]。
1.3.3 离子交换系数CEC试验称取0.500 g的土样,加入0.1 mol/L BaCl220 mL,摇床摇震2 h,250 rpm,然后离心,3000 rpm,离心20 min,上清液0.45µm滤膜过滤,稀释一定倍数,ICP-AES测定Ca,Mg,Na,K,Mn和Fe的浓度,最后通过公式计算CEC[22]。
1.3.4 溶解性有机碳(Dissolved Organic Carbon,简称DOC)测定取10 g新鲜土样,按照土:水为1∶5的比例混匀,在25℃条件下,以250 r/min的速度振荡1 h,接着在转速为15000 r/min离心10 min,上部悬浮液过0.45µm薄滤膜,过滤液用碳自动分析仪来测定(TOC-Vcph,Shimadzu,Japan)。
1.3.5 碳氮比(C/N)测定每个反应装置中各取1.00 g(干重)土壤样品,冷冻干燥12 h,然后研磨,过0.075 mm筛,使用元素分析仪(型号TOC-VWP)测得碳氮比[23]。
1.3.6 底物诱导呼吸速率试验13种土壤分别取12 g,置于塑料瓶中(250 mL)同时将土壤含水率控制在15%。土壤被随机进行二种方式处理:(一)控制,无扰动施加;(二)Cu胁迫,加入CuCl2溶液(Cu量:100 mg/kg干土重),含水率从15%调至18%。然后处理A、B均向装有12 g土壤的瓶中加入30 mg/g葡萄糖。将装有5 mL 0.2 mol/L的NaOH溶液的玻璃瓶放置在250 mL的塑料瓶中,用于捕捉土壤有机质矿化所生成的二氧化碳。塑料瓶密封,并在28℃下培养12 h。塑料瓶从培养箱中取出后,迅速将NaOH液体转移至100 mL三角瓶中,加入2 mL 1 mol/L的BaCl2溶液,再加两滴酚酞,用0.05 mol/L的HCl滴定[24]。每组处理有三个重复,另取3个瓶子不加土壤作为空白。为了便于说明时间,第0 d是当Cu胁迫被应用的时间。分别在加入Cu胁迫后第1,3,15,30和60天进行测定。
取第1、3、15、30、60 d五个时间点为横坐标,对各时间点的数据通过式1进行处理,并取其为纵坐标(见表3),描绘恢复曲线。土壤抵抗力、恢复力以及稳定性计算:

式中,f(t)为土壤抵抗力/恢复力。其中,f(1)反应土壤抵抗力,f(1)越大,土壤的抵抗力越强;f(60)反应土壤恢复力,f(60)越大,土壤恢复力越强;
CO2-stressed(t)为试验组第td的CO2的浓度;
CO2-control(t)为对照组第td的CO2的浓度;
Sb为土壤稳定性,Sb越大,土壤稳定性越强。
1.3.7 香农-威纳指数(Shannon Index)测定香农-威纳指数(简称香农指数),H=样品的信息含量(彼得/个体)=群落的多样性指数,在个体分配越均匀,H值就越大。计算公式:

式中,Sobs=测试样的个数;
ni=第i种的个体数目;
N=群落中所有种的个体总数。
1.3.8 相关性分析为了探讨土壤理化性质对农业土壤的抵抗力、恢复力和稳定性的影响性,数据采用SPSS19.0软件中的Pearson、显著性(双侧)进行相关性分析。
Pearson相关系数—R:用来衡量两个数据集合是否在一条线上面,衡量定距变量间的线性关系。
显著性(双侧)—P:用来体现显著性分布概率,其中,0.01>P>0.05表示差异性显著;P>0.01表示差异性极显著。
2 结果与讨论
2.1 土壤理化性质
土壤理化因素构成了土壤生物的生存环境,理化因素的变化势必会影响到土壤生物群落的稳定性[25,26]。为了研究土壤理化性质对于土壤生物功能稳定性的影响,故本研究对来自全国13种不同类型的土样进行了理化性质的测定,具体结果见表1。
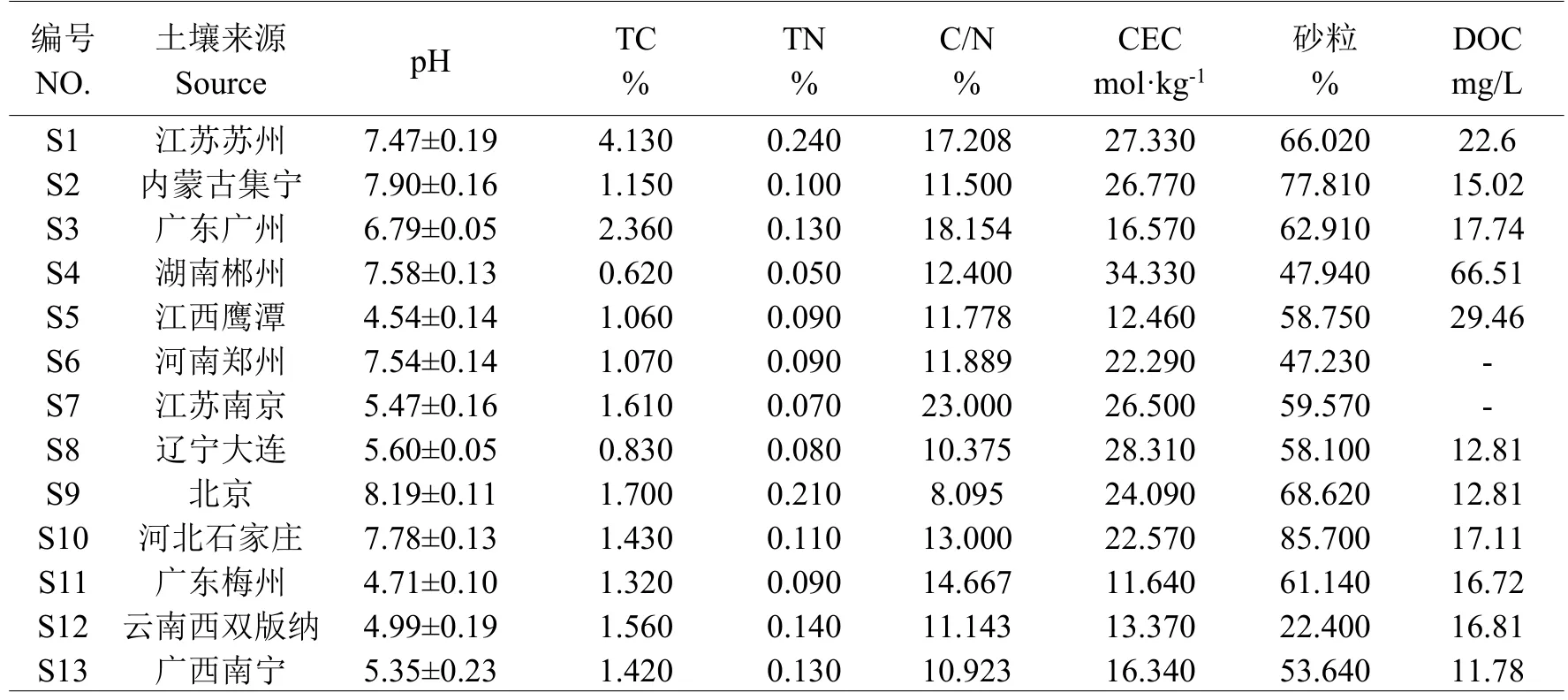
表1 不同土壤的理化性质Table 1 Physic-chemical properties of soil samples
2.1.1 pH根据土壤酸碱度等级划分标准(http://www.tdzyw.com/2010/0726/1007.html),本研究共选用了酸碱度不同的13种土样,本研究所测得的不同农业土样pH范围为4.54~8.19(详见表1),其中,对这些土样的酸碱度进行划分见表2。

表2 土壤的酸碱度划分Table 2 Division of soil pH
2.1.2 土壤粒径—砂粒百分比根据国际制土壤粒径分级标准(http://www.cqates.com/cqsoil/gjztrzdfjbz.htm),本研究所选用的13种土样,其砂粒百分比保持在22.40%~85.70%之间,范围广泛,具有一定代表性,而13种土壤的砂粒百分比平均值约为59.22%。
2.1.3 CEC土壤阳离子交换量是影响土壤缓冲能力高低,也是评价土壤保肥能力、改良土壤和合理施肥的重要依据[27]。测定结果的区间为11.64~34.33,其最大与最小值分别对应S4和S11。
2.1.4 C/N土壤有机质占土壤固相百分之几[28],微生物量和一些土壤酶活性与土壤有机碳的含量呈正相关[29],生物活性越强,抵抗力和恢复力越强。本研究中的13种土样的C/N保持在8.095~23.000之间,最大值和最小值分别对应S7和S9。
2.1.5 DOC DOC的含量越高,土壤中的有机质含量就越高,因而微生物活性越高,恢复力和抵抗力也越高,生态系统稳定。本实验所测定的13种土壤样品的DOC如表3所示,测定范围为11.78~66.51 mg/L。
2.2 香农指数
香农指数包含两个成分:①种数;②各种间个体分配的均匀性。香农指数越高,指示群落多样性越好,个体分配越均匀,而Cu胁迫能够改变土壤微生物的种密度和均匀度,从而影响微生物群落结构。本研究中由于土样S7和S8在测定香农指数的过程中误差较大,故选取除此之外的11种农业土样作数据分析。实验过程为了阐明Cu胁迫对微生物群落的影响,因此将第0 d与第60 d的香农指数进行对比(见表3),发现未受污染的农业土壤加入Cu胁迫后,大多数土壤样品的香农指数降低,表明土壤微生物的种密度和均匀度有所下降,而S13的香农指数上升幅度较大,但其恢复力及稳定性都较弱,不排除该土壤被污染的可能性。另外,S1、S5、S6恢复曲线的波动范围(见图3)受Cu胁迫的影响较大,这也支持了研究结论—Cu胁迫可以降低微生物活性和微生物群落多样性。

表3 不同区域土样的第0 d和第60 d的香农指数Table 3 Shannon Index of soil samples in different locations at the 0 d and 60 d
2.3 土壤微生物抵抗力与恢复力及其功能稳定性
为进一步研究不同土壤类型下的微生物抵抗力与恢复力的差异性,我们通过土壤中微生物呼吸量计算得出抵抗力/恢复力f(t),如图3所示,在加Cu胁迫的情况下,在土壤S1、S4、S5、S6、S7、S8、S1、S13中f(t)是呈现先下降后上升的趋势,而S2、S3、S9、S10、S11中f(t)则呈下降趋势,这说明大部分地区的土壤在经历Cu胁迫后能够自我恢复。而S3、S10、S11是呈完全地递减趋势,表明S3、S10、S11三个地区的土壤恢复力较差,受Cu胁迫后这些区域中的微生物自我修复能力较差。上述结果表明,不同土壤之间的抵抗力与恢复力存在差异(见表4),其中S1、S10、S13的抵抗力相对较好,S12的抵抗力最差;S1、S6、S8恢复力相对较好,S10的恢复力最差。Griffiths等[19]以Cu胁迫作为模式干扰,无论是污染还是未污染土壤第1 d的抵抗力最低,但是污染土壤的恢复力明显高于未污染土壤。这说明影响测定土样恢复力大小的一个因素是无法对所取的不同区域的土壤进行污染程度的自然统一,若要保持统一性,只能通过人工添加毒性的方法,但这不符合本研究的初始目的。其中图3的面积(即恢复曲线与横坐标围成的面积)表示为土壤的稳定性,面积越大,即表示稳定性越强,从稳定性上进行比较,S1的稳定性比较好,加入Cu胁迫前后的影响并不是特别明显;而S3、S7、S9、S10四种土样稳定性比较差。

表4 不同区域土壤的抵抗力与恢复力以及稳定性Table 4 Resistance and resilience with different types of soil and its stability
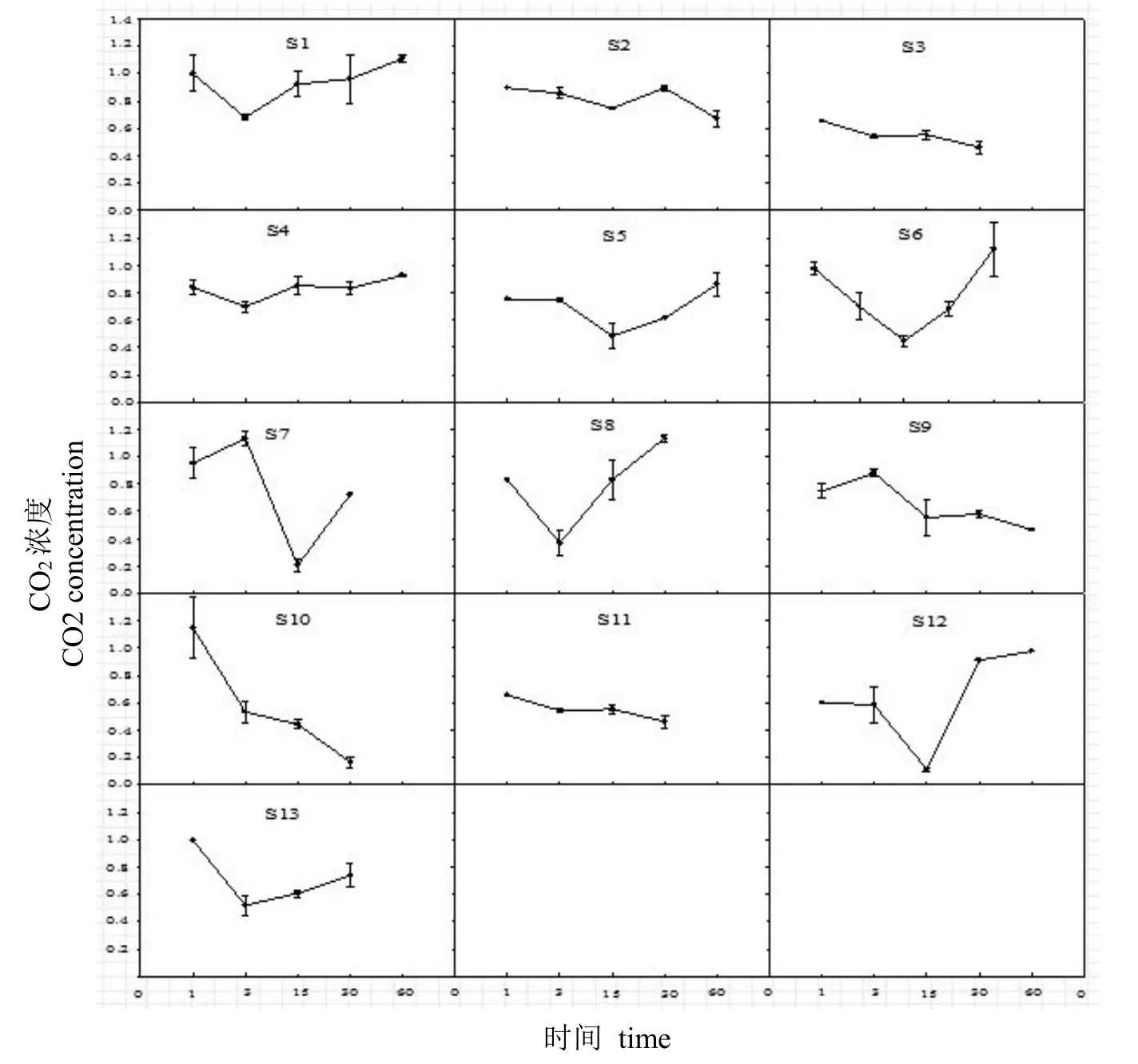
图3 不同区域土壤的恢复曲线Fig.3 Recovery curves of soil samples in different locations
2.4 基础理化性质与土壤微生物抵抗力、恢复力的相关性分析
为寻找影响土壤微生物抵抗力、恢复力的关键因子,我们对来自全国13种不同类型的土壤选取了5种理化性质,包括pH、砂粒百分比、CEC、C/N、DOC进行测定,数据结果见表1,并对这些因素与抵抗力、恢复力进行了相关性分析,具体结果见表5和表6。
根据相关性分析结果所示(表5),pH与抵抗力、恢复力、稳定性的相关系数分别为0.422、-0.278、0.039,表明pH与抵抗力有正低度相关性,与恢复力和稳定性不相关。对于pH,与抵抗力、恢复力、稳定性的相关性分析中,显著性P分别为0.151、0.357、0.9,设置显著性P为0.05,说明pH与三者均未通过显著性检验,与其没有显著相关性。而Bltton[30]的研究表明,pH值为3.0和3.7的酸性水对土壤微生物活性基本没任何影响,而在Furthermore等人的报道中也指出除pH值小于2.0的情况外,其他酸性处理的土壤并不降低土壤中酶的活性[32]。这些研究均表达了pH与土壤生物呼吸无直接相关性,与研究结论一致。
砂粒百分比与抵抗力、恢复力、稳定性的的相关系数R分别为0.496、-0.621*、-0.274,表明砂粒百分比与抵抗力低度相关,与恢复力中度相关,与稳定性不相关。其中,砂粒百分比与恢复力的相关系数为-0.621,说明两者之间的负相关关系,砂粒百分比越高,土壤应对Cu胁迫所体现的恢复力越弱。对于砂粒百分比,其与抵抗力、恢复力、稳定性三者的显著性P值分别为0.085、0.023、0.366,说明砂粒百分比与土壤对Cu胁迫的恢复力满足显著相关(P=0.023)。这一结果可以解释为,由于砂粒通透性好,但缺乏粘粒(无机胶体)和OM(有机质胶体),保水肥能力差、堆放空隙最大,矿质养分含量低[31],所以砂土通透性好,排水能力强,微生物呼吸快,砂质土有利于好气性微生物的活动,OM分解快,肥效快[32],前劲大后劲不足。此外,好氧微生物是在氧气充足的环境中才能正常生长的一类微生物,由于这些微生物呼吸作用的最终电子受体是氧,所以缺氧时便停止生长,但通常不死亡,这一特性导致土壤收到Cu胁迫的干扰后,微生物生长速度降低,无法对干扰进行正常快速的反应和继续维持生态系统稳定性的行为,恢复力减弱。
CEC与抵抗力、恢复力、稳定性的相关系数R值分别为0.465、0.165、0.307,表明CEC与其相关关系分别为中度相关、不相关、低度相关。此外,CEC与抵抗力的显著性也是偏高的(P值为0.109),说明两者之间的中度正相关关系是较为显著的。这一结论也是有依据的,不同土壤的阳离子交换量不同,CEC受土壤质地影响,质地越细,其阳离子交换量越高,且另有研究表明,土壤的基础呼吸与阳离子交换量呈显著正相关关系[31]。
C/N与抵抗力、恢复力、稳定性的相关系数分别为0.103、-0.022、-0.1,说明C/N与抵抗力、恢复力、稳定性均为不相关关系。有研究表明土壤的基础呼吸与C/N呈负相关关系[31],据王利利[33]报道,有机质的C/N过高会降低土壤微生物的活性(C/N为20:1时过高);而C/N较低时,土壤微生物量低,土壤活性差,不利于氮素被微生物同化利用,C/N比越低,加速了土壤原有有机碳的分解,导致土壤有机质含量减少。而胡玮[34]等人的研究表明C/N为12.5:1的土壤微生物活性较大,过高或过低微生物活性差,土壤抵抗力弱。故本研究数据分析获得的C/N和抵抗力、恢复力、稳定性均不相关的结果可以理解为取样土壤的C/N大部分低于土壤微生物最适宜的C/N所造成。
DOC的浓度与抵抗力和恢复力的相关系数R(见表6)分别为0.253、-0.060,说明DOC与两者均不相关,而与稳定性的R值为0.364,属于低度相关。尽管DOC浓度与稳定性之间的相关性并不大,也不具有较高的显著性(P=0.253),但是由于DOC受外界条件影响较大,同时与土壤的质地之间的差别也有很大的关系,所以我们也认为DOC的浓度与土壤的稳定性有正相关关系,这主要是因为有研究表明DOC与有机碳总量、全氮、全磷、碱解氮、有效磷和速效钾等养分因子之间呈正相关关系[35]。此外也有研究证实土壤微生物量碳、氮会随土壤有机质含量的增加而增加,而土壤过氧化氢酶、土壤转化酶的活性也会随土壤有机质含量的增加而增加[36],酶活性的增加有利于促进增强土壤生物活性,土壤生态系统稳定性的上升。
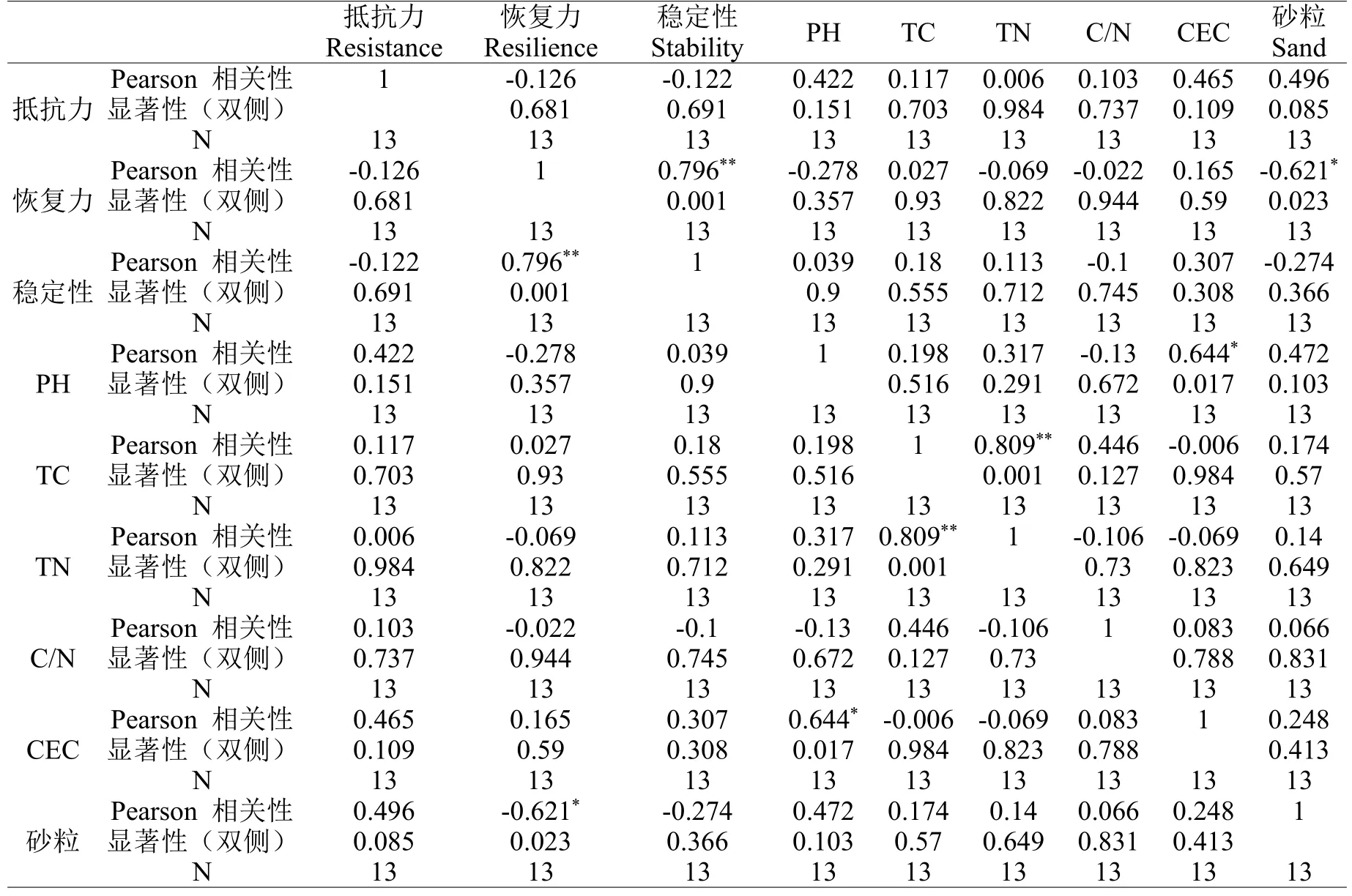
表5 相关性分析(除DOC外)Table 5 Correlation analysis(The exception of DOC)
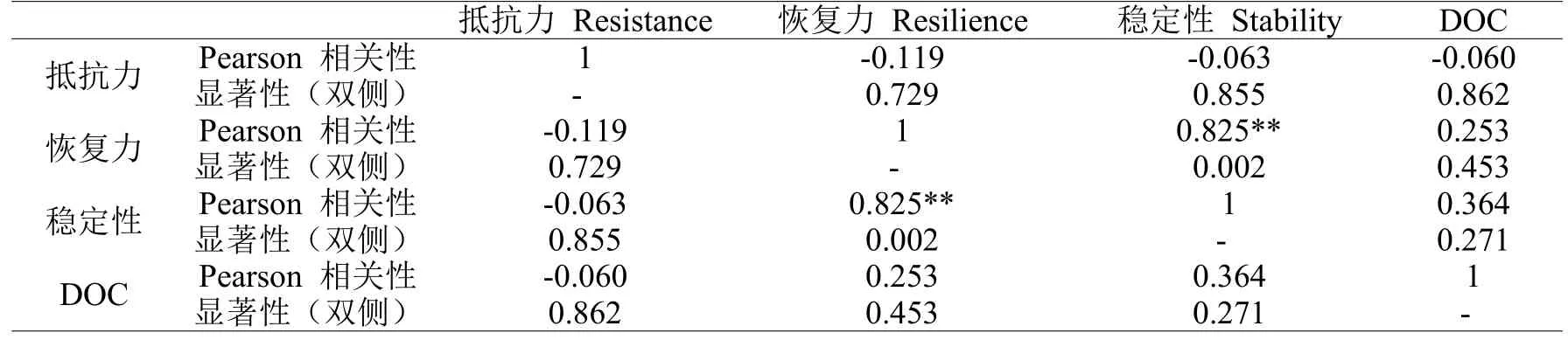
表6 DOC与土壤抵抗力、恢复力与稳定性的相关性Table 6 The correlation between DOC and soil resistance/resilience/stability
2.5 回归模型构建
由相关性分析证明,砂粒百分比与土壤微生物对Cu胁迫的恢复力呈显著性负相关。为了能对这组关系进行深入探讨,我们将这对关系借助软件Origin 8.0进行回归模型的构建,从而实现对其进行量化表征。经过不同线型的回归模型比对(见表7),结果发现砂粒百分比与恢复力之间以指数关系拟合效果最好,指数方程为y=259.42e-0.022x,模型可决系数R2=0.6468。

表7 砂粒百分比与恢复力的建模Table 7 The model between the sand percentage and soil resilience
为了评估砂粒百分比在整个模型中的相对重要性,我们对参数进行了敏感性分析。选用13种土壤的砂粒百分比平均值59.22%为初始值,将其进行±20%的数值波动,而参数的累积效应将通过恢复力的变化值表示出来。
对于参数P的敏感系数S可以计算如式4:
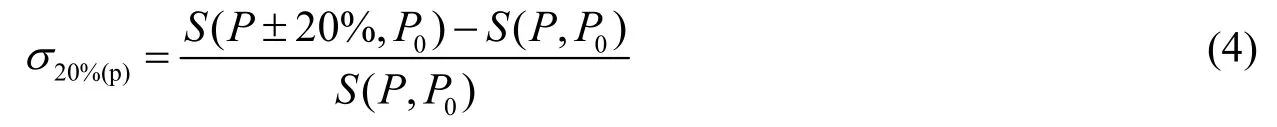
其中并且S(P,P0)表示与参数P相关的模拟变量S。我们对恢复力的动态变化对于砂粒百分比的敏感性进行了研究。若对砂粒百分比数值上下浮动20%,可得到其敏感系数为0.0026。
3 结论
本研究采集了来自全国13个地区不同类型的农业土壤,分别测定了他们的CO2呼吸速率、理化性质(pH、砂粒百分比、CEC、C/N、DOC)以及香农指数。研究表明,在加Cu胁迫的情况下,香农指数表明,Cu胁迫能够减少土壤微生物的种群密度和均匀度,改变微生物群落结构,降低微生物活动,降低生物群落多样性。此外Cu胁迫使不同土壤类型中微生物抵抗力、恢复力存在先降低后增加的趋势或者呈完全下降的趋势(见图3),表明土壤受到Cu胁迫后总会出现功能稳定性下降的现象,但对于自身生态系统稳定性好的土壤,会恢复Cu胁迫带来的毒性危害。理化性质与生物功能稳定性的关系通过相关性的回归分析得到:pH与抵抗力有正低度相关性,与恢复力和稳定性不相关;CEC与抵抗力之间的关系为正相关;C/N与抵抗力、恢复力、稳定性均为不相关关系;DOC的浓度与抵抗力和恢复力不相关,与稳定性的低度相关;砂粒百分比与土壤对Cu胁迫的恢复力呈指数下降关系,指数方程为y=259.42e-0.022x,模型拟合误差R2=0.6468,表明砂粒百分比越高,土壤应对Cu胁迫所体现的恢复力越弱。
由于土壤属性受地域性影响较大,为了所得结论更具代表性和规律性,还需要收集更多不同地域中的土壤样品进行分析和论证。另外,目前还有许多比较崭新的课题尚处于初步的研究阶段,对于例如土壤微生物重金属、有机污染胁迫的根际效应,土壤微生物重金属、有机污染胁迫的离子效应等问题的研究还需要后续试验来验证。
[1]李小方,邓欢,黄益宗,等.土壤生态系统稳定性研究进展[J].生态学报,2009,29(12):6712-6722
[2]Seybold CA,Herrick JE,Brejda JJ.Soil resilience:a foundamental component of soil quality[J].Soil Science,1999,164(4):224-234
[3]Jirsa VK,Ding MZ.Will a large complex systems with time delays be stable?[J].Physical Review Letters,2004,93:1–4
[4]May RM.Will a large complex systems be stable?[J].Nature,1972,238(5364):413-414
[5]Holt RD.Ecology-Asymmetry and stability[J].Nature,2006,442(7100):252-253
[6]McCann KS.The diversity-stability debate[J].Nature,2000,405(6788):228-233
[7]Griffiths BS,Bitz K,Wheatley R,et al.An examination of the biodiversity-ecosystem founction ralationship in arable soil microbial communities[J].Soil Biology&Biochemistry,2001,33(12-13):1713-1722
[8]Holling CS.Resilience and stability of ecological systems[J].Annual Review of Ecological Systems,1973,4:1-23
[9]Kuan HL,Fenwick C,Glover LA,et al.Founctional resilience of microbial from perturbed upland grassland soils to further persistent or tansient stresses[J].Soil Biology&Biochemistry,2001,33(4-5):533-551
[10]Renella G,Chaudri AM,Brookes PC.Fresh additions of heavy metals do not model long-term effects on microbial biomass and activity[J].Soil Biology&Biochemistry,2002,34(1):121-124
[11]王建坤.铅锌污染对土壤微生物多样性的影响[D].四川:四川农业大学,2009
[12]李晨华,李彦,谢静霞,等.荒漠-绿洲土壤微生物群落组成与其活性对比[J].生态学报,2007,27(8):3391-3399
[13]崔骁勇,陈佐忠,陈四清.草地土壤呼吸研究进展[J].生态学报,2001,21(2):315-322
[14]杨元根,Paterson E,Campbell C.重金属Cu的土壤微生物毒性研究[J].土壤通报,2002,33(2):137-141
[15]郭星亮,谷洁,高华,等.重金属Cu对堆肥过程中微生物群落代谢和水解酶活性的影响[J].农业环境科学学报,2011,30(2):375-382
[16]Roane TM,Pepper IL.Microbial responses to environmentally toxic[J].Microbial Ecol,1999,38(4):358-364
[17]Giller K,Bignell D,Lavelle P,et al.Solid Biodiversity in rapidly changing tropical landscapes:scaling up and scaling down//Bardgett RD,Usher MB,Hopkins DW.Biological Diversity and function of soil[C].Cambridge: Cambridge University Press,2005
[18]Griffiths BS,Bonkowski M,Roy J,et al.Functional stability,substrate utilization and biological indicators of soils following environmental impacts[J].Applied Soil Eco logy,2001,16(1):49-61
[19]Griffiths BS,Hallett PD,Kuan HL,et al.Functional resilience of soil microbial communities depends on both soil structure and microbial community composition[J].Biology and Fertility of Soils,2008,44(5):745-754
[20]彭新华,张斌,赵其国.土壤有机碳库与土壤结构稳定性关系的研究进展[J].土壤学报,2004,41(4):618-624
[21]林大仪.土壤学实验指导[M].北京:中国林业出版社,2004
[22]WILLIAM H,HENDERSHOT,MARTIN DUQUETTE.A Sample Barium Method For Determining Cation Exchange Capacity And Exchangeable Cations[J].Soil Sci Soc Am J.1986,50:605-608
[23]张威,刘宁,李慧捷,等.TruSpec CN元素分析仪测定土壤中碳氮方法研究[J].分析仪器,2009(3):46-48
[24]Bekku Y,Koizumi H,Oikawa T,et al.Examination of four methods for measuring soil respiration[J].Applied Soil Ecology,1997(5):247-254
[25]Johnston MD,Brown MH.An investigation into the changed physiological state of vibril bacteria as a survival mechanism inresponse to cold temperatures and studies on their sensitivity to heating and freezing[J].John of Applied Microbiology,2002,92(6):1066-1067
[26]Nikerson CA,Ott CM,Wilson JW,et al.low-shear modeled microgravity:a global environmental regulatory signal affecting bacterial gene expressing,physiology and pathogenesis[J].Journal of Microbiology,2012,18(2):81-85
[27]李天杰,赵烨,张科利,等.土壤地理学[M].北京:高等教育出版社,2009
[28]巴奇,李科,姬洪刚,等.土壤中有机碳和氮素的变化过程研究概况[J].环境保护与经济循环,2008,3(11):49-51
[29]梁启新,康轩,黄景,等.保护性耕作方式对土壤碳、氮及氮素矿化菌的影响研究[J].广西农业科学,2010:47-51
[30]黎宁,李华兴,朱凤娇,等.菜园土壤微生物生态特征与土壤理化性质的关系[J].应用生态学报,2006,17(2):285-290
[31]夏冬明.土壤肥料学[M].上海:上海交通大学出版社,2007
[32]赵义涛.土壤肥料学[M].北京:化学工业出版社,2009
[33]王利利,董民,张璐,等.不同碳氮比有机肥有机农业土壤微生物生物量的影响[J].中国生态学报,2013,21(9):1073-1077
[34]胡玮,李桂花,任意,等.不同碳氮比有机肥组合对低肥力土壤小麦生物量和部分土壤肥力因素的影响[J].中国土壤与肥料,2011(2):22-27
[35]李淑芬,俞元春,何晟.土壤有机碳的研究进展[J].土壤与环境,2002,11(4):422-429
[36]隋跃宇,焦晓光,高崇生,等.土壤有机质含量与土壤微生物量及土壤酶活性关系的研究[J].土壤通报,2009,10(5):1036-1039
Influence Factors of Ecological Function Stability of Soil and Their Correlation
CHEN Xin-yao,CHEN Qiu-jian,LI Min,NIU Xiao-cong,ZHOU Yang,ZHAO Qiao,ZHANG Yuan*
School of Environmental Science and Engineering/Suzhou University of Science and Technology,Suzhou215009,China
The research takes 13 kinds of representative agricultural soil samples from the national scale to measure the respiration rate of CO2and key physic-chemical parameters and analyze Shannon Index so as to describe the interaction between the properties of different soil types with soil stability to exploit the predominant factors that influence the soil resistance/resilience/stability in order to predict soil ability assessment.The results showed that after adding Cu perturbation, the curve of f(t)decreased firstly followed by an increase or completely decreasing,indicating that the soil would be emerging a decline of biological functional stability,but for the soil that have a good ecosystem stability would recover the toxicity caused by Cu perturbation.The relationship between physic-chemical properties and biological functional stability obtained by regression analysis.According to this research,pH have a low correlation with resistance,while irrelevant with the resilience and stability;there is a positive correlation between the CEC and the resistance;C/N and resistance/resilience/ stability were not correlated;the concentration of DOC are uncorrelated with the resistance and resilience,and have a low correlation with stability;the sand percentage had a proportional relationship with the resilience through correlation regression analysis,exponential equation:y=259.42e-0.022x,R²=0.6468.The Shannon Index indicated that the Cu perturbation decreased the soil microorganisms’abundance and equability by changing the microbial community structure and reducing microbial activity and community diversity.
Soil property;soil organism;resistance;resilience
R135.11
:A
:1000-2324(2015)06-0838-9
2015-03-17
:2015-04-13
江苏省环境科学与工程重点专业类建设项目资助:土壤功能抵抗力与恢复力建模及影响因素敏感性分析(13KJB610014);环境中重金属铅污染的儿童健康风险评价(Zd131201)
陈欣瑶(1995-),女,本科.E-mail:18896584296@163.com
*通讯作者:Author for correspondence.E-mail:yuanzhang_1001@mail.usts.edu.cn

