低压电刺激对不同部位宰后牦牛肉肌原纤维蛋白水解的影响
贾 青,余群力,*,田 园,孙志昶,李洪波
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃陇原中天生物工程股份有限公司,甘肃陇西 748100)
低压电刺激对不同部位宰后牦牛肉肌原纤维蛋白水解的影响
贾 青1,余群力1,*,田 园1,孙志昶1,李洪波2
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃陇原中天生物工程股份有限公司,甘肃陇西 748100)
研究电刺激对不同部位牦牛肉宰后成熟过程中微观结构及肌原纤维蛋白水解的影响。将牦牛宰后5min内进行低压电刺激(21V,50Hz,90s)并冷却排酸,于宰后0、1、3、5d取前部肱三头肌(TB)中部背最长肌(ML)和后部半膜肌(SM),分析其肌节长度、肌纤维直径、MFI指数、肌原纤维超微结构和全肌肉蛋白电泳图谱。结果表明:电刺激使不同部位牦牛肉肌节长度显著变化(p<0.05),肌纤维直径平均缩小6%、5%和9%;TB、ML和SM宰后0~5d MFI值分别上升54%、55%和92%,SM嫩度显著增大(p<0.01);不同部位牦牛肉肌原纤维超微结构中挛缩带占有率分别为23.9%、26.3%和31.2%,肌原纤维结构形变溶解;SDS-PAGE电泳图谱显示,TB、ML和SM部肌原纤维蛋白均在48~75ku之间降解彻底。本研究证实了电刺激缩短牦牛肉宰后成熟时间,对不同部位牦牛肉嫩度改善,特别是对肉质较差的SM效果显著。
牦牛,电刺激,宰后成熟,肌原纤维蛋白
牦牛(yak)生长在我国冷季长、氧气稀薄、工业污染少的草原环境中,其肉质具有高蛋白、血红蛋白含量高,抗病力强的特点。青海牦牛肉热能值平均高达9612.45kJ/kg,比其他牛肉高2400~4000kJ[1],对增强人体抗病力、细胞活力和器官功能均有显著作用,是具有市场潜力的优质天然绿色食品。但是牦牛肉嫩度较普通黄牛肉差[2],其肌纤维较粗,在冷藏过程中易发生收缩现象,极大影响肉质嫩度和口感,制约其内销与出口。因此对牦牛肉嫩化是生产中的关键技术因素。
低压电刺激能够改变肉质微观结构[3],使肌节收缩、肌原纤维直径变小、肌原纤维小片化程度增大,并且加快内源酶对肌原纤维蛋白的水解[4],缩短宰后牦牛肉冷却排酸时间,改善嫩度、肉色,提升品质,降低生产成本。
早在1960年,Locher发现肉牛屠宰后胴体快速冷却导致肌肉过度收缩,肌节缩短、肌纤维直径增加导致肉质韧化[5],同时有研究发现,肉的嫩化过程中常伴随着少量蛋白质的降解发生。我国学者张先峰[6]等在电刺激与延迟冷却对牛肉肌原纤维超微结构的影响中发现,电刺激产生挛缩带,使肌原纤维微观结构变化,进一步证实了肉在宰后成熟期间嫩度改善的原因;孙清亮[7]等在电刺激和延迟冷却对宰后牛肉肌原纤维蛋白降解的影响中发现,电刺激显著加快肌钙蛋白-T的降解,缩短宰后牛肉成熟时间。但是对于牦牛肉,不同部位肉电刺激后微观结构特征和全蛋白质降解分析的报道较少。
基于此,本实验研究低压电刺激处理对不同部位牦牛肉的肌节长度、肌纤维直径,MFI指数等微观结构特征的影响,并分析全蛋白质电泳图谱,探寻不同部位牦牛肉嫩化的内在机制,以期为中国牦牛肉不同部位品质改良、肉质分级加工提供更多理论依据。
1 材料与方法
1.1 材料与设备
实验用牛 选自青海省海晏县夏华清真肉食品有限公司,随机选取9头健康的2~4岁牦牛,体重(110±20)kg,宰前禁食禁水;丙烯酰胺(Acr)、SDS(十二烷基磺酸钠)、Tris-HCl缓冲液,过硫酸铵、EMED(四甲基乙二胺)、甘油、溴酚蓝、浓缩电极缓冲液、甘氨酸、考马斯亮蓝R250、乙醇、冰醋酸、脱色液 以上试剂均为分析纯。
ES-4型电刺激仪 美国查韦斯机械制造有限公司;SCR20BC型高速冷冻离心机 日本日立公司;双垂直CYCZ型电泳仪 北京市六一仪器厂;FA2004B型电子天平 上海佑科仪器厂;JSM561OLV型高分辨率扫描电镜仪 日本艾克赛普电子公司。
1.2 实验设计
随机选取9头自然放养青海牦牛,年龄2~4岁,活体重(110±20)kg,按照伊斯兰方式屠宰,在刺杀放血后5min内对牦牛胴体进行电刺激(电压21V,频率50Hz,时间90s),后置于0~4℃、风速0.5m/s条件下成熟排酸。
在宰后成熟过程中第0、1、3、5d分别取牦牛前部驱肱三头肌(TB)、中部背最长肌(ML)和后部驱半膜肌(SM)测定肌节长度、肌纤维直径、MFI指数,用电镜仪分析其超微结构,分析SDS-PAGE全蛋白图谱。
1.3 测定指标及方法
1.3.1 肌节长度和肌纤维直径测定方法 肌节长度:取不同部位肉样,冷冻切片,沿肌纤维方向切成约为3mm3方块,立即置于3%戊二醛磷酸缓冲溶液中固定保存24h以上,以备电镜分析,根据电镜照片与实物比例计算肌节长度。
肌纤维直径:取不同部位肉样约为1cm×1cm×3cm,于10%甲醛溶液中固定48h,剥离肌纤维,每个样重复3次,在10×40倍显微镜下,每个肉样重复随机计数100根肌纤维直径,求其平均值[8]。
1.3.2 肌原纤维MFI指数测定方法 称取不同部位肉样2g左右,绞碎,用20mL MFI缓冲液(100mmol/L KCl、20mmol/L K3PO4、1mmol/L EDTA、1mmol/L MgCl2、1mmol/L NaN3),pH7.0[9],均质,于1000×g条件下离心15min,弃上清液,沉淀中再加入与以上等体积的MFI缓冲液均质摇匀,再于1000×g条件下离心15min,弃上清液。沉淀用5mL MFI缓冲液搅匀,用200目筛网过滤该悬浊液,另用5mL缓冲液洗涤滤渣。过滤所得滤液用双缩脲法测定其蛋白含量,用MFI缓冲液将其浓度稀释到0.5mg/mL,于540nm 处测定吸光度,将D540值乘以200,即为肌原纤维MFI指数。
1.3.3 肌原纤维超微结构测定 取不同部位肉样约为2mm×1mm×1mm,4℃中3%戊二醛溶液中预固定48h以上。0.1mol/L磷酸缓冲液漂洗二次后,放入1%锇酸中进行固定2h,乙醇进行梯度脱水(50%、70%、80%、90%、100%),100%乙醇反复脱水3次后,用Epon812环氧树脂包埋聚合[10],再于实体显微镜下修整,切成超薄片,2%醋酸双氧铀6.18%柠檬酸铅染色后,于电子显微镜下观察肌原纤维超微结构。
1.3.4 全肌肉蛋白SDS-PAGE电泳分析 称取宰后不同部位肉样0.4g(去除筋腱和结缔组织),加入4mL SDS-PBS提取缓冲液(2% SDS,10mmol/mL Na3PO4,pH7.0),研碎,8000r/min离心5min,取上清液1mL,过滤后用双缩脲法测定蛋白浓度,沉淀用2mL SDS-PBS溶解,待用。分离胶浓度为12.5%,浓缩胶浓度为5%。用双缩脲法调整蛋白浓度,取待测蛋白质和5×样品缓冲(60mmol/L Tris-HCl,25%甘油,14.4mmol/L 2-巯基乙醇,0.1%溴酚兰,pH6.8)以4∶1混合,沸水中煮5min。上样量20μL。电泳电压:浓缩胶为75V,分离胶为110V,时间约4h[11-12]。
1.4 数据处理
以上每个处理重复3次,用Microsoft Excel 2003进行数据统计分析,采用SPSS19.0 统计软件用Duncan法对所有数据进行显著性分析(p<0.01)。
2 结果与分析
2.1 电刺激对不同部位牦牛肉肌节长度和肌纤维直径的影响
2.1.1 对肌节长度的影响 图1是电刺激后不同部位牦牛肉肌节长度变化趋势。TB宰后0d肌节长度2.02μm,为三个部位中最大值,表明TB嫩度最佳。三个部位的肌节长度宰后0、1d差异不显著(p>0.05),但从同一部位看,TB肌节长度相比宰后0d收缩极显著(p<0.01),其长度缩短40%,SM肌节长度相比宰后0d收缩极显著(p<0.01),缩短26%。宰后3d,TB与ML肌节长度相比,差异不显著(p>0.05),但与SM相比TB、ML变化显著(p<0.05),且SM宰后1d到3d,其肌节长度上升12%。随着牦牛肉成熟时间延长,宰后5d,不同部位牦牛肉肌节长度有所恢复,TB、ML肌节长度相对宰后3d变化显著(p<0.05),分别上升30%和20%,SM变化不显著(p>0.05),其长度仅恢复2%。此图表明电刺激在短时间内显著改变不同部位牦牛肉肌节长度。

图1 电刺激对成熟过程中不同部位牦牛肉肌节长度的影响Fig.1 The sarcomere length in different part ofyak meat during postmortem aging
注:小写字母表示同一部位牦牛肉在不同成熟时段的差异显著性,大写字母表示不同部位牦牛肉在同一成熟时段的差异显著性,相邻字母 (例AB、ab)表示差异显著(p<0.05),相隔字母(例AC、ac)表示差异极显著(p<0.01),图2、图3同。
2.1.2 对肌纤维直径的影响 图2所示,不同部位牦牛肉肌纤维直径总体趋势是随着成熟时间延长而减小。宰后0d,肌纤维直径最大的是SM,为61.05μm,其为牦牛运动部位,因此肌纤维较长,肉质较硬。宰后1d相比宰后0d,TB肌纤维直径显著变大(p<0.05),上升5%,ML、SM肌纤维直径显著变小(p<0.05),分别缩小2%和12%。宰后3d,与ML相比TB、SM肌纤维直径差异显著(p<0.05)。宰后5d,TB、ML、SM肌纤维直径相比宰后3d显著减小(p<0.05),分别下降13%、8%和2%。此图表明TB嫩度最佳,肌纤维直径缩小力度最大,同时证明电刺激使嫩度较差的SM改善,宰后0~5d肌纤维直径缩小14%。
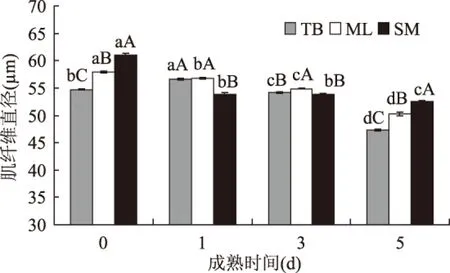
图2 电刺激对成熟过程中不同部位牦牛肉肌纤维直径的影响Fig.2 The muscle fiber diameter in different partof yak meat during postmortem aging
2.2 电刺激对不同部位牦牛肉MFI程度的影响
图3表明,电刺激后随着成熟时间延长,不同部位牦牛肉MFI值呈上升趋势。宰后0d,不同部位牦牛肉MFI有显著差异,其中SM与TB差异极显著(p<0.01),其中嫩度较差的SM MFI值为43.64。宰后1d,TB的MFI值显著变化(p<0.05),上升21%,相比宰后0d,SM的MFI值变化显著(p<0.05),其值上升36%,SM、ML的MFI值相近(p>0.05),这表明电刺激明显缩短嫩度较差SM的小片化时间。宰后3d,TB的MFI值相比宰后1d,显著变化(p<0.05),上升12%。宰后5d,MFI值最大的是TB,相比宰后3d上升13%,SM与ML的MFI值分别上升7%和11%,此时两者小片化程度接近(p>0.05),在整个过程中,TB、ML和SM的MFI值分别上升54%、55%和92%,这说明电刺激明显加快嫩度较差SM的嫩化程度。
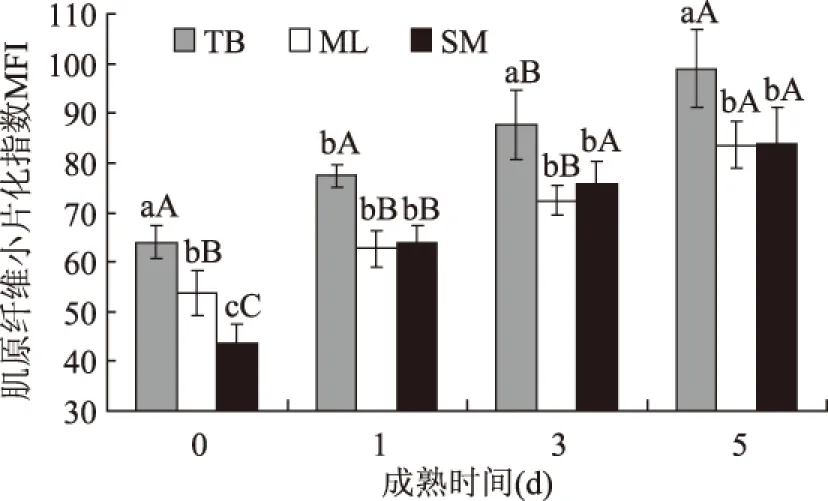
图3 电刺激对成熟过程中不同部位牦牛肉肌原纤维MFI指数的影响Fig.3 Myofbrils fragment index(MFI)in yak during postmortem aging
2.3 电刺激对不同部位牦牛肉肌原纤维超微结构的影响
由图4可知,经过电刺激处理,TB、ML和SM肌原纤维超微结构都发生了显著变化。宰后0d,不同部位牦牛肉肌原纤维结构完整,尤其TB的Z线清晰可见(图4A-TB.0d),TB、ML和SM肌原纤维间连接紧实平滑(图4A组)。宰后1d,不同部位牦牛肉肌纤维结构都有不同程度形变,ML肌原纤维之间缝隙变大(图4B ML.1d),SM肌原纤维框架还未被完全破坏,M线基本保持完好(图4B SM.1d),相比其他部位肌原纤维解体稍显滞后。宰后3d不同部位牦牛肉肌原纤维结构继续解体(图4C),并从电镜中看到挛缩带(图4C TB.3d、SM.3d),电刺激产生挛缩带使局部肌原纤维超收缩,物理性破坏肌原纤维结构,提高肉嫩度[13]。宰后5d,TB的肌原纤维框架基本模糊,ML和SM的肌原纤维间隙明显变大,M线消失,Z线断裂,粗丝、细丝结构也很模糊,肌原纤维大面积溶解,三个部位都出现不同程度的小片化现象(图4D组)。此图表明,通过电刺激产生的挛缩带对肌原纤维破坏,细胞液渗出,增加不同部位牦牛肉多汁性,提升不同部位牦牛肉嫩度。

图4 电刺激对成熟过程中不同部位牦牛肉肌原纤维超微结构的影响(×15000)Fig.4 variations of ultrastructure of myofibrilsin Yak during postmortem aging(×15000)
注:A.宰后0d;B.宰后1d;C.宰后3d;D.宰后5d。
2.4 电刺激对不同部位牦牛肉全肌肉蛋白SDS-PAGE电泳图谱的影响
图5所示,电刺激后,随着肌肉成熟时间延长,不同部位牦牛肉SDS-PAGE电泳图谱都发生了一定的降解变化。宰后0d,三个部位电泳图谱中一些分子量大的蛋白质条带逐渐被降解,可知电刺激已经开始发挥作用。图5-TB,宰后1d在75~100ku之间有小降解片段产生,图5-ML显示其降解片段是在宰后3d,此区域为肌球蛋白重链(Hm)分子量区域。图5-SM在48~63ku之间蛋白质条带降解极显著,宰后0~5d,几乎呈现出一个模糊痕迹,此为肌间线蛋白(D)的分子量区域。对于在17~20ku之间肌球蛋白轻链(Lm1Lm2)的分子量区域,不同部位牦牛肉对其降解程度与75~100ku之间可能出现的Hm降解度呈正相关,值得注意的是图5-ML的Hm和Lm1Lm2的可能区域,在宰后5d,条带颜色稍有加深,这种细微的变化可能和内源酶消耗减慢后非酶因素干扰有关。不同部位牦牛肉蛋白质条带降解速度和程度在宰后0~3d有差异。宰后5d,各个蛋白质条带降解程度不再有明显变化,痕迹模糊,这说明内源酶被消耗,活性降低,不再降解更多蛋白质。

图5 电刺激对成熟过程中不同部位牦牛肉 全肌肉蛋白SDS-PAGE电泳图谱的影响Fig.5 SDS-PAGEphotograph of yak whoele muscle proteins during postmortem aging
注:Mark为不同蛋白分子量标准蛋白泳道, 0d~5d泳道分别为电刺激后成熟 0、1、3、5d的样品;Hm:肌球蛋白重链、P:原肌球蛋白、 D:肌间线蛋白、A:肌动蛋白、T:肌钙蛋白-T、 Lm1Lm2:肌球蛋白轻链。
3 讨论
本研究结果表明电刺激作用在短时间内显著改变不同部位牦牛肉肌节长度。电刺激对较差肉质嫩化效果明显,肌节收缩又舒展的这种变化趋势与Eikelenboom和Smulders[13]研究低压电刺激宰后牛肉成熟过程中肌节长度变化相符,肌节长度恢复越大,肌肉嫩度越大。不同部位牦牛肉肌纤维直径在宰后0~5d内平均缩短6%、5%和9%,差异显著(p<0.05),其中SM变化最显著,这说明电刺激对不同部位牦牛肉的影响效果有显著性差异,肌纤维直径下降这一趋势与Thompson[14]研究牛背最长肌成熟过程结果相近,研究表明肉质越细嫩的部位,粗丝细丝密度越大,系水力越强,肌纤维直径越小。
本研究结果表明电刺激作用加速肌原纤维破坏程度。这一增大趋势与Veilseth[15]研究电刺激羊宰后成熟过程结果一致,MFI值越大,肌原纤维结构的完整性受到的破坏程度越大,肉质嫩度越好。宰后短时间内电刺激使肌肉痉挛,宰后5d,TB与SM差异显著(p<0.05),ML与SM差异不显著(p>0.05),也就是说电刺激对天然肉质硬度较大的SM嫩化效果显著,使其与其他部位嫩度接近,这与Terevinto[16]研究鸵鸟不同部位肉结果类似,运动部位肉质较硬,弹性蛋白含量多,电刺激有效嫩化硬度大位肉。
本实验结果表明,电刺激产生挛缩带,改变不同部位牦牛肉超微结构。Takahashi[17]研究得出电刺激后牛肉微观结构中肌节长度最大缩短85%,Sorinmade[18]提出45V、2min电刺激,有30%牛肉超微结构受到物理破坏,这些变化趋势与本实验结果一致,这说明,电刺激使不同部位牦牛肉肌肉痉挛,形成挛缩带,破坏肌原纤维物理结构,加速成熟进程。Kent和Spencer[19]研究认为,电刺激除了对肌原纤维结构物理性破坏外,挛缩带所产生的肌原纤维超微结构形变,更大程度暴露了蛋白降解底物,从而加快了细胞骨架蛋白降解。
本研究表明电刺激加快蛋白质降解,改善不同部位牦牛肉肉质嫩度。Taylor等[20]研究发现电刺激和冷却延迟条件下,TB和SM肌纤维蛋白骨架在72小时内逐渐被破坏,证明电刺激使SM肉质嫩度改善,宰后5d,TB、ML和SM蛋白质条带降解程度不显著,内源酶被消耗,Bernard[21]研究钙激活酶在宰后2d内活性最大,其他主要内源酶类在宰后5d活性下降,这与本实验结果一致。Dransfield[22]研究表明肉的成熟是内源酶对肌肉中各种蛋白质降解所致,电刺激使肌节收缩,加速牛肉中ATP分解,同时无氧条件下糖原酵解产生乳酸,使宰后胴体内pH迅速下降,胴体酸环境导致内源酶膜破裂,使其充分接触肌纤维蛋白,加大对蛋白质的分解力度,使肌纤维结构破坏,MFI值增大,快速提升嫩度。
4 结论
低压电刺激使不同部位牦牛肉肌节长度在宰后0~5d内显著变化,显著缩短肌纤维直径,有效地缩短肉质较差SM成熟排酸时间。电刺激对不同部位牦牛肉嫩化作用极显著,其中TB嫩化程度最佳,SM嫩度改善作用极显著。电刺激使不同部位牦牛肉都产生破坏肌节结构的挛缩带,肌原纤维大面积溶解;宰后5d,SM与ML嫩化程度接近。电刺激后全肌肉蛋白SDS-PAGE电泳图谱显示,不同部位牦牛肉对蛋白质降解效果有一定差异,不同部位牦牛肉中蛋白质成分有一定差异,这影响着不同部位肉质嫩度。
[1]田园,孙志昶,余群力,等. 低压电刺激对牦牛肉宰后成熟过程中嫩度及肌纤维超微结构的影响[J]. 食品科学,2014,35(7):43-47.
[2]黄明,刘冠勇,罗欣. 影响肉嫩度因素的探讨[J]. 肉类工业,2000(7):26-28.
[3]Becila,Samira,Herrera,et al. Postmortem muscle cells die through apoptosis[J]. European Food Research and Technology,2010,231(3):485-493.
[4]Caroline M,Kemp,Tim Parr. Advances in apoptotic mediated proteolysis in meat tenderisation[J]. Meat Science,2012,92(3):252-259.
[5]Bowling R A,Dutson T R,Smith G C,et al. Effects of cryogenic Chilling on beef carcass grade,shrinkage and palatability characteristics[J].Meat Sciences,1987,21(1):67-72.
[6]张先峰. 电刺激与延迟冷却对牛肉肌原纤维超微结构的影响[D]. 泰安:山东农业大学,2006.
[7]孙清亮,罗欣,毛衍伟,等. 电刺激和延迟冷却对宰后牛肉肌原纤维Troponin-T降解的影响[J]. 农业工程学报,2008,24(6):262-266.
[8]诸永志,宋玉,黄伟,等.雪山草鸡宰后肌肉成熟过程中剪切力及肌原纤维结构的变化[J].江苏农业学报,2012,28(2):351-354.
[9]曹锦轩. 宰后牛肉成熟过程中肌细胞死亡生理研究[D].南京:南京农业大学,2010.
[10]臧大存,周光宏,徐幸莲,等.加热过程中鸭肉嫩度及超微结构的变化[J].江苏农业学报,2007,23(5):475-480.
[11]Janz J A M,Aalhusb J L,Pricea M A. Blast chilling and low voltage electrical stimulation influences on bison(Bison bison bison)meat quality[J]. Meat Science,2001,57(4):403-411.
[12]王玉宁,罗欣,张先锋,等.电刺激和延迟冷却对宰后牛肉肌原纤维蛋白降解变化的影响[J].肉类研究,2006(6):25-28.
[13]Eikelenboom G,Smulders F J M,Ruderus H. The effect of high and low voltage electrical stimulation on beef quality[J]. Meat Science,1985,15(4):247-254.
[14]Hwang I H,Thompson JM. A technique to quantify the extent of postmortem degradation of meat ultrastructure[J]. Asian-Australasian Journal of Animal Science,2002,15(1):111-116.
[15]Veilseth E,shackelford S D,wheeler T L,et al.Indicators of tenderization are detectable by 12h postmortem in ovine longissimus[J]. Journal of Animal Science,2004,82(5):1428-1436.
[16]Terevinto,Ramos,Castroman,et al.Invitroiron-induced lipid oxidation and superoxide dismutase,catalase and glutathione peroxidase activities in rhea meat[J]. Meat Science,2010,84(4):706-710.
[17]Takahashi G,Wang S M,Lochner J V,et al. Effects of 2-Hz and 60-Hz electrical stimulation on the microstructure of beef[J].Meat science,1987,19(1):65-76.
[18]Sorinmade,cross,wergin,et al. Mechanisms of ultrastructural changes in electrlcally stlmulated beef longlsslmus muscle[J]. Meat science,1982,6(1):71-77.
[19]Kent MP,Spencer M J,Koohmaraie M.Postmortem proteolysis is reduced in transgenic mice overexpressing calpastatin[J]. Journal of Animal Science,2004,82(3):794-801.
[20]Taylor R,Geensink G H,Thompson V F,et al. Is Z-disk degradation responsible for postmortem tenderization[J]. Journal of Animal Science,1995,73(5):1351-1367.
[21]Bernard C,CassarMalek,Ctnff Le,et al. New indicators of beef sensory quality revealed by expression of specific genes[J].Journal of Agricultural and Food Chemistry,2007,55(13):5229-5237.
[22]Dransfield E. Optimization of tenderization,ageing and tenderness[J]. Meat Science,1994,36(1~2):105-121.
Effect of low voltage electrical stimulation on myofibrillar proteolysisof different parts of yak meat
JIA Qing1,YU Qun-li1,*,TIAN Yuan1,SUN Zhi-chang1,LI Hong-bo2
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Zhongtian Bio~Engineering Co.Ltd. of Gansu Longyuan,Longxi 748100,China)
After being treated by electrical stimulation in yak meat,changes in microstructure and myofibrillar proteolysis were studied. The raw materials were yaks slaughtered with electrical stimulation within 5min(21V,50Hz,90s),and then chilled(0~4℃,wind speed 0.5m/s). Taking front triceps(TB),central longissimus muscle(ML)and posterior semimembranosus(SM)as material,respectively,then determined sarcomere length,muscle fiber diameter,MFI value,muscle fiber microstructures and SDS-PAGE electrophoresis after postmortem 0,1,3 and 5d. The results indicated that after electrical stimulation,sarcomere length of different parts of yak meat changed significantly(p<0.05);the average diameter of the muscle fibers shortened 6%,5% and 9% repectively,MFI values increased by 54%,55% and 92% significantly,tenderness of SM increased significantly(p<0.05). Share of different parts of yak meat myofibrillar ultrastructure contracture were 23.9%,26.3% and 31.2%. Myofibrillar ultrastructural changed significantly. The view of the SDS-PAGEphotograph,TB,ML and SM Myofibrillar protein degradated completely between 48~75ku. In a conclusion,electrical stimulation could shorten the aging time,and improve tenderness of yak meat,especially,make a significant difference to poorer SM part(p<0.05).
yak;electrical stimulation;postmortem aging;myofibrils
2014-05-19
贾青(1987-),女,硕士研究生,研究方向:动物性食品营养工程。
*通讯作者:余群力(1962-),男,博士,教授,研究方向:动物性食品营养工程。
国家现代农业(肉牛牦牛)产业技术体系资助项目(CARS-38);国家科技支撑计划(2012BAD28B01)。
TS251.1
A
1002-0306(2015)05-0053-05
10.13386/j.issn1002-0306.2015.05.002

