乙基麦芽酚在正丙醇-水中溶解度的测定与关联模型
张利云,杨立斌,沙作良
(天津科技大学海洋科学与工程学院,天津市海洋资源与化学重点实验室,天津 300457)
乙基麦芽酚在正丙醇-水中溶解度的测定与关联模型
张利云,杨立斌,沙作良
(天津科技大学海洋科学与工程学院,天津市海洋资源与化学重点实验室,天津 300457)
本实验采用平衡法测定了在283.15~313.15K范围内,乙基麦芽酚在纯水及正丙醇-水不同比例混合溶剂中的溶解度;实验数据分别用多项式模型和半经验活度模型进行了模拟。模拟结果表明,在实验条件范围内,半经验活度方程模拟结果优于具有相同参数的多项式方程,其相关系数R2均大于0.981,且精度满足工程预测要求。
乙基麦芽酚,正丙醇-水混合溶剂,溶解度,半经验活度模型
乙基麦芽酚,化学名称2-乙基-3羟基-4H-吡喃酮,是一种重要的香味增效剂,具有增香、增甜、保香、“圆熟”、防腐和掩盖异味等功能,且其增香效果为香豆素的24倍,为麦芽粉(即甲基麦芽酚)的4~6倍;广泛应用于食品、香烟、药物、饮料、牙膏和化妆品等行业[1-2]。工业中,乙基麦芽酚一般通过化学合成后结晶分离得到产品。
乙基麦芽酚结晶分离纯化的热力学基础数据如在乙醇-水混合溶剂中的溶解度已有报道[3],但乙基麦芽酚结晶分离时产生的晶型和香型与有机溶剂或混合溶剂的类型和浓度有关系[4],因此有必要分析研究乙基麦芽酚在其他溶剂中的结晶行为,而在此类溶剂中的溶解度数据是研究乙基麦芽酚在溶剂中结晶过程的基础。
本文采用平衡法,分析测定了不同温度条件下乙基麦芽酚在正丙醇-水混合溶剂中的溶解度,同时分析研究找出适宜的模型拟合出了溶解度曲线,为预测乙基麦芽酚在此类混合溶剂中的溶解度提供了依据。
1 材料与方法
1.1 材料与仪器
乙基麦芽酚(纯度≥99.7%),纯香型,由安徽金禾实业股份有限公司提供;实验用水为蒸馏水。正丙醇、甲醇、盐酸、氯化铁,均为分析纯,由天津盛腾达化学试剂公司提供。
JB-3定时双向磁力恒温搅拌器 江苏省金坛市荣华仪器制造有限公司;Syc智能超级恒温水槽 巩义市予华仪器有限责任公司;722S可见分光光度计 上海精密科学仪器有限公司制造;电子天平CP114 奥豪斯仪器(上海)有限公司制造;有机过滤膜(规格:0.2μm);注射器(规格:5mL) 由天津盛腾达化学试剂公司提供。
1.2 实验方法
本实验采用平衡法[5],即在某一恒定温度下,溶液中存在过量的固体样品在搅拌状态下达到平衡。称量过量的乙基麦芽酚和一定质量的水或者一定比例的正丙醇-水混合溶剂放入恒温夹套瓶中,开启搅拌,如图1所示;每隔一段时间取溶液分析乙基麦芽酚含量,直至含量不变,并记录达到平衡所需时间(6h后溶液基本达到平衡,实验中采用平衡时间为8h)(见图2)。
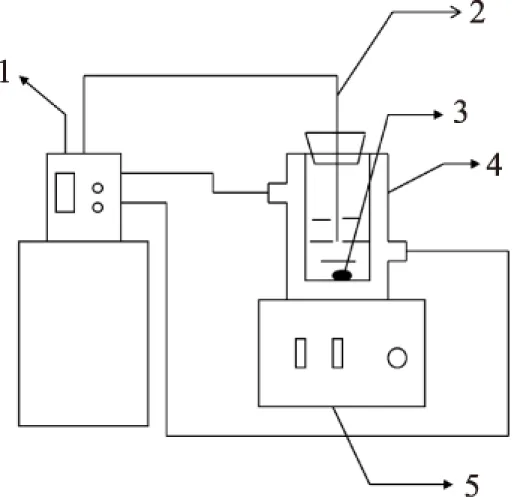
图1 实验装置图Fig.1 Set-up for solid-liquid equilibrium
注:1-恒温水浴装置;2-感温探头; 3-搅拌子;4-夹套瓶;5-磁力搅拌器。
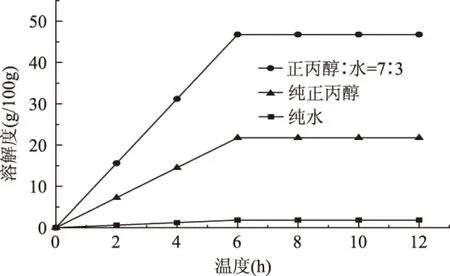
图2 溶液平衡时间Fig.2 Time on solid-liquid equilibrium
乙基麦芽酚浓度分析测定的原理及过程:基于乙基麦芽酚与三价铁离子反应生成紫红色配合物的特点,选用可见分光光度计[6-7]分析溶液的方法[8]。
准确称取0.1401g乙基麦芽酚,用正丙醇溶解,定量转移至100mL容量中,用蒸馏水定容,摇匀。工作液由此标准溶液用蒸馏水稀释,稀释液范围为1×10-4~1×10-2mol/L,在25mL比色管中加入适量乙基麦芽酚工作液,再加入浓度为0.01mol/L的盐酸缓冲溶液4mL,浓度为1g/L的FeCl3显色剂溶液2mL,然后用1∶100的甲醇稀释剂稀释至刻度,摇匀,用10mm比色皿[9],以试剂空白为参比,在540nm波长[10]处分别测定标准溶液的吸光度,以标准溶液浓度为横坐标(C),以吸光度为纵坐标(A),绘制标准曲线[11]。结果表明,乙基麦芽酚浓度在1×10-3~2.8×10-3mol/L之间有良好的线性关系。线性方程为A=0.2212C+0.0359,R2=0.9993。
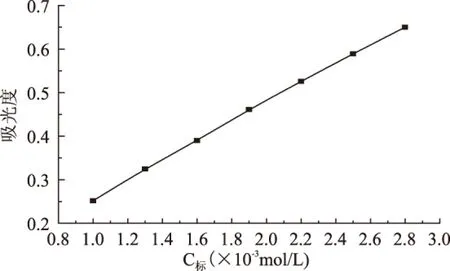
图3 标准工作曲线Fig.3 Standard working curve
待测溶液的预处理及测定:体系达到平衡之后停止搅拌,使未溶解的乙基麦芽酚晶体沉积到溶液的底部,用注射器抽取上部少量清液,用0.2μm有机过滤膜过滤,从滤液中取一定量的待测液于100mL容量瓶中,用蒸馏水定容,摇匀备用。在将待测液稀释到标准曲线所测得的吸光度范围内,并测出其吸光度,再通过标准曲线计算其浓度,从而计算出其在此温度下的溶解度。
2 结果与讨论
2.1 乙基麦芽酚在正丙醇-水混合溶剂中的溶解度
为描述乙基麦芽酚的溶解度与温度的关系,将乙基麦芽酚在正丙醇-水混合溶剂中的溶解度随温度的变化趋势在图4中分析。
由图4可以看出,当正丙醇与水质量配比大于1∶4时,乙基麦芽酚的溶解度随温度的升高明显增大。而正丙醇与水的质量配比低于1∶4时,乙基麦芽酚的溶解度随温度变化不大,这是因为正丙醇浓度较小时,水比例较大,乙基麦芽酚在纯水中的溶解度较低。
在不同温度下,乙基麦芽酚的溶解度随正丙醇-水不同质量配比的变化趋势,如图5所示。

图5 乙基麦芽酚溶解度 随正丙醇-水不同质量配比的变化趋势Fig.5 The solubility of ethyl maltol with different mass ratio of 1-propyl alcohol-water
由图5可以看出,乙基麦芽酚的溶解度随着正丙醇-水混合溶剂中正丙醇含量的增加先增大后减小,且其在正丙醇-水质量配比为7∶3时溶解度达到最大值。
2.2 溶解度实验数据的拟合
2.2.1 多项式模型 为了方便应用,采用两参数线性方程拟合S和T之间的关系,具体形式:
S=a+bT
式(1)
在式(1)中,a,b为方程参数,S为溶解度(单位为g/100g溶剂),T为温度(单位为K)。本实验所得溶解度数据用该方程拟合结果与实验值的比较如图6所示。
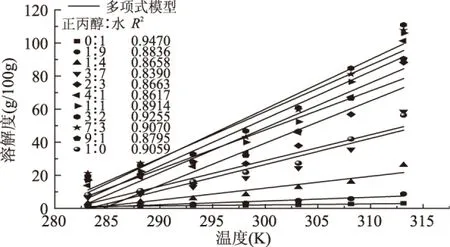
图6 线性方程拟合结果与实验值的比较Fig.6 Comparison of the correlation results of linear equation and the experimental values
由图6可看出,尽管线性方程拟合方便应用,但拟合结果相关系数R2均小于0.95,则说明用线性方程对乙基麦芽酚在纯水及其在正丙醇-水不同质量配比下的溶解度进行拟合,结果不是很理想。
2.2.2 半经验活度模型拟合 描述固液平衡有如下普遍化的溶解度方程[12]:
式(2)
由于压力项和热熔差较小可以忽略掉,因此,(2)式可以简化为[13]:
式(3)
活度系数一般可以表达为[14]:
式(4)
将(4)式带入(3)式,得到如下方程:
式(5)

式(6)
从式(2)到式(6)这5个式子中,x1为溶质的摩尔分率;γ1为溶质的活度系数;ΔHTP为溶质在三相点熔化焓,J/mol;TTP为溶质在三相点时的温度,K;ΔHml为溶质在熔点时的熔化焓,J/mol;Tml为溶质在熔点时的温度,K;T为温度,K;R为通用气体常数,J/(mol·K);a,b,A,B为方程参数。
对本实验所得的溶解度数据用该模型进行拟合,所得结果与实验值的比较如图7所示。

图7 半经验活度模型拟合结果与实验值的比较Fig.7 Comparison of the correlation results of semi-empirical activity model and the experimental values
由图7可以看出,该模型相关系数R2均大于0.981,所以公式(6)能高精度的关联乙基麦芽酚在正丙醇-水混合溶剂中的溶解度,且其形式简单,方便应用,物理意义明确。
3 结论
在正丙醇与水的混合溶剂中,乙基麦芽酚的溶解度随着温度的升高而增大,且随着溶剂中正丙醇含量的增加先增大后减小;半经验活度模型的拟合结果优于具有相同参数的线性方程,其相关系数R2均大于0.981,且精度满足工程预测要求。
[1]王之德.新型增香剂乙基麦芽酚[J].四川化工,1994,1:51-54.
[2]李士雨.乙基麦芽酚精制技术的改进[J].化学工业与工程,1995,12(1):50-53.
[3]Liu B S,Liu R J,Hu Y Q,et al. Solubility of Ethyl Maltol in Aqueous Ethanol Mixtures[J]. J Chem Eng Data,2008,53(11):2712-2714.
[4]Simon D B,John B,John F,et al. Three Polymorphic Forms of 2-Ethyl-3-hydroxy-4-pyranone(Etjyl Maltol)[J]. Acta Cryst,1995,C51:1335-1338.
[5]Zvaigzne A I,Acree W E. Solubility of anthracene in binary alkane+3-methyl-1-butanol solvent mixture[J]. Journal of Chemical and Engineering Data,1994,39(4):708-710.
[6]Ni Y N,Zhang G W,Kokotc S. Simultaneous spectrophotometric determination of maltol,ethylmaltol,vanillin and ethyl vanillin in foods by multivariatecalibration and articial neural networks[J]. Food Chemistry,2005,89:465-473.
[7]Pehlivan E,Cetin S. Sorption of Cr(VI)ions on two Lewatit-anion exchange resins and theirquantitative determination using UV-visible spectrophotometer[J]. Journal of Hazardous Materials,2009,163:448-453.
[8]董学芝,李畅,王爱芳,等.食品中乙基麦芽酚快速测定方法研究[J].食品科学,2008,29(6):318-320.
[9]仉晓文,王丽,刘涩,等.紫外/可见分光光度计的使用[J].生物学教学,2012,37(9):27-28.
[10]彭少华,马文华,狄俊伟. 分光光度法、高效液相色谱法和伏安法测定麦芽粉和乙基麦芽酚[J].光谱实验室,2005,22(4):680-682.
[11]顾洪云,分光光度计法制作标准曲线应该注意的问题[J].中国氯碱,2011,7(7):36-37.
[12]骆健美,金志华,岑沛霖,等.纳他霉素在不同溶剂中溶解度的测定与关联[J].高校化工学报,2008,22(5):733-738.
[13]王立志,刘庆芬,刘俊果. 土霉素盐酸盐在不同溶剂中溶解度的测定与关联[J].北京工商大学学报:自然科学版,2012,30(4):59-63.
[14]孙鹏,刘俊国,杨玉淮,等.阿维菌素在不同醇-水溶液体系中溶解度的测定与关联[J].高校化学工程学报,2010,24(5):735-738.
Measurement of correlation model ethyl maltol solubilityin 1-propyl alcohol-water mixture
ZHANG Li-yun,YANG Li-bin,SHA Zuo-liang
(College of Marine Science and Engineering,Tianjin University of Science &Technology,Tianjin Key Laboratory of Marin Resources and Chemistry,Tianjin 300457,China)
The solubility of ethyl maltol in water and mixed solvent of different ratio of 1-propyl alcohol-water was measured in the temperature ranging from 283.15K to 313.15K by the equilibrium method. Experimental datas were respectively simulated by the polynomial and semi-empirical activity equation. And the results showed that the semi-empirical equation was better than with polynomial equation in the range of experimental conditions.
ethyl maltol;mixed solvent of 1-propyl alcohol-water;solubility;semi-empirical activity model
2014-06-13
张利云(1988-),女,硕士在读,研究方向:工业结晶。
TS201.1
A
1002-0306(2015)05-0123-04
10.13386/j.issn1002-0306.2015.05.017

