基于蕨素聚类分析的凤尾蕨属药用植物化学分类研究
刘建群,刘 健
(江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004)
基于蕨素聚类分析的凤尾蕨属药用植物化学分类研究
刘建群,刘 健
(江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004)
目的:研究凤尾蕨属5 种药用植物蕨素类活性成分,为其质量评价、鉴定及亲缘关系研究提供依据,为凤尾蕨属植物化学分类深入研究奠定基础。方法:采用HPLC-DAD 测定5 种药用植物的石油醚、乙酸乙酯、正丁醇和水部位的蕨素类成分。比较蕨素种类和含量差异,并以蕨素类特征成分及其含量为分类性状,采用聚类分析对凤尾蕨属药用植物进行化学分类研究。结果:从大叶井口边草、半边旗、全缘凤尾蕨、蜈蚣草和凤尾草中分别检测出蕨素类成分59、39、3、7和22个,总体来看大叶井口边中蕨素类成分含量最高,而全缘凤尾蕨中蕨素类成分含量最低。运用系统聚类将5 种药用植物聚成3类: 第Ⅰ类为全缘凤尾蕨、蜈蚣草和凤尾草; 第Ⅱ类为半边旗;第Ⅲ类为大叶井口边草。结论:半边旗与全缘凤尾蕨、蜈蚣草和凤尾草之间的化学亲缘关系较远。蕨素聚类结果与传统分类结果有较好的一致性。蕨素类成分HPLC-DAD图谱可用于凤尾蕨属植物的鉴别和分类研究,并可为其质量评价提供重要参考。
凤尾蕨属;蕨素;高效液相色谱法;聚类分析;化学分类
凤尾蕨属(Pteris)隶属于凤尾蕨科(Pteridaceae),全世界约有300种,产于热带和亚热带地区,南达新西兰、澳大利亚(塔斯马尼亚)及南非洲,北至日本及北美洲。我国现知有66种,主要分布于华南及西南,少数种类向北到达东及秦岭南坡[1]。根据秦仁昌等对凤尾蕨科系统分类[2],中国植物志按照植物的形态特征将凤尾蕨属分为网眼凤尾蕨组(Sect.Campteria)、凤尾蕨组(Sect.Pteris)和篦形凤尾蕨组(Sect.Quadriauricula)3组。目前凤尾蕨属有近30种植物有化学成分研究报道,特别是关于凤尾草(Pterismultifida)、半边旗(Pterissemipinnata)和蜈蚣草(Pterisvittata)等研究报道较多。该属植物中主要含有蕨素类倍半萜、对映贝壳杉烷型二萜以及黄酮类化学成分[3-9]。目前,凤尾蕨属部分植物主要作为民间药用,用于抗肿瘤、抗菌消炎和保肝抗氧等临床应用[3]。例如:半边旗中的对映贝壳杉烷型二萜具有很好的体外抗肿瘤作用[8];蜈蚣草多糖、凤尾草多糖对大肠杆菌、变形杆菌、金黄色葡萄球菌、啤酒酵母和青霉菌等均有不同程度的抑菌活性[10];凤尾草和蜈蚣草中的黄酮类成分具有较好的保肝抗氧化作用[11-12]。目前已从凤尾蕨属植物中分离了许多蕨素类成分[4-6],研究表明蕨素类化合物具有显著的生理活性,如保肝、抗氧化、抗癌、促进人类肠吸收功能、止痉挛、治疗糖尿病及肥胖等作用[13-17]。蕨素为蕨类植物特有的特征成分,为1-茚酮结构(见图1)。该类成分具有很好的药用价值、植物鉴别和化学分类学意义[18-19]。凤尾蕨属相同组系有的植物从形态上区分比较困难,例如凤尾草与大叶井口边草(PteriscreticaL. var.nervosa)等。目前关于凤尾蕨属蕨素类成分及化学分类的系统研究很少。本文采用HPLC-DAD 测定了凤尾蕨属5种药用植物(全缘凤尾蕨、蜈蚣草、凤尾草、半边旗和大叶井口边草)的蕨素类成分,共检出该类成分80多个,并首次以蕨素类特征成分及其含量为分类性状,采用聚类分析对凤尾蕨属5种药用植物进行化学分类研究,评价了种间亲缘关系,以期为凤尾蕨属植物化学分类研究提供新思路。
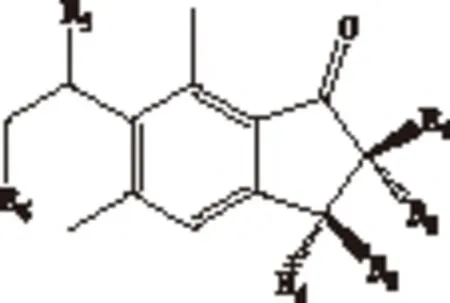
图1 蕨素结构图
1 材料与仪器
Agilent1260高效液相色谱仪(四元泵、柱温箱、DAD检测器和Agilent 1260 色谱工作站);Diamonsil C18(4.6 mm×250 mm, 5μm);乙腈(HPLC级,ACS公司);甲醇和甲酸(分析纯,上海国药集团化学试剂有限公司);双蒸水(自制)。半边旗、全缘凤尾蕨、蜈蚣草和凤尾草药材全草于2013年10月采自江西省萍乡市,大叶井口边草全草采自江西省南昌市,经江西中医药大学现代中药制剂教育部重点实验室刘建群教授分别鉴定为凤尾蕨科植物半边旗(Pterissemipinnata)、全缘凤尾蕨(Pterisinsignis)、蜈蚣草(Pterisvittata)、凤尾草(Pterismultifida)和大叶井口边草(PteriscreticaL. var.nervosa),凭证标本(NO.2013101P、NO.2013102P、NO.2013103P、NO.2013104P和NO.2013105N) 保存于江西中医学院现代中药制剂教育部重点实验室。
2 方法与结果
2.1 样品溶液配制
精密称取5种药材粉末各1 g,置于50 mL具塞锥形瓶中,精密加甲醇20 mL,加热回流60 min,过滤,减压蒸干,用10 mL水混悬,分别用等体积的石油醚、乙酸乙酯和正丁醇萃取三次,减压蒸干溶剂后用5 mL甲醇溶解,溶液用0.45 μm微孔滤膜过滤,得四个部位(石油醚部位、乙酸乙酯部位、正丁醇部位和水部位)样品溶液。
2.2 色谱条件
石油醚部位:Diamonsil C18色谱柱(4.6 mm×250 mm, 5 μm),以乙腈-0.1%甲酸水溶液为流动相进行梯度洗脱(0~80 min, 15 ∶85~100 ∶0;80~90 min, 100 ∶0),流速1.0 mL/min,检测波长258 nm,柱温30 ℃,进样量10 μL。
乙酸乙酯部位:Diamonsil C18色谱柱(4.6 mm×250 mm, 5 μm),以乙腈-0.1%甲酸水溶液为流动相进行梯度洗脱(0~5 min, 5 ∶95;10~35 min, 15 ∶85;55~95 min,17 ∶83~100 ∶0),流速1.0 mL/min,检测波长258 nm,柱温30 ℃,进样量10 μL。
正丁醇部位:Diamonsil C18色谱柱(4.6 mm×250 mm, 5 μm),以乙腈-0.1%甲酸水溶液为流动相进行梯度洗脱(0~5 min, 5 ∶95;24~34 min, 11 ∶89;55~70 min, 20 ∶80~60 ∶40;80~90 min,100 ∶0),流速1.0 mL/min,检测波长258 nm,柱温30 ℃,进样量10 μL。
水部位:Diamonsil C18色谱柱(4.6 mm×250 mm, 5 μm),以乙腈-0.1%甲酸水溶液为流动相进行梯度洗脱(0~5 min, 5 ∶95;20~25 min, 11 ∶89;30~35 min,15 ∶85;50~60 min,25 ∶75~100 ∶0;70 min,100 ∶0),流速1.0 mL/min,检测波长258 nm,柱温30 ℃,进样量10 μL。
2.3 五种凤尾蕨属药材石油醚部位HPLC和蕨素类成分聚类分析
笔者前期研究报道了蕨素类成分的紫外光谱特征如下[20]:蕨素紫外光谱具有3个特征紫外吸收峰, 最大吸收波长和摩尔吸光系数范围为: λmax1(290~330 nm ), ε1(103 L/ mol·cm) ; λmax2(245~270 nm), ε2(103~104L/ mol·cm) ; λmax3(200~230 nm), ε3(104~105L/ mol·cm ),3 个紫外吸收峰摩尔吸光系数比约为: ε1∶ε2∶ε3≈1∶(3~9)∶(4~20)。五种凤尾蕨属药材石油醚部位HPLC色谱图见图2A,蕨素类成分(大叶井口边草石油醚部位保留时间27.952 min)的典型DAD紫外光谱见图3。根据蕨素紫外光谱特征以及DAD紫外光谱图鉴定出HPLC色谱图中的蕨素,并将保留时间和峰面积归纳于表1。以蕨素类特征成分及其含量为分类性状,采用SPPS软件对凤尾蕨属5种药用植物石油醚部位进行聚类分析,结果见图4A。从图4A可以看出,5 种药用植物聚成3类: 第Ⅰ类为全缘凤尾蕨、蜈蚣草和凤尾草; 第Ⅱ类为半边旗;第Ⅲ类为大叶井口边草。半边旗与全缘凤尾蕨、蜈蚣草和凤尾草之间的化学亲缘关系较远。根据中国植物志[1],全缘凤尾蕨、蜈蚣草、凤尾草和大叶井口边草同属于凤尾蕨组,而半边旗属于篦形凤尾蕨组。聚类分析结果与传统分类结果有较好的一致性。聚类分析结果表明凤尾蕨组的大叶井口边草与同组其它3种距离较远,可能因为产地差异原因或本身因素导致,值得进一步研究。凤尾草与大叶井口边草同属凤尾蕨组,从植物形态上区分十分困难。结果表明,本方法可明显区分这两种植物。研究表明,蕨素类成分HPLC图谱可用于凤尾蕨属植物的分类和鉴别研究,并可为凤尾蕨属药用植物质量控制提供重要参考。
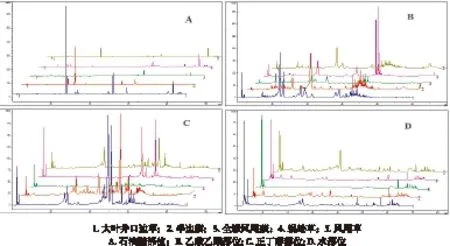
图2 五种凤尾蕨属药材各部位HPLC色谱图

图3 蕨素类成分的典型DAD紫外光谱图表1 五种凤尾蕨属药材石油醚部位蕨素类 成分保留时间和峰面积

保留时间/min大叶井口边草半边旗全缘凤尾蕨蜈蚣草凤尾草4.641000012.88.7655500009.07233.2000012.97836.8000016.47818.3000017.94523.8000018.08818000024.5580502.5015.9027.9527011.73008.416.6109.4798.829.959032.100033.542478.3135008034.127110.2000038.76850.8000049.678234.500063.850.3555.466.700052.0551992.8409.1041.726088.36222.70000

图4 五种凤尾蕨属药材四个部位蕨素类成分系统聚类分析图
2.4 五种凤尾蕨属药材乙酸乙酯部位HPLC和蕨素类成分聚类分析
5种凤尾蕨属药材乙酸乙酯部位HPLC色谱图见图2B。按2.3项下方法,根据蕨素紫外光谱特征以及DAD紫外光谱图鉴定出HPLC色谱图中的蕨素,并将保留时间和峰面积归纳于表2。以同2.3项下方法进行聚类分析,结果见图4B。从图4B可以看出,5 种药用植物乙酸乙酯部位蕨素聚类结果与石油醚部位基本一致。
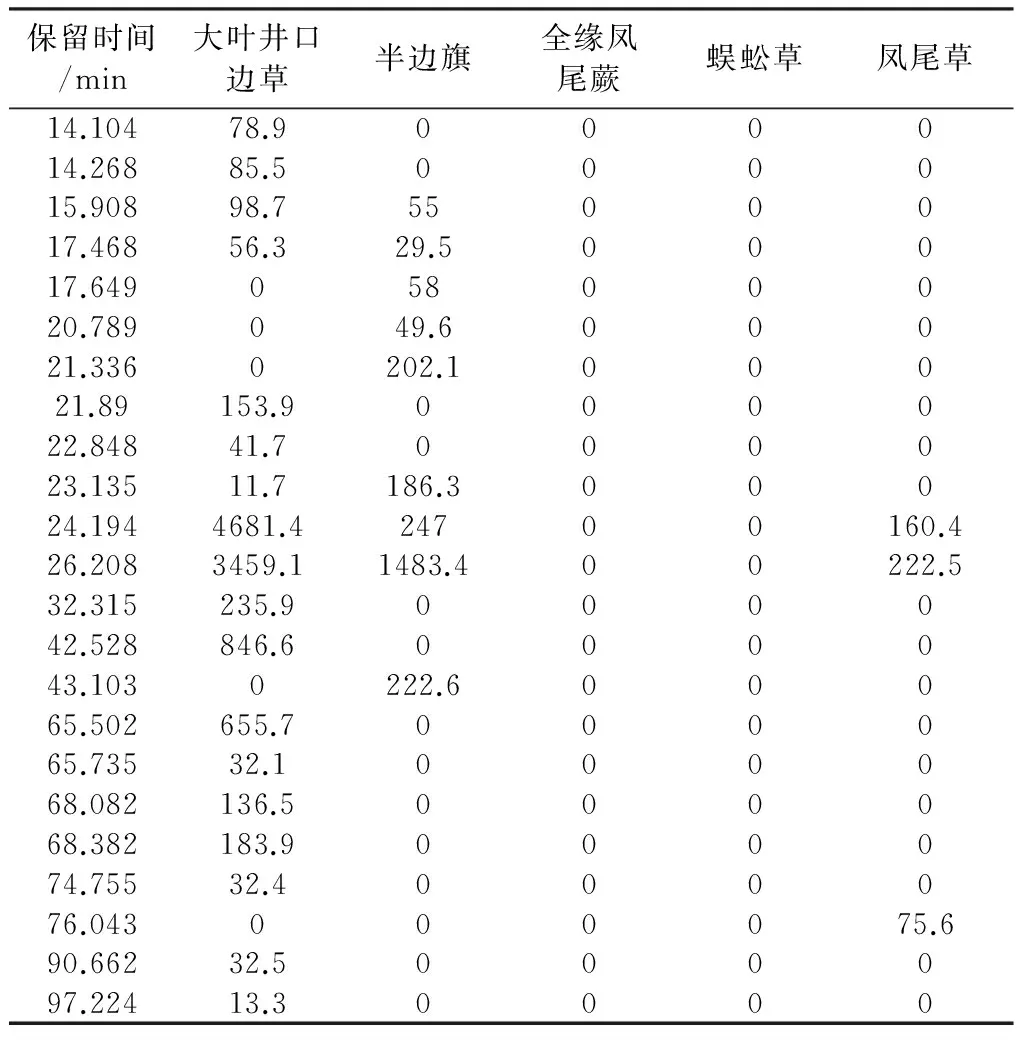
表2 五种凤尾蕨属药材乙酸乙酯部位蕨素类
2.5 五种凤尾蕨属药材正丁醇部位HPLC色谱图和蕨素类成分聚类分析
5种凤尾蕨属药材乙酸乙酯部位HPLC色谱图见图2C。按2.3项下方法,根据蕨素紫外光谱特征以及DAD紫外光谱图鉴定出HPLC色谱图中的蕨素,并将保留时间和峰面积归纳于表3。以同2.3项下方法进行聚类分析,结果见图4C。从图4C可以看出,5 种药用植物正丁醇部位蕨素聚类结果与石油醚部位基本一致。

表3 五种凤尾蕨属药材正丁醇部位蕨素类
2.6 五种凤尾蕨属药材水部位HPLC色谱图和蕨素类成分聚类分析
5种凤尾蕨属药材乙酸乙酯部位HPLC色谱图见图2D。按2.3项下方法,根据蕨素紫外光谱特征以及DAD紫外光谱图鉴定出HPLC色谱图中的蕨素,并将保留时间和峰面积归纳于表4。以同2.3项下方法进行聚类分析,结果见图4D。从图4D可以看出,5 种药用植物水部位蕨素聚类结果与石油醚部位基本一致。
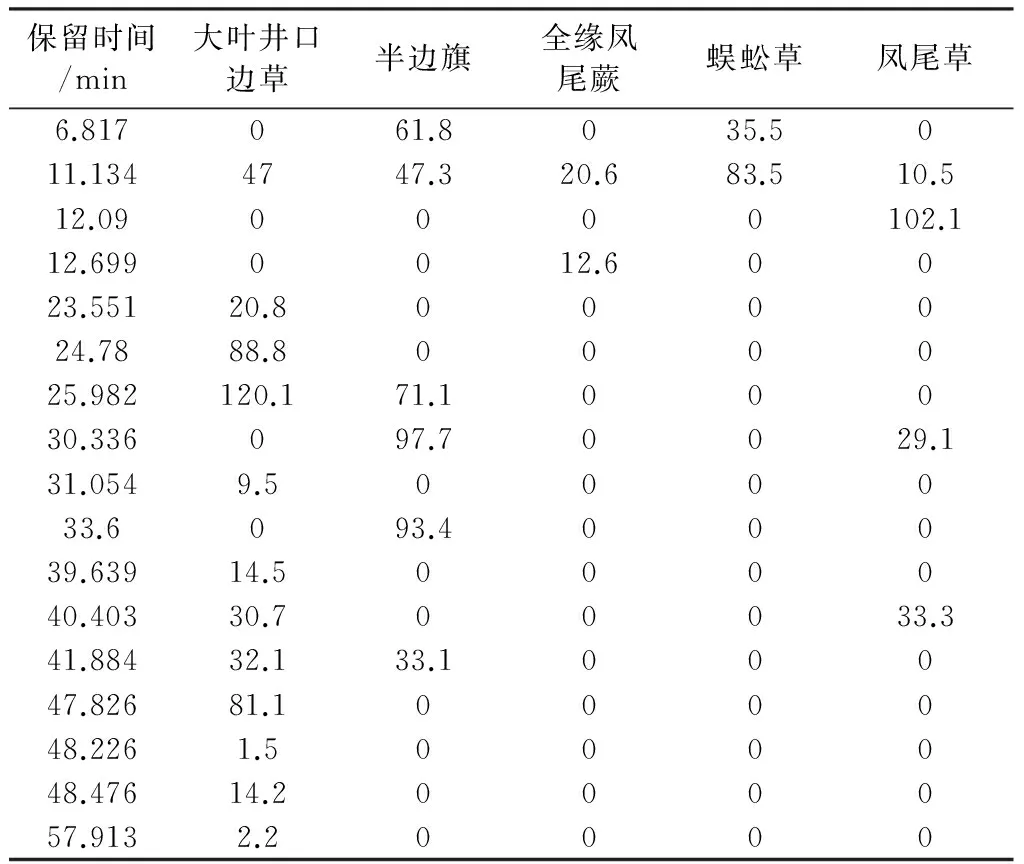
表4 五种凤尾蕨属药材水部位蕨素类
从凤尾蕨属5种药材大叶井口边草、半边旗、全缘凤尾蕨、蜈蚣草和凤尾草中分别检测出蕨素类成分59、39、3、7和22个,总色谱峰面积分别为32 984.1、16 120、49.8、341.2和3 875.1。总体来看大叶井口边草中蕨素类成分含量最高,而全缘凤尾蕨中蕨素类成分含量最低。
3 讨 论
凤尾蕨属5种药用植物石油醚、乙酸乙酯、正丁醇部位、水部位蕨素和总蕨素类成分聚类分析结果基本一致。结果显示:5 种药用植物聚成3类: 第Ⅰ类为全缘凤尾蕨、蜈蚣草和凤尾草; 第Ⅱ类为半边旗;第Ⅲ类为大叶井口边草。半边旗与全缘凤尾蕨、蜈蚣草和凤尾草之间的化学亲缘关系较远。根据中国植物志,全缘凤尾蕨、蜈蚣草、凤尾草和大叶井口边草同属于凤尾蕨组,而半边旗属于篦形凤尾蕨组。聚类分析结果与传统分类结果有较好的一致性。聚类分析结果表明凤尾蕨组的大叶井口边草与同组其它3种距离较远, 可能因为产地差异原因或本身因
素导致,值得进一步研究。凤尾草与大叶井口边草同属凤尾蕨组,从植物形态上区分十分困难。结果表明,本方法可明显区分这两种植物。总体来看大叶井口边中蕨素类成分含量最高,而全缘凤尾蕨中蕨素类成分含量最低。研究表明,蕨素类成分HPLC图谱可用于凤尾蕨属植物的分类和鉴别研究,并可为凤尾蕨属药用植物质量控制提供重要参考。
[1] 中国科学院中国植物志编委会. 中国植物志:第3卷第1分册[M]. 北京: 科学出版社. 1990:10.
[2] 秦仁昌,吴兆洪. 中国凤尾蕨属植物[C]//中国科学院华南植物研究所集刊(第1集),1983.
[3] 龚先玲, 陈志红, 梁念慈. 凤尾蕨属植物化学成分及药理活性研究进展[J]. 中国中药杂志,2007, 32(14): 1382-1387.
[4] Jicheng Shu, Jianqun Liu, Youquan Zhong, et al. Two new pterosin sesquiterpenes from Pteris multifida Poir[J]. Phytochemistry Letter, 2012, 5(2): 276-279.
[5] Jianqun Liu, Jicheng Shu, Rui Zhang, et al. Two new pterosin dimers from Pteris mutifida Poir[J]. Fitoterapia, 2011,82(8):1181-1184.
[6] 舒积成,潘景行,张锐,等. 凤尾草中倍半萜类成分研究[J]. 中成药, 2011,33(12):2104-2107.
[7] 舒积成,张锐,张维,等. 凤尾草中黄酮类化学成分研究[J]. 中成药,2012, 34(6):1122-1126.
[8] 李金华,梁念慈,莫丽儿,等. 半边旗5 种成分体外细胞毒活性比较及构效关系分析[J].药学学报,1998, 33(9): 641-644.
[9] 吕应年,邓亦峰,李彩虹,等. 常压硅胶柱层析分离制备高纯贝壳杉烷型二萜[J]. 化学与生物工程,2006,23(9): 60-62.
[10] 许柑叶, 郑怡, 陈晓清. 8种蕨类植物多糖提取物抑菌效果的研究[J] . 福建师范大学学报, 2005, 21(2 ): 99.
[11] 高书亮,卢元元,安利娟,等. 野漆树苷对雷公藤甲素诱导肝损伤的保护作用[J]. 中药药理与临床,2012, 28(6):18-20.
[12] 周向军,高义霞,杨宗琪,等. 蜈蚣草总黄酮体外抗氧化作用的研究[J]. 资源开发与市场,2010, 26(4):294-296.
[13] Ouyang D W, Ni X, Xu H Y, et al. Pterosins from Pteris multifida [J]. Planta Medica, 2010, 76, 1896-1900.
[14] Helen S, Neil F, Ronan F. Smooth muscle relaxant activity of pterosin Z and related compounds [J]. Planta Medica, 1999, 65(3), 271-272.
[15] Akio K, Hiroshi E, Koichi K, et al. Antimicrobial constituents in Pteris inaequalis [J]. Agricultural and Biological Chemistry, 1975, 39(9), 1851-1856.
[16] Wu Q, Yang X W. The constituents of Cibotium barometz and their permeability in the human Caco-2 monolayer cell model [J]. Journal of Ethnopharmacology, 2009, 125(3): 417-422.
[17] 徐凤麟,刘兴华,汪炳钧. 蕨素化合物用于治疗糖尿病及肥胖之用途:中国,ZL201080005473.0[P]. 2013-12-18.
[18] Satake, Toshiko; Murakami, Takao; Yokote, Nobuaki; et al. Chemical and chemotaxonomical studies on Filices. LVIII. Chemical studies on the constituents of Monachosorum arakii Tagawa (Pteridaceae) [J]. Chemical & Pharmaceutical Bulletin, 1985, 33(10): 4175-4181.
[19] Kuraishi, Tadayuki, Murakami Takao, Taniguchi Takao, et al. Chemical and chemotaxonomical studies of ferns. LIV. Pterosin derivatives of the genus Microlepia (Pteridaceae) [J]. Chemical & Pharmaceutical Bulletin, 1985, 33(6): 2305-2312.
[20] 刘建群,舒积成,张锐,等. 蕨素的电喷雾质谱裂解规律及紫外光谱特征[J]. 光谱实验室, 2013, 30(4), 1954-1959.
Study on the Chemotaxonomy of GenusPterisbyCluster Analysis of Pterosins
Liu Jianqun, Liu Jian
(Key Laboratory of Modern Preparation of TCM, Ministry of Education, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China)
Objective: To study on the chemotaxonomy ofPterisby cluster analysis of pterosins. Methods: The HPLC-DAD method was established for the determination of the pterosins in fivePterisspecies. A cluster analysis of the characteristic pterosins was used for the chemotaxonomy of thesePterisspecies. Results: 59, 39, 3, 7 and 22 pterosins were identified by HPLC-DAD fromPteriscreticaL. var.nervosa,Pterissemipinnata,Pterisinsignis,PterisvittataandPterismultifida, respectively. Pteris cretica L. var.nervosashowed the highest amount of pterosins andPterisinsignis showed the lowest content of pterosins in five species. A cluster analysis of these species ofPterisindicated that they were divided into three groups:Pterisinsignis,PterisvittataandPterismultifidawere classified into group Ⅰ,Pterissemipinnatain group Ⅱ,PteriscreticaL. var.nervosain group Ⅲ, respectively. Conclusion: The significant differences betweenPterisinsignis,Pterisvittata,PterismultifidawithPterissemipinnatawere observed.The obtained results were in agreement with the traditional taxonomic study.The result indicted that the above method can be used to authenticate, classify and quality controlPterisspecies.
Pterisgenus; pterosin; HPLC; cluster analysis; chemotaxonomy
2015-03-28
国家自然科学基金资助项目(30960495)。
刘建群(1970-),男,教授,博士,主要从事中药活性成分及质量评价研究。E-mail:liu5308@sina.com
10.3969/j.issn.1006-9690.2015.05.002
R284.1
A
1006-9690(2015)05-0004-05

