不同处理对海蓬子种子萌发的影响及其最佳萌发条件的研究
张 晶,乔 星,倪伟超,李 彪,王 超,倪 穗
(宁波大学 海洋学院,浙江 宁波 315211)
不同处理对海蓬子种子萌发的影响及其最佳萌发条件的研究
张晶,乔星,倪伟超,李彪,王超,倪穗*
(宁波大学 海洋学院,浙江 宁波 315211)
海蓬子(SalicorniabigeloviiTorr.)是一种耐盐极强的肉质植物,可以开发改良为直接用海水灌溉的食用和油用经济植物。本文针对海蓬子种子萌发率低的问题,采用不同浓度 NaCl浸种、不同浓度海水培育,高盐胁迫下不同浓度外源GA3处理方法进行海蓬子种子萌发研究,通过单因素实验和正交试验,得出最佳的种子萌发条件。结果表明:海蓬子种子经过 2 g·L-1NaCl浸种1天后,在海水浓度为10%,添加外源GA3为15 mg·L-1条件下,萌发率和发芽指数最高,为33%和20.7%。研究发现,海蓬子种子在低浓度的海水中萌发效果好,适宜浓度范围的外源GA3,能够减弱盐胁迫的影响,促进海蓬子种子的萌发,一定浓度范围内的NaCl浸种预处理有助于促进海蓬子种子的萌发率和发芽指数。
海蓬子;种子萌发;海水;GA3;NaCl
海蓬子(SalicorniabigeloviiTorr.)属于藜科(Chenopodiaceae)海蓬子属(Salicornia),一般生长在盐沼地,盐湖旁及海滩,属于肉质化的真盐生植物。原产于美国西部海滨,经美国亚利桑那大学培育、改良为耐盐极强可以直接用海水灌溉的植物。 目前在我国辽宁、河北、山西、陕西、宁夏、甘肃、山东、江苏等省(区)也有广泛的分布[1]。海蓬子具耐盐碱、耐涝等特点,并且具有很高的经济价值[2-3];同时,还可以作为生物过滤器去除海水养殖中的营养盐[4-6],但海蓬子的种子萌发率较低,限制了它的推广应用。因此,探讨海蓬子种子萌发问题,对于生态脆弱的盐碱地区的经济植物种植与养殖废水的处理净化具有重要的意义。
有关海蓬子种子萌发的研究目前还刚起步,已有资料仅涉及温度、pH值、NaCl、外源激素等因素对海蓬子种子萌发的影响[7-13]。但对于海水,GA3,NaCl预浸种等因素综合作用影响海蓬子种子萌发及最适萌发件等方面的研究还未见报道。本研究采用不同海水浓度胁迫下,经过不同浓度GA3和不同浓度的NaCl浸种预处理后,海蓬子种子萌发情况,并探究3个因素共同影响下的最佳萌发条件,实验结果对海蓬子的开发利用提供理论依据。
1 材料与方法
1.1材料与预处理
海蓬子种子购于江苏盐城绿苑海蓬子有限责任公司,固体海水购于浙江省杭州市蓝海星盐制品有限公司,pH值为6.0,矿化度约为30 g·L-1。
挑选饱满一致的种子,将种子以3%的KMnO4进行表面消毒2 h[14]。将消毒后的种子用蒸馏水清洗,洗去表面残留的消毒液,晾干,4℃冰箱保存,备用。
1.2研究方法
1.2.1种子萌发方法采用培养皿纸上法,参照《国际种子检验规程》[15]。在洗净、烘干的培养皿中放入3张滤纸,用各处理液润湿,每皿放置25粒种子,各处理有3组重复。将各处理组的种子放置在人工气候培养箱,萌发温度为25 ℃,相对湿度为70%,光照8 h,光照强度为100 μmol/(m2·s)。每天观察记录发芽种子,并补充蒸发的溶液,使实验中溶液浓度维持相对不变。
1.2.2海水处理海水浓度梯度设置:0(CK )、20%,40%,60%,80%,100%的海水溶液,共6个处理。用不同浓度的海水溶液浸润滤纸,放入种子。置于培养箱内。
1.2.3外源GA3处理在40%浓度海水中加入不同浓度的GA3,浓度梯度设置:0(CK),5,10,20, 30,40 mg·L-1,共6个处理组进行种子萌发试验。
1.2.4NaCl浸种预处理后种子的萌发NaCl溶液梯度设置: 0(CK),4,6,8,12 ,14 g·L-1,浸种1天,然后将种子置于40%的海水中进行萌发试验。
1.2.5海蓬子种子萌发的正交试验在单因素试验的基础上,以海水浓度、GA3浓度、NaCl浸种预处理浓度为变量,以海蓬子种子的最终萌发率为指标,选取各因素较优区,采用L9(33)正交表,对海蓬子种子最佳萌发处理进行研究。
1.3测定方法
发芽率=发芽种子数/供试种子数×100%
发芽指数(GI)=∑Gt/Dt(Gt为在第t天的种子发芽数,Dt为相对的种子发芽天数)
所有数据均用Sigma Plot统计并制图。应用SAS 8.1统计分析软件对不同处理下的发芽率、发芽指数指标进行差异显著性分析。
2 结果与分析
2.1不同海水浓度对海蓬子种子萌发率和发芽指数的影响
2.1.1不同海水浓度对海蓬子种子萌发率的影响
由图1可见,海蓬子种子的萌发率随着海水浓度的升高,先增加后降。在培养12天后,发芽率基本稳定。
海蓬子种子在清水中的萌发率为17.3%,在20%浓度的海水中萌发率最高为24%,当海水浓度为40%时,海蓬子种子的萌发率明显降低,发芽率仅为14%,并且随着海水浓度的增加,其萌发率降低。可见,20%左右的海水有利于海蓬子种子的萌发。海水对海蓬子种子萌发的抑制,不仅表现在降低萌发率,还表现在使海蓬子种子的萌发时间受到推迟,海水浓度越高,推迟时间越长。海蓬子种子在清水中,第3天开始萌发,在海水浓度为20%时,萌发时间在第4天,当海水浓度达到100%时,海蓬子种子在第8天萌发,并且萌发受到严重抑制,仅为2%。

图1 海蓬子种子在不同浓度海水中的萌发率
2.1.2不同海水浓度对海蓬子种子发芽指数的影响
发芽指数体现了种子的发芽速度和整齐度。图2为培养12天,海蓬子种子的发芽指数。海蓬子种子的发芽指数随着海水浓度的增加也是呈先增后降的趋势,清水中海蓬子种子的发芽指数为19.16%,20%海水中发芽指数最高为20.72%,当海水浓度为40%时,其发芽指数为9.8%,显著降低,100%海中发芽指数最低为1%。
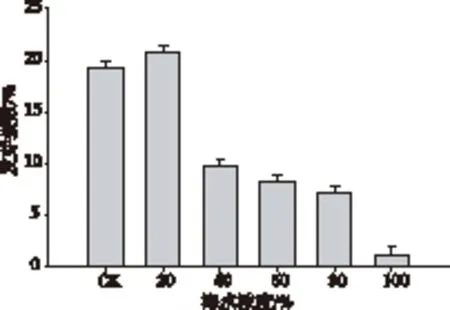
图2 海蓬子种子在不同海水浓度中的发芽指数
2.2不同浓度GA3对海蓬子种子萌发和发芽率的影响
2.2.1不同浓度GA3对海蓬子种子萌发的影响
图3是不同浓度GA3加入到在40%浓度海水的海蓬子种子中,其萌发情况。由图3可见加入不同浓度GA3后,海蓬子种子的萌发率随着赤霉素浓度的增加先增高后降低。在第12天赤霉素添加浓度为10 mg·L-1和20 mg·L-1时海蓬子种子萌发率分别为18%和16%,均高于对照组(14%)。赤霉素浓度达到3 mg·L-1时,萌发率为10%,明显低于对照组,并且降低趋势明显。实验结果可见,赤霉素的添加有助于缓解盐胁迫对海蓬子种子萌发的影响,在一定程度上提高其萌发率。
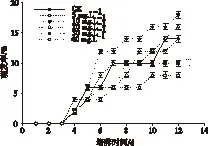
图3 不同浓度GA3+海水处理下海蓬子种子的萌发率
2.2.2不同浓度GA3对海水中的海蓬子种子发芽指数的影响
从图4可以明显看出,在40%浓度海水中随着赤霉浓度的增加对海蓬子种子发芽指数的同样呈先增加后降低的趋势,在赤霉素浓度为10 mg·L-1时,发芽指数最高为13.3%。当赤霉素添加浓度超过20 mg·L-1时,海蓬子种子的发芽指数低于对照,生长开始受到抑制。
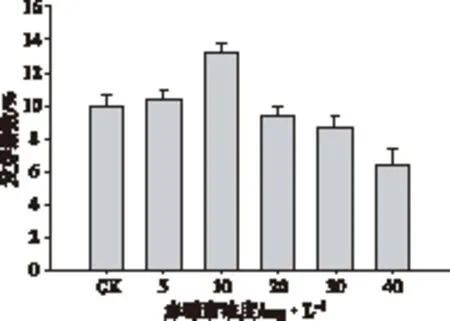
图4 不同浓度GA3+海水处理下海蓬子种子的发芽指数
2.3不同浓度NaCl浸种处理后对海蓬子种子的萌发率和发芽指数的影响
2.3.1不同浓度NaCl浸种处理后对海蓬子种子的萌发率的影响
图5是不同浓度NaCl浸种处理后的海蓬子种子在40%海水中的萌发率。从图5可见不同浓度的NaCl浸种预处理对海蓬子种子在高浓度海水中的萌发有促进作用。其萌发率呈先增加后降低趋势,在 NaCl预处理浓度为12 g·L-1时,种子的萌发率达到最高为18%。在浓度为14 g·L-1时,萌发率开始降低为16%,但均高于对照组(14%)。但是NaCl浸种预处理对海蓬子种子的萌发存在有滞后效应,从图5可以看出,当NaCl浓度高于6 g·L-1后,海蓬子种子滞后一天,也就是在第5天开始萌发。
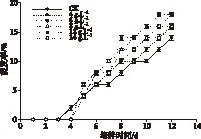
图5 不同浓度NaCl浸种预处理后海蓬子种子 在海水中的萌发率
2.3.2不同浓度NaCl浸种预处理后对海蓬子种子的发芽指数的影响
由图6 可见,不同浓度的NaCl浸种预处理,提高了海蓬子种子在高浓度海水中的发芽指数。其发芽指数与萌发率同样呈先增加后降低趋势,但均高于对照组发芽指数9%,在 NaCl预处理浓度为12 g·L-1时,种子的发芽指数达到最高为11.72%。
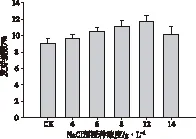
图6 不同浓度NaCl浸种预处理后海蓬子种子 在海水中的发芽指数
2.4海蓬子种子萌发的正交试验及其方差分析
从三组单因素实验中,选出3个不同影响因素合适的水平范围,建立成因素水平表1。

表1 正交实验水平表
按照正交实验L9(33)设计的方案,以海蓬子种子培养12天的最终萌发率为指标,得出正交分析表,如表2。
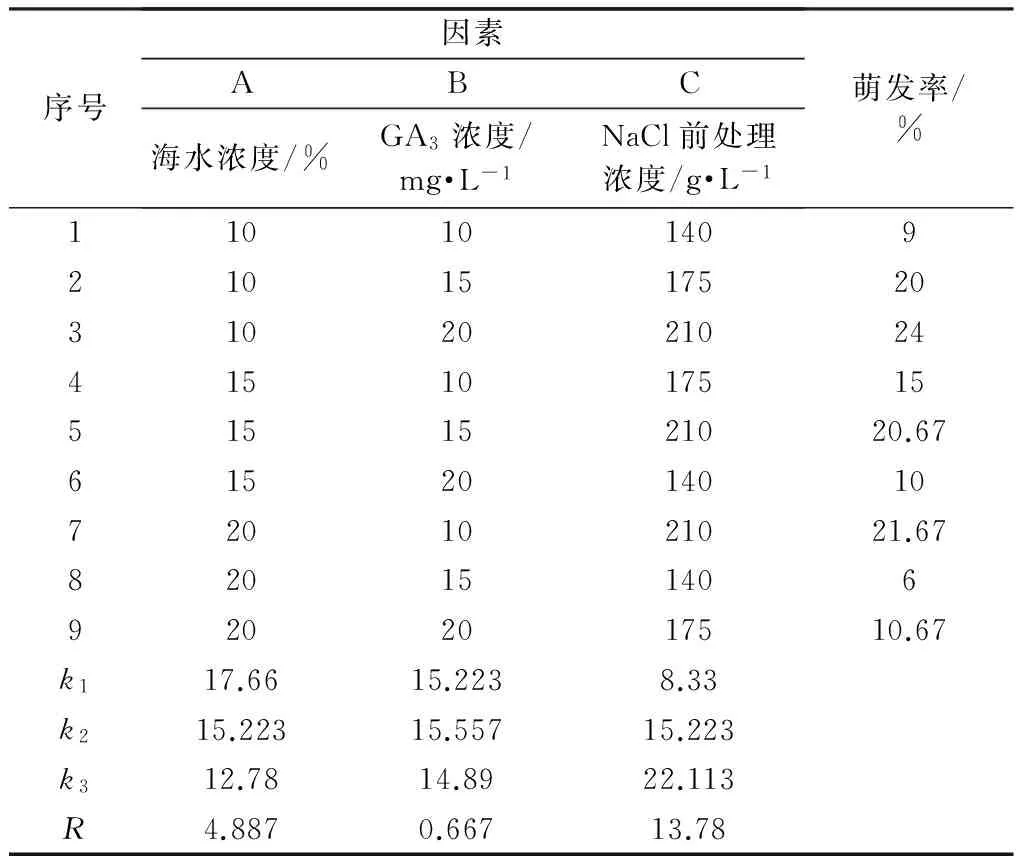
表2 正交实验L9(33)设计及其结果分析
选择各因子在同一水平下的平均试验指标之和k最高的为最优水平,从结果分析中挑选最佳的萌发试验条件,为A1B2C3,即海水浓度为10%,添加浓度为15 mg·L-1外源GA3,12 g·L-1NaCl浸种预处理。因素的影响顺序为:NaCl预浸种浓度>海水浓度>外源GA3浓度。
从方差分析表3中,可以看出对于因素A:P<0.001,对于因素B:P=0.001 5<0.05,对于因素C:P<0.001,说明选择的三个因素对海蓬子种子萌发的影响显著。
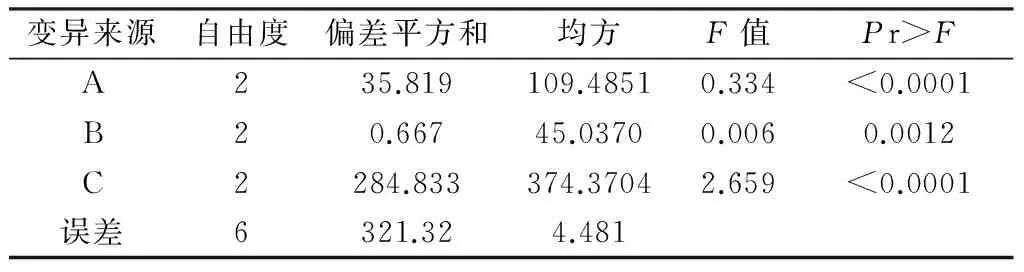
表3 方差分析表
2.5验证实验
以最优萌发条件,按照1.2.1中的培养方法,计算海蓬子种子12天最终萌发率和发芽指数。结果见表4。
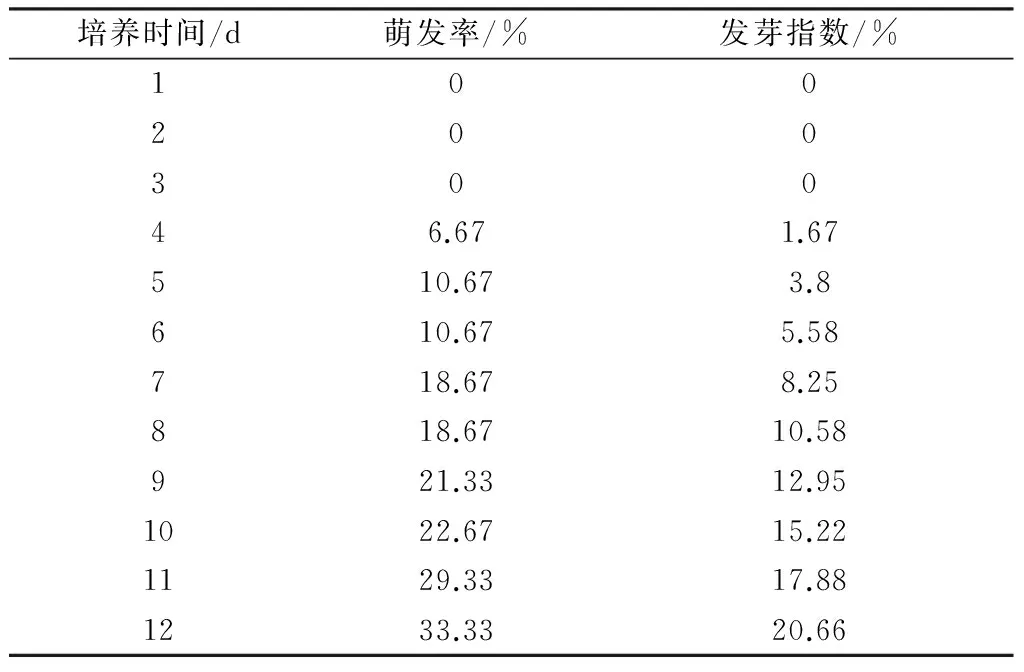
表4 萌发最优条件的验证
3 讨论与结论
3.1低浓度的海水有助于海蓬子种子的萌发
海蓬子在种植时可以用全海水灌溉也可以用不同浓度的海水灌溉。从研究结果来看,海蓬子种子在萌发时全海水对其有一定的抑制作用,许多研究有类似的发现[8,10,16]。而低浓度的海水则有助于海蓬子种子的萌发,由实验结果看海蓬子种子在20%的海水中,萌发率和萌发指数均高于清水对照组。原因可能是由于低盐环境能够刺激海蓬子种子中脯氨酸等其他可溶性物质的积累,提高细胞内部的渗透压,增加种子的吸水能力,还有可能改变细胞膜质蛋白的功能,细胞从外界环境中吸收无机离子,降低细胞水势,促进种子吸水萌发。尽管一定浓度的盐分有助于盐生植物海蓬子的萌发,但其萌发时间会受到延迟,这是其种子在萌发阶段受到盐胁迫时发生休眠所致。盐生植物在盐分较高时不萌发,当环境适宜时再萌发,这样可以在一定程度上避免植株受到高浓度盐分胁迫致死的可能,是盐生植物自我保护的机制[17]。
3.2GA3对海水处理下的海蓬子种子萌发有促进作用
一定浓度的GA3有助于海蓬子种子在盐胁迫下的萌发,研究表明GA3浓度为10 mg·L-1时,海蓬子种子在40%海水中的萌发率和发芽指数最高。赤霉素能够提高盐胁迫下海蓬子种子的萌发率。这可能是由于GA3能够打破盐胁迫下种子的休眠,可以增加体内脯氨酸的积累,增强海蓬子种子自身抗胁迫能力[18-19]。赤霉素浓度超过20 mg·L-1时,其发芽率和发芽指数明显下降,表现为抑制作用,外源赤霉素的加入可以调节海蓬子种子中的激素水平,但是种子的萌发还受多种激素的共同调控,加入过多的外源赤霉素,可能会破海蓬子种子的激素调控机制,反而不利于种子的萌发。
3.3NaCl浸种预处理后对海蓬子种子的萌发有一定影响
盐胁迫下,植物种子的萌发生长与渗透胁迫和离子毒害有关,曾幼玲等[20]研究认为盐生植物中起主要抑制作用的是渗透胁迫而不是离子毒害,而张万钧等[21]认为影响盐生植物种子萌发的因素不仅仅是渗透胁迫,NaCl可能对在种子萌发中起关键作用的一些酶的活动有抑制作用。经NaCl短时间浸种预处理后海蓬子种子的萌发率和发芽指数表现为增加,说明一定浓度短时间的NaCl浸种有利于提高海蓬子种子的耐盐性,在NaCl浓度为12 g·L-1处理下,其萌发率和发芽指数最大,浓度高于12 g·L-1后,种子的萌发率和发芽指数呈下降趋势。这可能与种子在盐浸种下,种子内部调节渗透平衡的物质积累有关。杨景宁等[13]研究发现短时间NaCl浸种预处理能够促进黎科的某些植物的复萌,其机理还有待进一步的研究。
3.4海蓬子种子最佳萌发条件的确定
通过单因素实验及其正交实验,确定海蓬子种子萌发的最佳条件为:10%海水, 15 mg·L-1外源GA3,12 g·L-1NaCl浸种预处理。三中因素的影响顺序为:NaCl浸种预处理浓度﹥海水浓度﹥外源GA3浓度,在最优条件下,海蓬子的萌发率为33.3%,发芽指数为20.7%。
综上所述,海蓬子种子的萌发受季节的显著,且发芽率不高。在实验室培养条件下,低浓度海水对其种子萌发比较有利,添加一定浓度外源GA3,有助于促进种子的在高浓度海水中的萌发,减轻盐胁迫作用,并且短时间的NaCl浸种预处理,能够提高海蓬子种子的耐盐性,但其具体机理研究尚少,有待于进一步深入探讨。
[1]洪立洲, 蒋海荣,杨智青,等.盐生植物海蓬子的研究进展及前景展望[J].江西农业学报,2008, 20 (7) : 46-48.
[2]周泉澄,华春,周峰,等.毕式海蓬子和盐角草幼苗抗氧化酶与渗透物质对海水浇灌的适应性研究[J].中国草地学报,2010, 32 (5) : 101-105.
[3]吕忠进. 全海水灌溉的作物[J].世界农业, 2001(2) : 14-16.
[4]BROWN J J, GlENN E P, FITZSIMMONS K M, et al.Halophytes for the treatment of saline aquaculture effluent[J]. Aquaculture, 1999, 175 : 255-268.
[5]BROWN J J, GlENN E P. Reuse of highly saline aquaculture effluent to irrigate a potential forage halophyte, Suaeda esteroa[J].Aquacultural Engineering, 1999, 20 : 91-111.
[6]郑春芳,陈琛,彭益全, 等. 海水养殖废水灌溉对碱蓬和海蓬子生长和品质的影响[J]. 浙江农业学报, 2012, 24( 4) : 663-669.
[7]华春,周泉澄,周峰, 等. 毕氏海蓬子种子萌发及幼苗生长对盐分和水分胁迫的响应[J].湖北农业科学, 2010,49(8) : 1853-1855.
[8]周泉澄, 华春, 张玉飞, 等. 海水对毕氏海蓬子(SalicorniabigeloviiTorr. )种子萌发及幼苗生长的影响[J]. 南京晓庄学院学报, 2006(6) : 48-52.
[9]郑青松, 刘兆普, 刘友良, 等. 盐和水分胁迫对海蓬子、芦荟、向日葵幼苗生长及其离子吸收分配的效应[J]. 南京农业大学学报, 2004, 27 (2) : 16-20.
[10]余桂红, 曹君, 马鸿翔. NaCl和pH值对北美海蓬子种子萌发的影响[J]. 江苏农业科学, 2009 (2) : 88-90.
[11]姜丹, 李银心, 黄凌风, 等. 盐度和温度对北美海蓬子在厦门海区引种以及生长特性的影响[J] . 植物学通报, 2008, 25 (5) : 533 -542.
[12]AYALA F, OLEARY J W. Growth and physiology of Salicornia bigelovii Torr. at suboptimal salinity[J]. International Journal of Plant Sciences, 1995, 156 : 197-205.
[13]杨景宁, 王彦荣. NaCl胁迫对四种荒漠植物种子萌发的影响[J]. 草业学报, 2012, 5 (21): 32-38.
[14]华春, 周泉澄, 吴雨龙. 不同消毒剂对毕氏海蓬子种子萌发的影响[J]. 安徽农学通报, 2007, 13 (23) : 138-139.
[15]国际种子检验学会(ISTA). 国际种子检验规程[S]. 北京: 技术标准出版社, 1980: 145-183.
[16]李海云, 赵可夫, 王秀峰. 盐对盐生植物种子萌发的抑制[J], 山东农业大学学报( 自然科学版) , 2002, 33 (2) : 170-173.
[17]WAISEL Y. Biology of halophytes[ M] . New York: Academic Press, 1972.
[18]BEGUM F, KARMOKER J L, FATTAH Q A, et al. The effect of salinity on germination and its correlation with K+, Na+, Cl-accumulation in germination seeds of Triticum aestrium[ J] . Plant Cell Physiol, 1992, 33 (7) : 1007- 1014.
[19]华春, 周泉澄, 王小平, 等. 外源GA3对盐胁迫下北美海蓬子种子萌发及幼苗生长的影响[J], 南京师大学报(自然科学版), 2007, 30 (1) : 82-87.
[20]曾幼玲, 蔡忠贞, 马纪, 等.盐分和水分胁迫对两种盐生植物盐爪爪和盐穗木种子萌发的影响[J]. 生态学杂志, 2006, 25 (9) : 1014-1018.
[21]张万钧, 王斗天, 范海, 等.盐生植物种子萌发的特点及其生理基础[J].应用与环境生物学报, 2001, 7 (2) : 117-121.
Study on Effects of Different Treatments on Seed Germination ofSalicorniabigeloviiand Its Optimum Germination Conditions
Zhang Jing, Qiao Xing, Ni Weichao, Li Biao, Wang Chao, Ni Sui*
(School of Marine Science, Ningbo University, Ningbo 315211, China)
This article aims at the question ofSalicorniabigeloviilow germination rate, its seed germination was studied by using different concentration NaCl solutions soaking, different concentration sea water and different concentrations of exogenous GA3with high salt stress. The optimum germination conditions were analyzed through a single-factor test and orthogonal experiment. The results indicated that theS.bigeloviiseed germination percentage and index were the best under concentration of 10 % sea water and 15 mg·L-1exogenous GA3after one day presoaking in 2 g·L-1NaCl solution, which was 33% and 20.7%. The study also found thatS.bigeloviiseed germination was better in low concentration sea water, appropriate concentration range of exogenous GA3could weaken the influence of salt stress and promote theS.bigeloviiseed germination capability, the seeds presoaked in appropriate concentration NaCl solutions could improve their germination percentage and index.
Salicorniabigelovii; seed germination; sea water; GA3; NaCl
2015-03-18
浙江省公益技术应用研究计划项目(2015C32004);宁波市科技富民项目(2015C10062)。
张晶(1990—),女,硕士。E-mail:13857478403@163.com
*通讯作者:倪穗(1965—),女,教授,研究方向:植物生物技术。E-mail:nisui@nbu.edu.cn
10.3969/j.issn.1006-9690.2015.06.009
Q945.34
A
1006-9690(2015)06-0032-05

