针刺预处理对脑梗死大鼠胆碱能抗炎通路的影响研究
秦彦强,孙忠人,张亚娟,高利权,史术峰
·论著·
针刺预处理对脑梗死大鼠胆碱能抗炎通路的影响研究
秦彦强,孙忠人,张亚娟,高利权,史术峰
目的探讨针刺预处理对脑梗死大鼠胆碱能抗炎通路(CAP)的影响。方法选择40只健康成年SD雄性大鼠,采用随机数字表法将大鼠分为正常组(A组)、假手术组(B组)、脑梗死组(C组)、针刺预处理组(D组)和针刺预处理+甲基牛扁亭(MLA)组(E组),各8只。A组大鼠不做任何处理;B组大鼠只切开皮肤,暴露颈总动脉、颈外动脉、颈内动脉,不插入线栓,术后缝合皮肤;C组大鼠采用改良Zea Longa方法制备脑梗死模型;D组于造模前7 d开始针刺治疗;E组大鼠于针刺同时腹腔注射MLA,5 mg/kg,1次/d,连续治疗7 d。各组大鼠于造模成功后同步饲养,自由饮食,3 d后处死。于处死前采用Longar 5分制评分法进行神经功能评分;取处死大鼠新鲜脑组织顶叶皮质采用甲醛固定,采用TUNEL法检测细胞凋亡情况;剩余脑组织采用液氮保存,采用酶联免疫吸附试验(ELISA)检测TNF-α、IL-1β水平,采用实时定量荧光PCR检测α7烟碱型乙酰胆碱受体(α7nAChR)mRNA表达情况。结果C组、D组、E组大鼠TUNEL阳性细胞多于A组和B组,脑组织中TNF-α、IL-1β水平高于A组和B组(P<0.05);C组和E组大鼠α7nAChR mRNA相对表达量低于A组和B组(P<0.05);D组大鼠TUNEL阳性细胞少于C组和E组,神经功能评分低于C组和E组,脑组织中TNF-α、IL-1β水平低于C组和E组,α7nAChR mRNA相对表达量高于C组和E组(P<0.05)。结论针刺预处理可以改善脑梗死大鼠神经功能,抑制神经元凋亡,降低炎性细胞因子水平,上调α7nAChR mRNA的表达。
脑梗死;针刺穴位;细胞凋亡;炎症趋化因子;胆碱能抗炎通路;大鼠
秦彦强,孙忠人,张亚娟,等.针刺预处理对脑梗死大鼠胆碱能抗炎通路的影响研究[J].实用心脑肺血管病杂志,2015,23(3):29-33.[www.syxnf.net]
Qin YQ,Sun ZR,Zhang YJ,et al.Impact of acupuncture preconditioning on cholinergic anti-inflammatory pathway in rats with cerebral infarction[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(3):29-33.
随着经济的发展,人口老龄化进一步加重,目前脑血管疾病已成为我国三大致死性疾病之一[1]。脑血栓形成在脑血管疾病中占1/3,由于中枢神经元损伤不可逆、无法自然恢复而遗留残疾,重则危及患者生命。因此,许多专家学者意识到,最大限度地提高脑损伤耐受能力可能是阻断脑血管疾病恶性循环的有力手段。缺血耐受的提出为脑梗死的预防性治疗提供了广阔的思路,也提出了多种预处理方式诱导脑缺血耐受。但脑缺血耐受的具体脑保护作用机制尚未明确,值得肯定的是炎性反应在缺血性脑损伤中占重要地位[2],且贯穿于脑缺血性损伤病理发展的始终,在脑损伤早期局部脑组织就会大量释放炎性因子[3]。因此,针对急性缺血性脑卒中神经炎症通路的定向治疗已成为转化医学研究的重要课题[4]。
近期研究发现,胆碱能抗炎通路(cholinergic antiinflammatory pathway,CAP)是一种神经-免疫调节通路。CAP的激活能够有效减少机体内多种促炎因子的释放,在全身和局部炎性反应过程中均存在明显的抑制作用。CAP发挥作用的中枢环节是抑制乙酰胆碱(Ach)与免疫细胞上的α7烟碱型乙酰胆碱受体(α7nAChR)结合,激活核转录因子κB(NF-κB)信号通路和蛋白酪氨酸激酶2与信号转导和转录激活子3(JAK2/ STAT3)信号通路,从而抑制机体内细胞因子和趋化因子的产生与释放[5]。本研究的前期研究结果证实,针刺风池穴预处理可以改善脑梗死大鼠神经功能、诱导脑缺血耐受,但针刺风池穴诱导脑缺血耐受的具体机制尚需进一步明确。因此,本研究探讨了针刺预处理对脑梗死大鼠CAP的影响,试图从CAP角度揭示针刺预处理脑保护作用的机制。
1 材料与方法
1.1 实验动物选用健康成年SD雄性大鼠40只,由黑龙江中医药大学实验动物中心提供,平均体质量(330±10)g,合格证号为黑201302415号。
1.2 主要试剂TUNEL测试试剂盒(美国Roche公司,批号:11772465001),DBA工作液现用现配;DEPC (美国Sigma公司);甲基牛扁亭(MLA)(美国Sigma公司);TransZol Up(北京全式金生物技术有限公司);反转录试剂盒TAKAR(大连宝生物);实时定量荧光PCR试剂盒TAKARA(大连宝生物);α7nAChR及βactin mRNA引物由上海生物工程技术服务有限公司合成;肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)酶联免疫吸附试验(ELISA)试剂盒(伊莱瑞特生物科技有限公司)。
1.3 主要仪器酶标仪(450 nm波长滤光片):北京博仪恒业科技发展有限公司;光学显微镜(MCL-300):美佳朗;电热恒温箱(DHP-9052):上海一恒公司;华佗牌针灸针(0.25×25 mm):苏州医疗用品厂有限公司;高精度移液器(WKYIII-5):上海佳安分析仪器厂;实时定量荧光PCR仪(ABI-7500):美国ABI公司。
1.2 实验方法
1.2.1 分组方法采用随机数字表法将大鼠分为正常组(A组)、假手术组(B组)、脑梗死组(C组)、针刺预处理组(D组)、针刺预处理+MLA组(E组),各8只。A组大鼠同步喂养,不做任何处理;B组大鼠只切开皮肤,暴露颈总动脉、颈外动脉、颈内动脉,不插入线栓,术后缝合皮肤;C组大鼠采用改良Zea Longa方法制备脑梗死模型;D组大鼠于造模前7 d开始针刺治疗;E组大鼠于针刺同时腹腔注射MLA,5 mg/kg,1次/d,连续治疗7 d。
1.2.2 脑梗死动物模型制备方法采用改良Zea Longa[6]方法。动物造模前6 h禁食,10%水合氯醛腹腔麻醉,于颈部距正中线右侧0.5 cm切开颈部皮肤,剥离至暴露颈总动脉、颈内动脉、颈外动脉,结扎颈外动脉及颈总动脉近段,血管夹夹闭颈内动脉,于颈总动脉剪一小口,插入备好线栓,固定,松开动脉夹,将线栓经颈内动脉送入至大脑前动脉,栓塞大脑中动脉,制备左侧大脑中动脉闭塞脑梗死模型。模型制备成功标准:动物清醒后,采用Longar 5分制进行神经功能评分,评分≥2分为模型制备成功。
1.2.3 针刺预处理针刺大鼠双侧“风池”穴,即枕骨后缘夹肌与肩斜方肌之间,左右距前正中线约1 cm处,30 min/次,1次/d,连续针刺7 d。
1.3 实验指标检测各组实验动物于造模成功后同步饲养,自由饮食,3 d后处死。于处死前采用Longar 5分制评分法进行神经功能评分;取处死大鼠新鲜脑组织
顶叶皮质采用甲醛固定,采用TUNEL法检测细胞凋亡情况;剩余脑组织采用液氮保存,采用ELISA检测TNF-α、IL-1β水平,采用实时定量荧光PCR仪检测α7nAChR mRNA表达情况。
1.3.1 Longar 5分制评分标准0分:无神经功能缺损,动物行为正常;1分:提尾时左前肢内收,不能完全伸展;2分:自发行走时向左侧转圈;3分:行走时身体向左侧倾倒;4分:不能自发行走或昏迷。
1.3.2 TUNEL法检测细胞凋亡各实验组大鼠于取材前6 h禁食水,取新鲜脑组织顶叶皮质脑缺血损伤边缘区组织进行甲醛固定,石蜡包埋,应用TUNEL法标记凋亡细胞,具体步骤如下:(1)石蜡切片常规脱蜡至水;(2)滴加胃蛋白酶K(20μg/ml溶于10 mM的Tris/HCL中,pH值7.4~8.0)室温孵育30 min,PBS冲洗2次;(3)标记:擦干样品周围的水,滴加50 μl的Tunel反应混合液,在湿盒中37℃孵育60 min,PBS冲洗3次;(4)信号转化和分析:擦干样品周围的水分,加入50 μl的转化剂POD,在湿盒中37℃孵育30 min,PBS冲洗3次;(5)显色:滴加显色剂DBA,室温下10 min,蒸馏水充分冲洗;(6)苏木素复染1 min; (7)常规脱水透明,中性树胶封片,显微镜下观察。应用Motic Med 6.0病理图像分析系统,每张片随机观察并计数脑损伤区周围组织5个不重复视野,在400倍镜视野下计数脑损伤区周围组织中TUNEL阳性细胞。取平均值作为每个标本高倍视野内的统计数据(个/ HP)。
1.3.3 ELISA法检测脑组织中TNF-α、IL-1β水平各实验组大鼠取梗死边缘脑组织5 mg,液氮保存待用。按照大鼠ELISA试剂盒说明书步骤测定组织TNF-α、IL-1β水平。具体步骤如下:(1)在各孔中加入标准品或样品各100 μl,37℃孵育90 min;(2)倒去孔内液体,加入100 μl生物素化抗体工作液,37℃孵育60 min;(3)洗涤3次;(4)加入100 μl酶结合物工作液,37℃孵育30 min;(5)洗涤5次;(6)加入90 μl底物溶液,37℃孵育15 min;(7)加入50 μl终止液,立即在450 nm波长处测量OD值;(8)计算结果。
1.3.4 实时定量荧光PCR检测α7nAChR mRNA的表达(1)样本RNA提取:取每组大鼠脑组织研磨成粉末,加入1 ml的TriZol试剂,混匀,室温静置5 min,提取总RNA;(2)反转录反应:2 μg RNA按照试剂盒说明进行反转录反应,42℃30 min,85℃5 min;(3) PCR反应:按组分〔SYBR Premix Ex Taq 12.5 μl、PCR Forward Primer(10 μM)0.5 μl、PCR Reverse Primer (10 μM)0.5 μl、DNA模板1.0 μl、灭菌蒸馏水10.5 μl〕分别配制实时定量荧光PCR反应体系,各样品的目的mRNA和内参(GAPDH)分别进行实时定量荧光PCR反应;(4)计算结果:实时定量荧光PCR仪中制备标准品,溶解曲线的吸收峰单一的PCR产物为合格标准品。β-actin基因作为内参基因,分别采集α7nAChR、β-actin扩增各循环荧光信号。Rotor-Gene 6.0版软件收集循环阈值(CT值),目的基因相对mRNA表达量计算按照公式:目的基因相对mRNA表达量=2-△△CT。实时定量荧光PCR基因引物序列见表1。

表1 实时定量荧光PCR基因引物序列Table 1 Sequences of gene primers of real-time PCR
1.4 统计学方法采用SPSS 19.0统计学软件进行数据处理,计量资料以(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验。检验水准α =0.05。
2 结果
2.1 各组大鼠神经功能评分A组和B组大鼠神经功能评分均为0分、C组为(2.17±0.48)分、D组为(1.24±0.58)分、E组为(2.24±0.46)分,C组、D组和E组大鼠神经功能评分比较,差异有统计学意义(F=9.61,P=0.00),其中D组大鼠神经功能评分低于C组和E组,差异有统计学意义(q值分别为5.16、5.55,P<0.05)。
2.2 各组大鼠细胞凋亡情况A组和B组可见少量TUNEL阳性细胞(见图1A),C组(见图1B)、D组(见图1C)和E组(见图1D)3 d时TUNEL阳性细胞较多,但D组阳性细胞数明显少于C组和E组。A组大鼠TUNEL阳性细胞为(10.05±2.15)个/HP、B组为(11.97±2.35)个/HP、C组为(18.34±4.28)个/ HP、D组为(14.57±3.48)个/HP,E组为(17.75 ±3.87)个/HP。各组大鼠TUNEL阳性细胞比较,差异有统计学意义(F=9.27,P=0.00);其中C组、D组、E组大鼠TUNEL阳性细胞多于A组和B组,D组大鼠TUNEL阳性细胞少于C组和E组,差异有统计学意义(P<0.05)。
2.3 各组大鼠脑组织中TNF-α、IL-1β水平及α7nAChR mRNA相对表达量各组大鼠脑组织中TNF-α、IL-1β水平和α7nAChR mRNA相对表达量比较,差异有统计学意义(P<0.05)。其中C组、D组和E组大鼠脑组织中TNF-α、IL-1β水平高于A组和B组,C组和E组大鼠α7nAChR mRNA相对表达量低于A组和B组,差异有统计学意义(P<0.05);D组大鼠
脑组织中TNF-α、IL-1β水平低于C组和E组,α7nAChR mRNA相对表达量高于C组和E组,差异有统计学意义(P<0.05,见表2)。

图1 各组大鼠脑梗死边缘TUNEL阳性细胞情况(TUNEL法染色,×400)Figure 1 TUNEL positive cells in cerebral infarction edge in each group of rat
表2 各组大鼠脑组织中TNF-α、IL-1β水平及α7nAChR mRNA相对表达量比较(±s)Table 2 Comparison TNF-α,IL-1β level of brain tissues and relative expression of a7nAChR mRNA in each group of rat
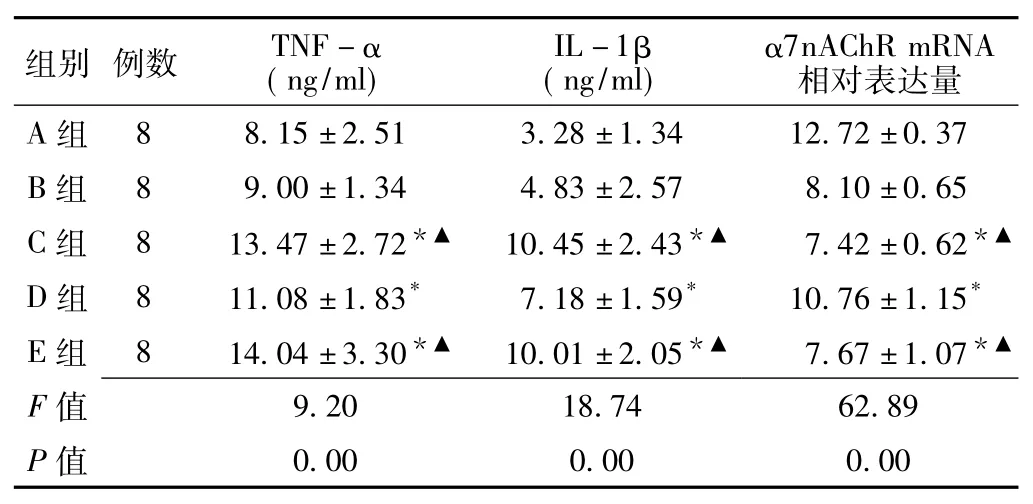
表2 各组大鼠脑组织中TNF-α、IL-1β水平及α7nAChR mRNA相对表达量比较(±s)Table 2 Comparison TNF-α,IL-1β level of brain tissues and relative expression of a7nAChR mRNA in each group of rat
注:A组=正常组,B组=假手术组,C组=脑梗死组,D组=针刺预处理组,E组=针刺预处理+MLA组;TNF-α=肿瘤坏死因子α,IL-1β=白介素1β,α7nAChR=α7烟碱型乙酰胆碱受体;与A组和B组比较,*P<0.05;与D组比较,▲P<0.05
组别例数TNF-α (ng/ml)相对表达量A组(ng/ml)α7nAChR mRNA IL-1β 88.15±2.513.28±1.3412.72±0.37 B组89.00±1.344.83±2.578.10±0.65 C组813.47±2.72*▲10.45±2.43*▲7.42±0.62*▲D组811.08±1.83*7.18±1.59*10.76±1.15*E组814.04±3.30*▲10.01±2.05*▲7.67±1.07*▲F 0.000.000.00 9.2018.7462.89 P值值
3 讨论
“治未病”理论早在《黄帝内经》中就有提及,“未病”一般定义为“体内已有病因存在但尚未致病的人体状态”。治未病与现代医学的预处理理念不谋而合,因此,挖掘治未病手段诱导脑缺血耐受具有现实意义。针刺风池穴可以调节椎基底动脉血流[7],改善脑供血情况及脑血流,可治疗脑供血不足引起的眩晕;还具有降低交感神经紧张度、兴奋迷走神经的作用。但其是否存在诱导CAP而抗细胞凋亡、抑制炎症、改善脑损伤的作用尚不清楚。
缺血性脑血管疾病是以脑动脉粥样硬化为基础、以脑组织缺血缺氧性损伤为主要病理改变的疾病。炎性反应在缺血性脑血管疾病中占重要地位,脑组织发生缺血缺氧可以激活一系列炎性转导机制,导致Toll样受体和核转录因子等被激活,诱导下游产生TNF-α[8]、IL-1β[9]和金属基质蛋白酶9(MMP-9)等,进一步损伤神经元细胞膜和细胞器,使神经元发生肿胀、变性甚至坏死,最终诱导神经元凋亡[10]。
CAP以神经-免疫调节的方式在缺血性脑损伤过程中发挥着重要作用,分布在效应器上的胆碱能受体根据其药理反应可分为毒蕈碱型乙酰胆碱受体(mAChR)和烟碱型乙酰胆碱受体(nAChR),mAChR属于G-蛋白耦联受体家族,nAChR属于离子通道受体家族。多数实验证明,免疫细胞发挥胆碱能调控作用主要与α7nAChR相关,α7nAChR激动剂可抑制局部或全身炎性反应[11]。小胶质细胞在中枢神经系统中可以表达α7nAChR,Shytle等[12]研究表明,烟碱和ACh可阻断LPS介导的小鼠小胶质细胞释放TNF-α。同时烟碱还可以升高小胶质细胞环氧化酶2(COX2)的表达,从而降低细胞炎性因子的表达。这种调控作用可被α7nAChR拮抗剂、α-银环蛇毒素阻断[13]。MLA是α7nAChR拮抗剂,可以抑制星形胶质细胞活化,拮抗α7nAChR的抗炎作用[14]。本研究从CAP方面探讨针刺预处理发挥脑保护作用的具体机制,结果显示C组、D组和E组大鼠造模3 d时神经功能均有缺损,但D组神经功能评分低于C组和E组,提示针刺预处理能更好地改善脑梗死后神经功能缺损程度、发挥脑缺血耐受作用,但针刺预处理的神经保护作用可被α7nAChR拮抗剂MLA所阻断。
细胞凋亡是脑损伤后神经组织细胞发生的一系列生物学特征性改变,在缺血性脑损伤早期,炎性因子导致缺血区脑组织发生大量细胞凋亡,是继发性脑损伤的病理生理过程[15]。TUNEL法可以对凋亡细胞核或凋亡小体进行原位染色,并能准确反映细胞凋亡的生物化学及形态学改变。本研究结果显示,C组、D组和E组大鼠均存在TUNEL染色阳性细胞,但D组TUNEL阳性细胞数少于C组,表明针刺预处理具有抗细胞凋亡作用。但E组大鼠TUNEL阳性细胞与C组接近,且多于D组,提示针刺预处理的抗细胞凋亡作用可以被α7nAChR拮抗剂MLA所阻断。
脑梗死后会发生一系列信号转导机制,众多的促炎因子、抗炎因子均参与了脑梗死的发生发展过程。TNF-α由单核细胞分泌,属于炎性反应中最先激活细
胞因子之一,参与介导细胞凋亡过程。IL-1β是一种重要的炎性因子,发生炎性反应时可进一步激活中性粒细胞及内皮细胞,形成级联式瀑布反应,并最终诱导细胞死亡和凋亡。本研究结果显示,C组和D组大鼠缺血损伤后3 d脑组织中TNF-α、IL-1β水平升高。但D组大鼠脑组织中TNF-α、IL-1β水平低于C组,提示针刺预处理具有减轻脑梗死后炎性反应的作用;E组大鼠脑组织中TNF-α、IL-1β水平高于D组,提示针刺预处理的抗炎作用可以被α7nAChR拮抗剂MLA所阻断。本研究采用实时定量荧光PCR法检测脑组织中a7nAChR mRNA的表达情况,结果表明针刺预处理可以上调α7nAChR mRNA的表达,而E组较D组大鼠α7nAChR mRNA的表达下调。
综上所述,针刺预处理可以改善脑梗死大鼠神经功能,抑制神经元凋亡,减轻脑梗死后炎性反应,且可以上调α7nACh mRNA的表达,针刺预处理的脑保护作用可以被α7nAChR拮抗剂MLA所逆转。推测CAP在针刺预处理诱导脑缺血耐受过程中发挥着重要作用。
[1]王北松.缺血性脑血管病研究近况与中医治疗概略[J].中医药信息,2001,18(3):2-4.
[2]Jin R,Liu L,Zhang S,et al.Role of inflammation and its mediators in acute ischemic stroke[J].J Cardiovasc Transl Res,2013,6 (5):834-851.
[3]Berti R,Williams AJ,Moffett JR,et al.Quantitative real-time RT-PCR analysis of inflammatory gene expression associated with ischemia-reperfusion brain injury[J].J Cereb Blood Flow Metab,2002,22(9):1068-1079.
[4]Swanson RA,Ying W,Kauppinen TM.Astrocyte influences on ischemic neuronal death[J].Curr Mol Med,2004,4(2):193-205.
[5]刘晓洁,梅志刚,王明智.胆碱能抗炎通路:缺血性脑卒中炎症反应的可能调节机制[J].中国老年学杂志,2013,33(5): 1211-1213.
[6]Longa EZ,Weinstein PR,Carison S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7]袁晓军,郝喜书,赖仲平,等.针刺风池穴对脑血流的影响[J].中医杂志,1996,37(5):285-286.
[8]Watters O,O'Connor JJ.A role for tumor necrosis factor-α in ischemia and ischemic preconditioning[J].J Neuroinflammation,2011.doi:10.1186/1742-2094-8-87
[9]Strecker JK,Minnerup J,Gess B,et al.Monocyte chemoattractant protein-1-deficiency impairs the expression of IL-6,IL-1β and G-CSF after transient focal ischemia in mice[J].PLoS One,2011,6(10):e25863.
[10]Majumder S,Ilayaraja M,Seerapu HR,et al.Chick embryo partial ischemia model:a new approach to study ischemia ex vivo[J]. PLoS One,2010,5(5):528.
[11]李祺,刘霞.胆碱能抗炎通路的信号机制研究[J].药学实践杂志,2010,28(5):325-327.
[12]Shytle RD,Mori T,Townsend K,et al.Cholinergic modulation of microglialactivationbyalpha7nicotinicreceptors[J].J Neurochem,2004,89(2):337-343.
[13]Hu J,Zhu C,Liu Y,et al.Dynamic alterations of gene expression of nicotinic acetylcholine receptor a7,a4 and a2 subunits in an acute MPTP-lesioned mouse model[J].Neurosci Lett,2011,494 (3):232-236.
[14]Liu Y,Hu J,Wu J,et al.α7 nicotinic acetylcholine receptormediated neuroprotection against dopaminergic neuron loss in an MPTP mouse model via inhibition of astrocyte activation[J].J Neuroinflammation,2012.doi:10.1186/1742-2094-9-98
[15]Raghupathi R,Conti AC,Graham DI,et al.Mild traumatic brain injury induces apoptotic cell death in the cortex that is preceded by decreases in cellular Bcl-2 immunoreactivity[J].Neuroscience,2002,110(4):605-616.
Impact of Acupuncture Preconditioning on Cholinergic Anti-inflammatory Pathway in Rats with Cerebral Infarction
QIN Yan-qiang,SUN Zhong-ren,ZHANG Ya-juan,et al.
Heilongjiang University of Traditional Chinese Medicine,Harbin 150040,China
ObjectiveTo explore the impact of acupuncture preconditioning on cholinergic anti-inflammatory pathway in rats with cerebral infarction.MethodsA total of 40 adult male SD rats were randomly divided into groups A,B,C,D,E,each of 8 cases.Rats of A group were given normal feeding,rats of B group were given sham-operation(cut the skin and exposed carotid general artery,external carotid artery,internal carotid artery,did not insert line-lock,then suture the skin),rats of C group were prepared for cerebral infarction model according to modified Zea Longa method,rats of D group were given acupuncture preconditioning 7 days before modeling,rats of E group were given acupuncture preconditioning and methyllycaconitine 7 days before modeling.All of the rats were killed 3 days after modeling,and neurological score was evaluated by Longar 5-grade method before killing.Fresh parietal lobe cortex were collected and fixed by formaldehyde,and TUNEL method was used to detect the cell apoptosis;other brain tissues were kept by liquid nitrogen,and ELISA was used to detect the TNF-α and IL-1β levels,real-time fluorescent quantitative PCR was used to detect the expression of α7nAChR mRNA. ResultsTUNEL positive cells of groups C,D,E were more than those of groups A and B,respectively;TNF-α and IL-1β levels of groups C,D,E were higher than those of groups A and B,respectively;while the expression of α7nAChR mRNA of
Brain infarction;Acupuncture points;Apoptosis;Inflammatory chemokines;Cholinergic antiinflammatory pathway;Rats
R 743.33
A
10.3969/j.issn.1008-5971.2015.03.009
2014-12-10;
2015-03-10)
(本文编辑:谢武英)
国家自然科学基金面上项目(30873298)
150040黑龙江省哈尔滨市,黑龙江中医药大学(秦彦强,孙忠人,高利权);哈尔滨市第二医院(秦彦强,张亚娟);北京中医药大学附属三院(史术峰)
孙忠人,150040黑龙江省哈尔滨市,黑龙江中医药大学;E-mail:szr006@163.com
groups C,E were lower than those of groups A and B,respectively(P<0.05).TUNEL positive cells of D group were less than those of groups C and E,respectively;neurological score,TNF-α and IL-1β levels of D group were lower than those of groups C and E,respectively;while the expression of α7nAChR mRNA of D group were higher than those of groups C and E,respectively(P<0.05).ConclusionAcupuncture preconditioning can improve neurological function in rats with cerebral infarction,inhibit neuronal apoptosis and reduce inflammatory cytokines levels,raise the expression of 7nAChR mRNA.

