甘蓝根肿病的人工接种体系与抗源材料筛选
陈 欣,王 超,张晓烜,王 帅
(东北农业大学园艺学院,哈尔滨 150030)
甘蓝根肿病,是由芸薹根肿菌(Plasmodiophora brassicaeWoronin)侵染引起的一种世界性土传病害,该病原菌除侵染甘蓝外,还可侵染其他十字花科蔬菜引起根肿病。受侵染的甘蓝表现为根部组织异常增生、肿大,植株地上部发育迟缓,不能形成正常的叶球,严重减产甚至绝收[1]。由于根肿病为土传病害,其病菌休眠孢子在无感病寄主的土壤中可存活20年之久,土壤一旦污染,将不再适宜十字花科蔬菜的栽培[2]。国内外的研究和实践证明,防治该病害的最根本途径是选育抗病品种,而建立一套稳定的人工接种体系是抗病育种的基础。目前国内外对甘蓝根肿病最佳人工接种体系仍无定论,为此,本研究在参考已报道的十字花科蔬菜根肿病的各种接种方法和条件的基础上,对比了不同接种方法,不同接种浓度以及不同土壤pH 条件对甘蓝根肿病接种效果的影响,筛选出适合甘蓝根肿病接种的最佳组合,从而建立一套稳定的甘蓝根肿病接种体系,并利用此接种体系,对东北农业大学甘蓝课题组提供的20份甘蓝材料进行了抗性鉴定。
1 材料与方法
1.1 材料
菌种:在东北农业大学农场基地甘蓝根肿病发病田块采集发病植株肿根和菌土,-20℃冷冻保存。
供试甘蓝材料:高度感病品种‘京丰一号’[3];由东北农业大学园艺学院甘蓝课题组提供的20个自交系:‘PM’、‘PF’、‘P1’、‘P2’、‘P3’、‘P4’、‘R’、‘Q1’、‘Q2’、‘Q3’、‘3-1003’、‘3-1004’、‘3-1005’、‘3-1006’、‘3-1009’、‘3-1012’、‘3-1015’、‘3-1017’、‘3-1020’、‘3-1021’。
1.2 方法
1.2.1 病田土壤含菌量的测定
为了解根肿菌的致病浓度,从而确定有效的接种浓度,对发病田块土壤中病原菌休眠孢子含量进行统计,方法如下:在发病田块共确定20个样点(按不同品种设点取样),由于根肿菌休眠孢子活动较为集中,在土层10cm 处含量较多[4],因此取样时在每个取样点的病株根部周围距地表10cm 处取500g土壤,采用杨佩文的蔗糖溶液离心法分离菌土中的休眠孢子[5],利用血球计数板计测休眠孢子浓度,并计算20个样点土壤含菌量的平均值,以此作为后续试验接种浓度的参考指标。
1.2.2 接种液的制备
取出部分冷冻保存的甘蓝肿根,室温解冻,剪成小块后称重,加等量无菌水,用组织捣碎匀浆机搅成匀浆后4层纱布过滤,4 000r/min 离心15min,弃上清液;用无菌水悬浮沉淀,3 500r/min 离心10 min,弃上清液,重复此步3次,最后弃上清液,重新用无菌水悬浮沉淀,制成根肿菌休眠孢子悬浮液,利用血球计数板计测休眠孢子悬浮液浓度,并调至1.6×108个/mL(参考发病田块土壤含菌量的平均值)。4 ℃保存备用。
1.2.3 不同接种方法对甘蓝根肿病接种效果的影响
蘸根法[6]:将消毒的‘京丰一号’种子播种在装有灭菌基质(蛭石∶草炭∶灭菌土=1∶1∶2)的营养钵(直径×高度=9cm×9cm)中,培养10d后拔出无病虫幼苗,将其根部洗净并用吸水纸吸干,然后将根部浸入配制好的1.6×108个/mL休眠孢子悬浮液中,4h后将幼苗重新移植到营养钵中培养,正常管理。
根际土壤注菌法[7]:将消毒后的‘京丰一号’种子播在装有灭菌基质的营养钵中,用移液枪吸取2 mL配制好的1.6×108个/mL 休眠孢子悬浮液注射于根际基质,正常管理。
菌土法[8-9]:将冷冻保存的甘蓝肿根取出,室温解冻,剪成小块后称重,加等量无菌水,用组织捣碎匀浆机搅成匀浆后,与灭菌基质混匀,采用杨佩文的蔗糖溶液离心法分离菌土中的休眠孢子[5],利用血球计数板计测休眠孢子浓度,最终使混匀后的菌土中休眠孢子浓度达1.6×108个/g基质,在25 ℃黑暗条件下保湿48h,然后在装有灭菌基质的培养钵中挖一圆柱形小洞(直径30 mm,高35 mm),将混合好的菌土撒入其中,然后将消毒后的‘京丰一号’种子播入,正常管理。
以上各处理分别接种幼苗30 株,对照为同苗龄期未做接种处理的‘京丰一号’植株,3次重复,在25 ℃条件下培养,保持基质湿润,6 周后调查发病情况。
1.2.4 不同接种浓度对甘蓝根肿病接种效果的影响
采用菌土法接种,称取一定量的甘蓝肿根,加等量水后,用组织捣碎匀浆机搅成匀浆后与定量的灭菌基质混匀制成6种不同浓度的菌土,各处理浓度为:每克灭菌基质中分别拌入0.002、0.01、0.05、0.1、0.2、0.4g肿根,统计6种不同浓度的菌土中的病菌孢子含量,采用杨佩文的蔗糖溶液离心法分离菌土中的孢子[5],利用血球计数板计算浓度。分别对‘京丰一号’,‘PM’,‘P3’,‘3-1012’进行接种,每种供试甘蓝材料的每个接种浓度重复3次,每次重复接种30株,以同苗龄期未做接种处理的‘京丰一号’植株为对照,在25 ℃条件下培养,保持基质湿润,6周后调查发病情况。
1.2.5 不同土壤pH 条件对甘蓝根肿病接种效果的影响
采用菌土法接种,选择1.2.4试验筛选得到的最佳接种浓度(1.6×108个/g基质)配制菌土,用硫酸亚铁溶液和石灰水分别调节菌土pH 至5.5、6.0、6.5、7.0、7.5、8.0等6种不同pH,每个处理各接种‘京丰一号’30株,以不经处理的菌土作对照,3次重复,在25℃条件下培养,保持基质湿润,6周后调查发病情况。
1.2.6 室内人工接种法对供试甘蓝材料进行根肿病抗性鉴定
在东北农业大学甘蓝课题组温室内,采用1.2.2~1.2.5确定的最佳接种体系,对20份甘蓝材料进行接种,每份材料30株,对照为已知感病品种‘京丰一号’,3次重复,培养6周后调查发病情况。
1.2.7 数据统计和分析
甘蓝根肿病室内人工接种病情分级标准[3]如下:
单株分级标准:0级,根部无任何肿瘤;1级,主根肿大,其直径小于2 倍茎基,或须根有小肿瘤;肿大部分直径在4mm 以下;3级,主根肿大,其直径为茎基的2~3倍,肿大部分直径约4~6mm;5级,主根肿大,其直径为茎基的3~4倍,肿大部分直径约6~8mm;7级,主根肿大,其直径为茎基的4倍以上,肿大部分直径约8mm 以上。
病情指数(DI)=∑(发病级代表值×各级病株数)×100/(调查总株数×最高级发病代表值)
甘蓝根肿病群体抗性分级标准[10]如下:
免疫(I):DI=0;高抗(HR):0<DI≤5;抗病(R):5<DI≤15;中抗(MR):15<DI≤30;感病(S):30<DI≤50;高感(HS):DI>50。
采用SPSS 19.0软件进行数据分析。
2 结果与分析
2.1 病田土壤含菌量的测定结果
由20个样点的土壤中休眠孢子含量(表1)可得,病田土壤中休眠孢子含量的平均值为1.6×108个/g土壤,此浓度作为接种试验中接种浓度的参考指标。
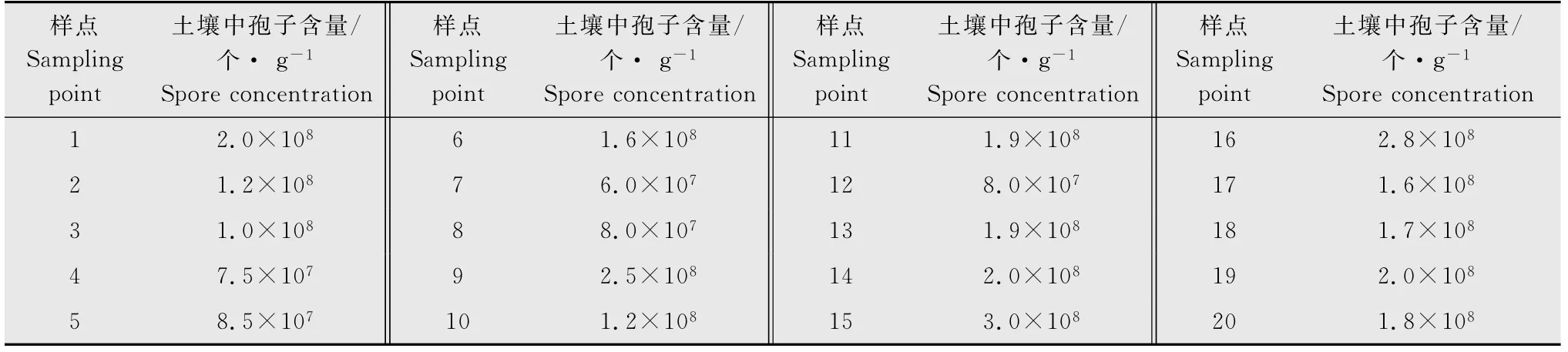
表1 病田土壤中休眠孢子含量Table 1 Resting spores concentration in the field
2.2 不同接种方法对甘蓝根肿病接种效果的影响
接种六周后,对发病情况进行调查,按照甘蓝根肿病室内人工接种病情分级标准对接种植株进行分级,计算发病率和病情指数。从表2可以看出,3种接种方法均可使植株发病,其中菌土法接种效果最好,平均发病率为77.78%,平均病情指数为49.52;根际土壤注菌法效果次之,平均发病率为57.78%,平均病情指数为30.79;蘸根法效果较差,平均发病率为55.56%,平均病情指数仅为24.13。因此,3种接种方法中,以菌土法的接种效果最佳。
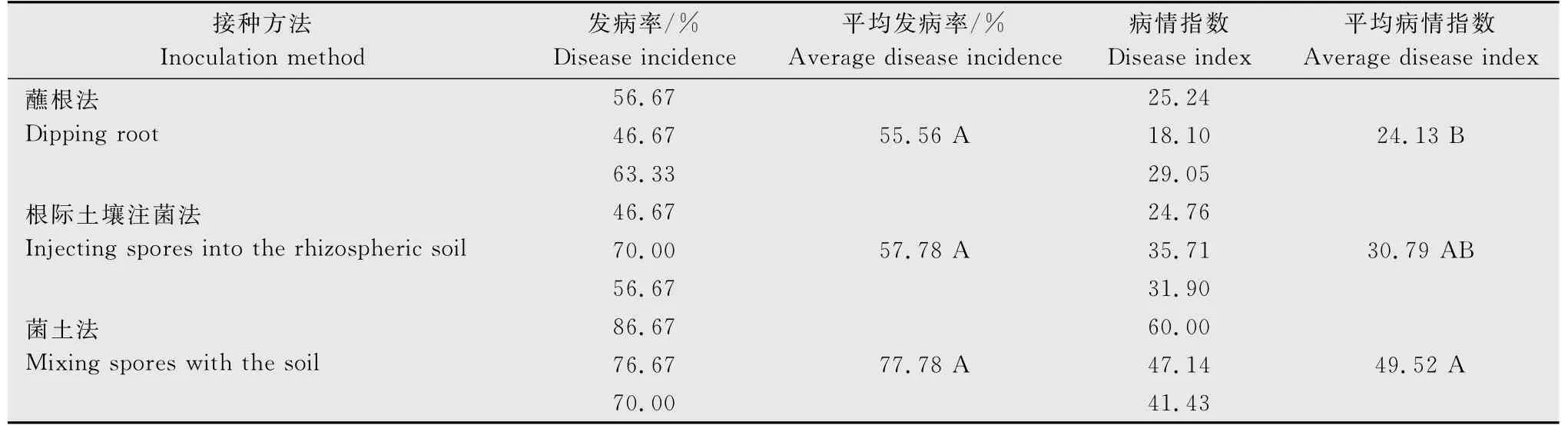
表2 不同接种方法下‘京丰一号’发病情况1)Table 2 The occurence of cabbage clubroot on‘Jingfeng 1’cabbage with different inoculation method
2.3 不同接种浓度对甘蓝根肿病接种效果的影响
按1.2.4的方法制备的菌土,其病菌孢子含量分别为3.2×106、1.6×107、8×107、1.6×108、3.2×108和6.4×108个/g基质,各浓度处理4种供试甘蓝的结果见表3~6,各表数据显示:(1)6种不同浓度的菌土均可使甘蓝幼苗发病,对同一种甘蓝材料,随着接种浓度的升高,发病率和病情指数也随之升高;(2)接种材料‘京丰一号’为已知高感品种[3],当菌土中孢子浓度为3.2×106、1.6×107和8×107个/g基质时,平均病情指数均小于30,说明这3种接种浓度在调查时间内不能真实地反映接种材料的抗性。

表3 不同接种浓度下‘京丰一号’发病情况Table 3 The occurence of cabbage clubroot on‘Jingfeng 1’cabbage under different inoculation concentrations

表4 不同接种浓度下‘PM’发病情况Table 4 The occurence of cabbage clubroot on‘PM’cabbage under different inoculation concentrations

表5 不同接种浓度下‘P3’发病情况Table 5 The occurence of cabbage clubroot on‘P3’cabbage under different inoculation concentrations

表6 不同接种浓度下‘3-1012’发病情况Table 6 The occurence of cabbage clubroot on‘3-1012’cabbage under different inoculation concentrations
表7为菌土中孢子浓度达1.6×108个/g时,4种供试甘蓝材料各重复间病情指数,可以看出,各重复间接种结果比较稳定;表8~10为菌土中孢子浓度为1.6×108、3.2×108、6.4×108个/g时4种不同供试甘蓝材料间方差分析,可以看出,在1.6×108个/g接种浓度下,材料间F值80.95(F>F0.01)各材料间表现出明显的抗性差异,方差分析极显著(表8);当菌土中孢子浓度达3.2×108和6.4×108个/g时,材料间F值分别为3.70和1.91(F<F0.05),方差分析均不显著(表9~10),表明在此两种接种浓度下,材料间抗病性无明显差异。综上,接种浓度过高或过低都会影响鉴定结果的真实性,所以1.6×108个/g为最适接种浓度,能够真实反映出供试材料的抗性,且能区分供试材料的抗感差异。
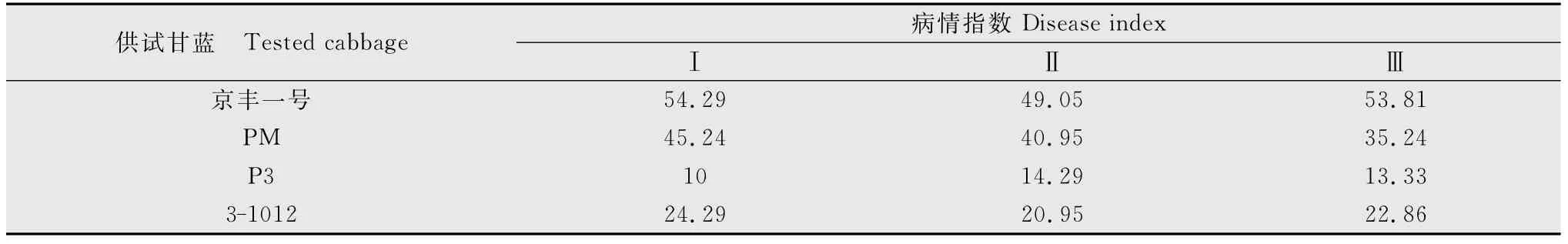
表7 接种孢子浓度为1.6×108 个/g时供试甘蓝的病情指数1)Table 7 Disease index of the tested cabbage at inoculation concentration of 1.6×108spores per gram of substratum
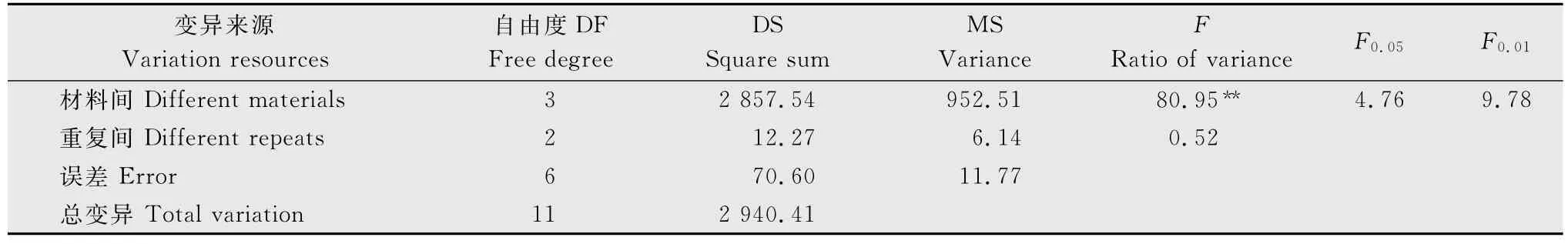
表8 接种孢子浓度为1.6×108 个/g时供试甘蓝的方差分析结果1)Table 8 Variance analysis of different cabbage materials at inoculation concentration of 1.6×108spores per gram of substratum
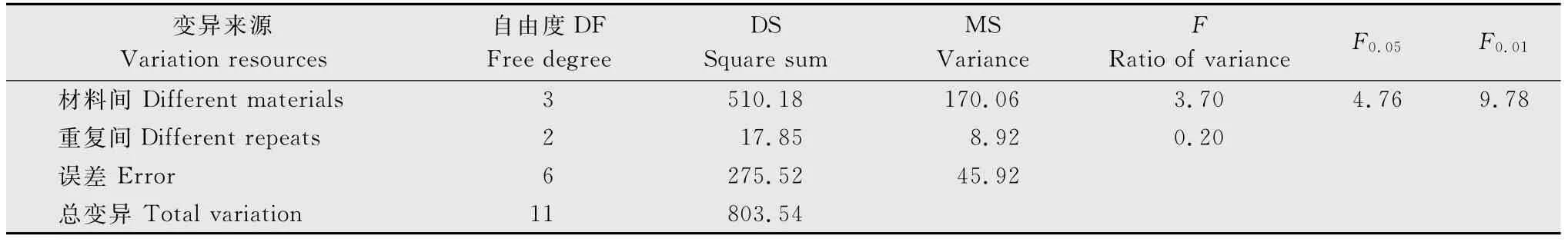
表9 接种孢子浓度为3.2×108 个/g时供试甘蓝的方差分析结果Table 9 Variance analysis of different cabbage materials at inoculation concentration of 3.2×108spores per gram of substratum
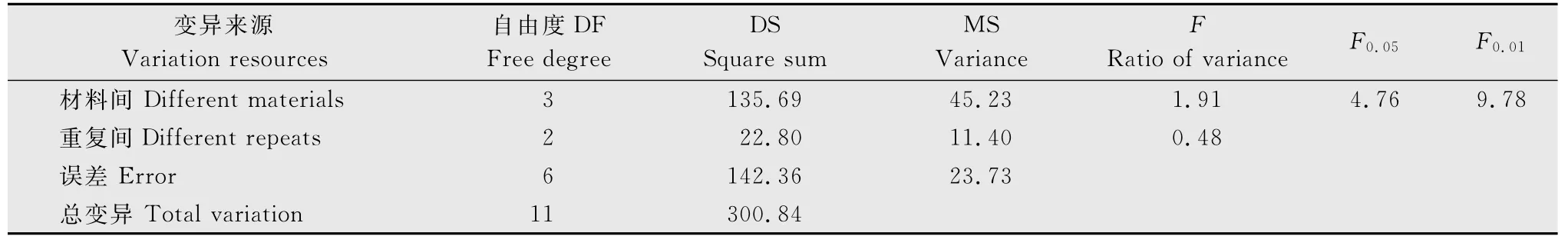
表10 接种孢子浓度为6.4×108 个/g时供试甘蓝的方差分析结果Table 10 Variance analysis of different cabbage materials at inoculation concentration of 6.4×108spores per gram of substratum
2.4 不同pH 条件对甘蓝根肿病接种效果的影响
如表11所示,在pH 5.5~6.5范围内,植株平均病情指数均大于30,符合‘京丰一号’的抗性指标[3],当pH 6.0时发病最重,平均发病率为81.11%,平均病情指数为51.58。所以适宜根肿病发病的土壤pH 在5.5~6.5之间,最佳pH 为6.0。各结果同时证明甘蓝根肿病发病严重度与土壤酸碱性有关,在偏酸性土壤中(pH 5.5、6.0、6.5)发病重于中性土壤(pH 7.0),而中性土壤(pH 7.0)下发病又重于偏碱性土壤(pH 7.5、8)。
综上,甘蓝根肿病的最佳接种方法为菌土法,最佳接种孢子浓度为1.6×108个/g,土壤pH 偏酸性利于发病。最终确定甘蓝根肿病最佳接种体系:采用菌土法,菌根与灭菌基质以1∶10的比例混匀,用硫酸亚铁溶液调节菌土基质pH 为6.0,进行接种。

表11 不同pH 的菌土对根肿病发病情况的影响Table 11 Effect of different soil pH value on occurence of cabbage clubroot
2.5 甘蓝材料根肿病室内人工接种抗性鉴定结果
为了能给甘蓝抗根肿病育种提供可靠的育种材料,对东北农业大学提供的20份甘蓝材料在室内进行了人工接种抗性鉴定,按照甘蓝根肿病室内人工接种病情分级标准进行分级(图1)。

图1 甘蓝根肿病室内人工接种单株病情分级标准Fig.1 Grade standard of cabbage clubroot on individual plant by artificial inoculation indoors
鉴定结果,如表12所示,本次供试的20份材料中,没有免疫(I)和高抗(HR)根肿病材料,其中抗病(R)材料有3份,分别为:P3、R、Q3;中抗(MR)材料9份,分别为:‘P1’、‘Q1’、‘Q2’、‘3-1005’、‘3-1012’、‘3-1015’、‘3-1017’、‘3-1020’、‘3-1021’;感病(S)材料有7份,分别为:‘PM’、‘P2’、‘P4’、‘3-1003’、‘3-1004’、‘3-1006’、‘3-1009’;高度感病(HS)材料1份:PF。
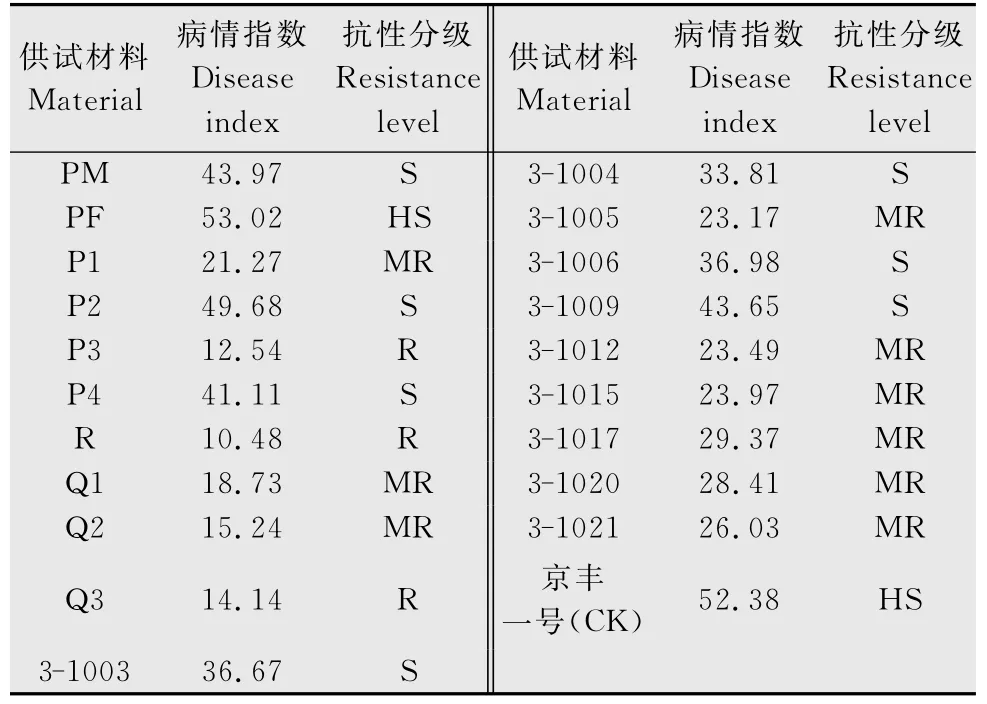
表12 甘蓝种质资源的抗根肿病筛选结果Table 12 Screening results of resistance of cabbage germplasm resources against clubroot
3 讨论
建立一套稳定的人工接种体系是抗病育种工作的基础,本试验以发病快、接种后抗/感反应稳定、并能正确划分出品种真实抗性以及操作简便为宗旨,筛选出一套与田间发病症状吻合的最佳甘蓝根肿病接种体系。
接种方法、浓度及培养体系pH 条件是影响植物病害抗性鉴定准确性的重要因子,为建立一套可靠的甘蓝根肿病接种体系,本研究针对这3种因素设计试验,结果表明,所采用的3种接种方法中菌土法接种效果最佳,3种接种方法的接种物都为病原菌休眠孢子,区别在于菌土法是将肿根直接搅碎后拌入基质中进行接种,而其他两种方法的特点是将分离自肿根中的休眠孢子配成悬浮液后作为接种液。根据接种效果的优劣,可以看出混有植物组织的病原孢子接种效果更好,推测可能是发病植株组织搅碎后的汁液可促进休眠孢子萌发,利于其侵染,要验证此推测,还需要对根肿菌休眠孢子的萌发特性进行深入研究;不同接种浓度的测试表明,相对于同一甘蓝材料,接种浓度越高,发病效果越好,相对于不同接种材料,当接种孢子浓度为1.6×108个/g时,能较好地区分出甘蓝材料间的抗性,为最适接种浓度。
本次试验测得根肿病在偏酸性(pH 5.5~6.5)条件下发病较重,最适发病的土壤pH 为6.0。关于不同土壤pH 条件对植株发病轻重的影响,前人研究存在一定争议,普遍认为pH 5.4~6.5适宜该病发生[3,11-12],但余汉清等[13]却认为土壤pH 与发病率无关。对于甘蓝在偏酸性土壤中易于感病,笔者分析可能与根肿菌的萌发特性有关,根肿菌的最适宜萌发pH 为6.0~6.7[9],因此土壤pH 在此范围内更利于根肿菌萌发产生游动孢子,从而侵染植株。
田间实际发病情况要受不稳定的环境条件影响,因此室内筛选出的抗性材料,在实际栽培过程中是否表现抗病,还有待进一步验证,此外由于本次研究仅针对哈尔滨地区甘蓝根肿菌菌源进行抗性鉴定,因而,筛选出的抗性材料是否抗其他地区甘蓝根肿病不得而知,还需要进一步开展对甘蓝根肿菌生理小种的研究。
[1]杨丽梅,方智远,刘玉梅,等.“十一五”我国甘蓝遗传育种研究进展[J].中国蔬菜,2011(2):1-10.
[2]Howard R J.Strelkov S E.Harding M W.Clubroot of cruciferous crops—new perspectives on an old disease[J].Canadian Journal of Plant Pathology,2010,32(1):43-57.
[3]司军,李成琼,宋洪元,等.结球甘蓝对根肿病的抗性鉴定与评价[J].西南大学学报,2009,31(6):27-30.
[4]杨明英,李向东,孙道旺,等.白菜根肿病菌致病性因素研究[J].西南农业学报,2011,24(2):612-615.
[5]杨佩文,李家瑞,杨勤忠,等.十字花科蔬菜根肿病菌休眠孢子的分离与检测[J].云南农业大学学报,2002,17(3):301-306.
[6]Johnston T D.Club root inBrassica:A standard inoculation technique and the specification of races[J].Plant Pathology,1968,17(4):184-187.
[7]丁云花,简元才.十字花科蔬菜根肿病菌生理小种及接种方法[J].中国蔬菜,2005(8):29-31.
[8]郭向华.甘蓝根肿菌的生物学特性及致病研究[D].重庆:西南农业大学,2001.
[9]司军,李成琼,肖崇刚,等.甘蓝根肿病接种方法的研究[J].西南农业大学学报,2003,25(3):216-219.
[10]李向东,孙道旺,曹继芬,等.十字花科蔬菜根肿病抗性水平筛选研究[J]西南农业学报,2013,26(1):171-173.
[11]余仕金.十字花科作物根肿病发生规律及防治研究[J].云南农业,2009(3):45-46.
[12]杨子祥,段曰汤,袁理春,等.十字花科根肿病的发生规律及防治[J].长江蔬菜,2011(23):42-43.
[13]余汉清,华秀丽.大白菜根肿病发生条件与防治[J].长江蔬菜,1996(10):18-19.

