北京地区草莓灰霉病菌对异菌脲的抗性及抗性分子机制
陈帅民,芦 帆,张 璨,张 佳,张国珍
(中国农业大学植物病理学系,农业部植物病理学重点实验室,北京 100193)
草莓灰霉病是草莓上常见的严重病害之一,主要发生在采果期。采后果实常迅速腐烂,造成非常严重的损失。该病害的病原菌灰葡萄孢(Botrytis cinereaPers.)还可引起花枯、侵染叶片和叶柄[1]。灰葡萄孢具有寄主范围广、繁殖快和遗传变异频繁等特点,使其易于对杀菌剂产生抗性[2]。
以异菌脲、腐霉利等为代表的二甲酰亚胺类杀菌剂是国外20 世纪70 年代开发的一类新型杀菌剂,对灰霉病具有良好防效,目前仍是生产上防治灰霉病的常用药剂。据报道,我国部分省区的草莓灰霉病菌已经对二甲酰亚胺类杀菌剂产生了抗性。2005-2006年礼茜等[3]检测了浙江省建德市和杭州下沙区的2个草莓主产区的草莓灰霉病菌对异菌脲的抗性,发现建德下涯和庙头张两地的抗性频率达17.5%。2010年胡伟群等[4]对分离自浙江杭州市售草莓的83个灰霉病菌菌株的测定结果显示,对异菌脲的抗性频率达到18.1%。2012 年潘以楼等[5]检测江苏草莓主产区的句容市和宜兴市采集的草莓灰霉病菌为对异菌脲的抗性频率为64.6%。因此,有必要继续加强草莓灰霉病菌对该类杀菌剂抗性情况的监测。
已有研究表明,二甲酰胺类杀菌剂可能通过干扰灰葡萄孢的渗透压传导途径来抑制其生长,而灰葡萄孢对二甲酰胺类杀菌剂的抗性产生可能与编码组氨酸激酶基因(BcOS1)的突变有关,BcOS1具有调节渗透压的功能[6]。Oshima等[7]对日本(主要是大阪)的灰葡萄菌株对二甲酰胺类杀菌剂的抗性研究发现有3种突变类型,类型Ⅰ:第365位氨基酸由异亮氨酸变为丝氨酸;类型Ⅱ:有3个突变位点,分别为第368位由缬氨酸变成苯丙氨酸,第369位由谷氨酰胺变为组氨酸,第447位由苏氨酸变为丝氨酸;类型Ⅲ:有2个突变位点,分别为第369位由谷氨酸变为脯氨酸,第373位由天冬酰胺变为丝氨酸,在24个抗性菌株中突变类型Ⅰ占50%。Cui等[8]主要检测了来自新西兰的抗二甲酰胺类杀菌剂的灰葡萄菌株的突变情况,分为4 种类型:类型Ⅰ:第365位氨基酸由异亮氨酸变为丝氨酸;类型Ⅱ:第365位氨基酸由异亮氨酸变为天冬酰胺;类型Ⅲ:第365位氨基酸由异亮氨酸变为精氨酸;类型Ⅳ:第365位氨基酸由异亮氨酸变为丝氨酸,第369 位谷氨酰胺变为脯氨酸。李茜等[3]对采自浙江省建德市和杭州下沙区的灰葡萄孢抗药性菌株检测发现有两种突变类型:第365位氨基酸由异亮氨酸变为丝氨酸;第369位由谷氨酸变为脯氨酸,第373位由天冬酰胺变为丝氨酸。
近些年,以日光温室为主的设施草莓种植在北京地区迅速发展,种植面积持续增长,2012 年种植面积达到800hm2,总产量为1.5万t[9]。设施栽培也为灰霉病的发生提供了有利条件。目前尚未见北京地区草莓灰霉病菌对二甲酰亚胺类杀菌剂的抗性报道。我们在检测草莓灰霉病菌对该类杀菌剂的抗性时发现,采自北京地区各草莓园的灰霉病菌对异菌脲和腐霉利的抗性频率完全相同(结果未列出),表明草莓灰霉病菌对这两种杀菌剂存在交互抗性。本研究重点检测了2013-2014年北京地区15个草莓园的草莓灰霉病菌对异菌脲的抗性情况,分析了两个年度间菌株的抗性频率变化,并对抗性菌株的抗性分子机制进行了研究,旨在为异菌脲的合理使用和有效防治草莓灰霉病提供科学依据。
1 材料与方法
1.1 供试菌株
草莓灰霉病菌(Botrytiscinerea):2013 年 和2014年从北京4个区15个草莓种植园采集草莓灰霉病病果,带回实验室进行分离培养和纯化,每个病果只保留1个单孢菌株,共获得121株单孢菌株,其中2013年57株,2014年64株(表1)。

表1 2013-2014年北京地区采集草莓灰霉病菌供试菌株信息Table 1 Tested isolates of Botrytis cinerea collected from 15strawberry gardens in Beijing from 2013to 2014
1.2 供试杀菌剂
98%异菌脲原药由北京中植科华农业技术有限公司提供,4 ℃冰箱保存。
1.3 培养基
PDA 培养基:去皮马铃薯200g,葡萄糖20g,琼脂粉20g,蒸馏水1 000mL。
1.4 草莓灰霉病菌对异菌脲的抗性检测
采用最低抑制浓度法(MIC)检测供试菌株对异菌脲的抗性,鉴别浓度为5μg/mL[10],每个菌株重复3次。
含药培养基平板的制备:将异菌脲原药用丙酮配制成5mg/mL溶液,吸取300μL药液与300mL PDA 培养基混匀,倒入灭菌培养皿(d=6cm),制成异菌脲浓度为5μg/mL的含药平板培养基,并以添加等量丙酮的PDA 培养基为对照。
抗药性的判别:在培养3d 的灰霉病菌菌落上,用直径5mm 的打孔器在菌落边缘打取菌饼,接种在含药培养基中央,于20 ℃培养箱黑暗培养。将在鉴别浓度培养基上不能生长或几乎不能生长的菌株定为敏感菌株,能在鉴别浓度培养基上生长的判定为抗性菌株。
按下列公式计算各采样点菌株的抗性频率(resistance frequency):
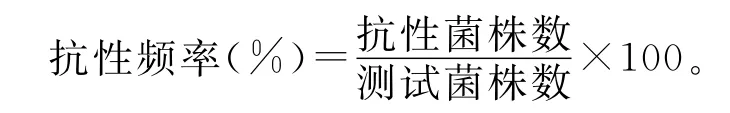
1.5 草莓灰霉病菌对异菌脲的抗性水平测定
采用菌丝生长速率法[11],对经鉴别浓度确定的抗性和敏感菌株进行EC50的测定,通过比较抗性菌株的EC50与敏感基线的比值,确定各菌株的抗性水平。抗性菌株所用含药浓度梯度为0.2、0.5、1.0、2.5和5μg/mL,以添加等量溶剂丙酮的PDA 培养基为对照。在供试菌株菌落边缘的同心环上用直径5mm 打孔器打取菌饼,接种于含药PDA 平板上,每个浓度重复3皿,置于20 ℃培养箱黑暗培养,3d后测量各处理的菌落直径,根据以下公式计算菌丝生长抑制率:

将生长抑制率数据转换成几率值(Y)、药剂浓度(μg/mL)转换成以10为底的对数值(X),在Microsoft Excel中做回归直线,求出毒力回归方程(Y=A+BX)和相关系数,计算出药剂对供试菌株菌丝生长抑制的有效中浓度(EC50)。当EC50与敏感基线EC50的比值小于5 时为低抗菌株,比值大于10 为高抗菌株,介于两者之间为中抗菌株[3]。
1.6 抗异菌脲菌株的分子检测
采用CTAB 法[12]提取供试菌株的基因组DNA,根据礼茜等[3]设计的引物对目标片段进行扩增。扩增片段为组氨酸激酶基因BcOS1N-端氨基酸重复区中已知的与二甲酰亚胺抗性相关的区段,大小为500bp 左右。引物BcHKF:5′-TCCGAGAAATTGCTTCCGTC-3′;BcHKR:5′-CCATTCACATTTTCGGTGAGG-3′。PCR扩增体系50μL:10×PCR缓冲液5.0μL,2mmol/L dNTP 4.0μL,10mol/L引物各1.0 μL,2.5U/μLTaqDNA 聚合酶0.5μL,10ng/μL模板DNA 1.0μL,ddH2O 37.5μL。PCR 扩增程序:94 ℃2min;94 ℃45s,55 ℃45s,72 ℃50s,30个循环;最后72 ℃延伸10min。
扩增产物由北京三博远志生物技术有限公司测序,测序结果用DNAMAN 软件进行分析。
2 结果与分析
2.1 草莓灰霉病菌对异菌脲的抗性
2.1.1 各区草莓灰霉病菌对异菌脲抗性频率在年度间的变化情况
从各区菌株对异菌脲的抗性情况来看,4 个区的菌株抗性频率明显不同,房山区菌株的抗性频率最高,在73.7%以上,其次是通州区和昌平区,海淀区菌株的抗性频率最低,只有9.1%。从年度间总体平均抗性频率变化来看,2013年菌株对异菌脲的抗性频率为9.1%~73.7%,平均为40.4%,2014年菌株的抗性频率为0~78.6%,平均为45.3%,较2013年增加了近5%(图1)。

图1 北京市4个区草莓灰霉病菌对异菌脲的抗性频率在2013-2014年度间变化Fig.1 Changes of iprodione-resistant frequency in Botrytis cinereaisolates from strawberry collected from four districts in Beijing between 2013and 2014
2.1.2 不同草莓园灰霉病菌菌株对异菌脲的抗性频率比较
2013年和2014 年共从15 个草莓园采集了121株草莓灰霉病菌株,各草莓园菌株的抗性表现出很大差异,抗性频率从0 至85%不等。来自昌平区兴寿、香屯和万德园、海淀区御香园和苏家坨的菌株对异菌脲均敏感,未发现抗性菌株。来自北京农林科学院林果所和昌平区豆豆草莓园菌株的抗性频率低,为8.3%~12.5%。而通州区王庄和大运河、房山区长阳和夏场的菌株抗性频率均高于60%。其他草莓园菌株的抗性频率介于25%~50%之间(表2)。
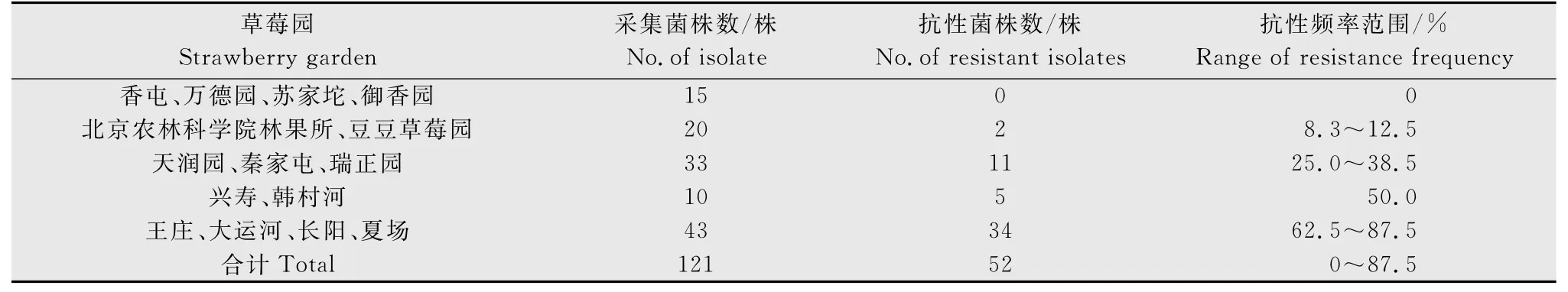
表2 不同草莓园灰霉病菌菌株对异菌脲的抗性频率比较Table 2 Iprodione-resistant frequency of Botrytis cinereaisolates collected from different strawberry gardens
2.2 草莓灰霉病菌对异菌脲的抗性水平
本研究利用最低抑制浓度法,从2014年的64个菌株中检测出29株对异菌脲具有抗性的菌株,经测定异菌脲对这些抗性菌株的EC50分布在0.54~3.37μg/mL之间。参照礼茜等[3]建立的灰霉病菌对异菌脲敏感基线值(EC50为0.229 9μg/mL),对抗性菌株的抗性水平进行划分,在29个抗性菌株中,有6株为低抗菌株,18株为中抗菌株,5株为高抗菌株,分别占抗性菌株的21%、62%和17%(图2)。低抗、中抗和高抗菌株占检测菌株数的百分率分别为9.4%、28.1%和7.8%。表明绝大部分抗性菌株对异菌脲具有中抗至高抗水平,而且中抗水平以上菌株占菌株数的近36%。
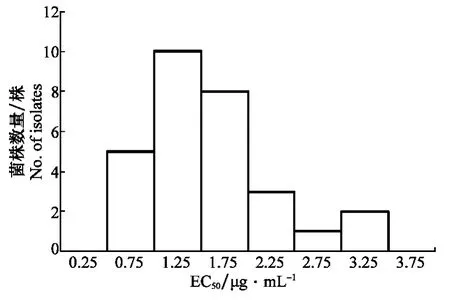
图2 草莓灰霉病菌29个抗异菌脲菌株的EC50分布Fig.2 Distribution of EC50value among 29 iprodione-resistant isolates of Botrytiscinereafrom strawberry
2.3 菌株抗异菌脲的分子机制
选取2个敏感菌株和6个EC50不同的抗性菌株(表3),扩增了其BcOS1基因,得到约为500bp的条带。将所测序列与GenBank中Botryotiniafuckeli-anaBcOS1基因序列(登录号AF396827.2)比较。结果表明,敏感菌株BcOS1基因的核苷酸序列与比对序列的相似性为100%,而抗性菌株BcOS1基因在1 214位点的核苷酸序列发生了2种类型的突变,导致对应的编码的第365位氨基酸发生变化。在检测的6个菌株中,Ⅰ类有4个菌株,EC50为1.37~2.39μg/mL,属于中抗至高抗菌株,其核苷酸序列的第1 214位由ATC 变为AGC,导致第365 位氨基酸由异亮氨酸(Ile)变为丝氨酸(Ser);Ⅱ类有2个菌株,EC50为0.54~0.64μg/mL,属于低抗菌株,其核苷酸序列的第1 214位由ATC 变为AAC,导致第365位氨基酸由异亮氨酸变为天冬酰胺(Asn)。此外,还发现抗性菌株中第1 203位、1 347位和1 350位核苷酸也发生了变化,但对应的氨基酸并没有改变(表3)。
3 讨论
本研究检测了2013 年和2014 年北京地区15个种植园草莓灰霉病菌对杀菌剂异菌脲的抗性情况,虽然2014年较2013年的抗性频率没有显著上升,但总体的抗性频率较高,平均为45.3%。在检测的15个草莓园中,有4个园的抗性菌株频率表现很高,为62.5%~87.5%。检测出的异菌脲抗性频率的高低与异菌脲的施用水平有关,调查发现,没有检测到抗性菌株或抗性菌株频率很低的草莓园,部分是有机草莓生产园,不施或很少用杀菌剂,或是以农业防治措施为主的草莓园。当然,由于各草莓园采集的菌株数量不等或菌株数量有限,不能完全排除有漏检抗性菌株的可能性。
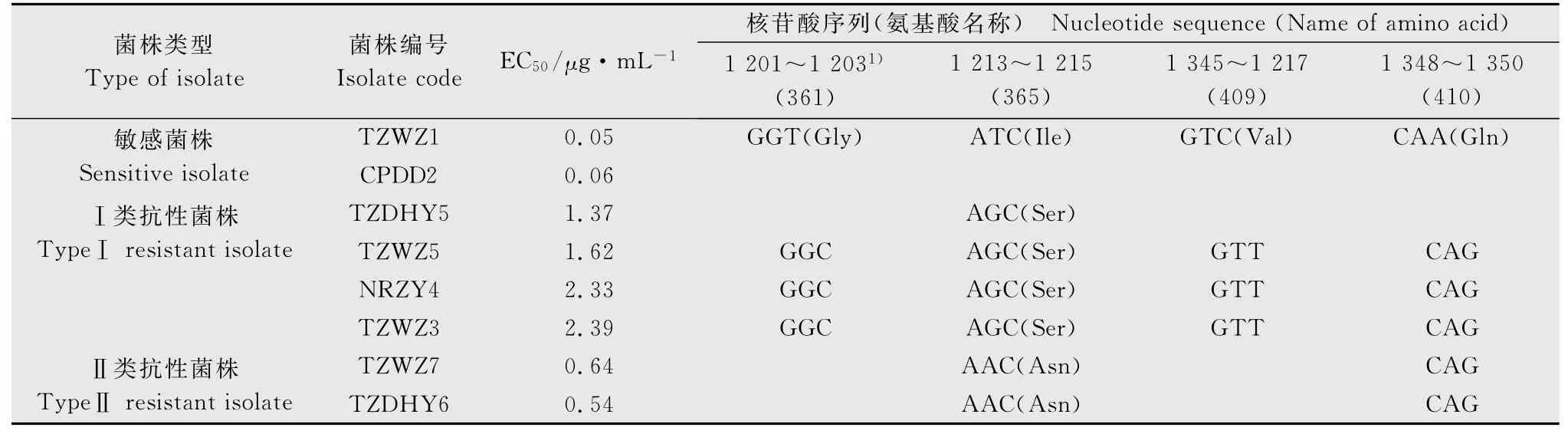
表3 草莓灰霉病菌抗性菌株与敏感菌株BcOS1基因核苷酸序列及编码氨基酸的差异比较Table 3 Comparison of BcOS1gene nucleotide and amino acid sequences between iprodione-resistant and iprodione-sensitive isolates of Botrytiscinereafrom strawberry
本研究采用最低抑制浓度法从2014年采集的64个草莓灰霉病菌菌株中检测出了29个抗异菌脲的菌株。由于异菌脲使用较普遍,无法采集到不施用该杀菌剂的菌株建立敏感基线,本研究是参照礼茜等[3]的敏感基线值对抗性菌株的抗性水平进行划分的。2014年采集的菌株中,属于中抗和高抗的菌株占了近36%。异菌脲和腐霉利同属于二甲酰亚胺类杀菌剂,据我们前期的检测结果,草莓灰霉病菌对这两种杀菌剂存在明显的交互抗性(结果未列出),也鉴于有些草莓园的灰霉病菌菌株对异菌脲的抗性频率已达较高水平,因此在北京地区防治草莓灰霉病,尤其是施药水平高的草莓园,应该限制这类杀菌剂的使用或减少使用次数,建议优先选用其他作用机制或类型的新型杀菌剂,如氟啶胺、环酰菌胺、咯菌腈等,与之轮换使用。
本研究通过抗异菌脲菌株与敏感菌株BcOS1基因的核苷酸序列的对比分析,发现北京地区草莓灰霉病菌抗异菌脲菌株有2种突变类型,以第Ⅰ类为主,即该基因核苷酸序列的第1 214位由ATC 变为AGC,导致第365位氨基酸由异亮氨酸(Ile)变为丝氨酸(Ser),这在礼茜等[3]、Oshima等[7]、Cui等[8]的研究中均有报道,而第Ⅱ类仅在Cui等[8]的报道中出现。此外,本研究还发现第Ⅰ类突变菌株的抗性水平属于中抗和高抗,而发生第Ⅱ类突变的菌株属于低抗菌株。由于本研究只对少部分抗性菌株的BcOS1基因进行了检测,北京地区草莓灰霉菌的抗性菌株是否还存在其他突变类型,以及菌株的不同突变类型与抗药性水平是否存在一定关系,还有待进一步研究。
[1]Mass J L.草莓病虫害概论[M].第2 版.张运涛,张国珍,译.北京:中国农业出版社,2012.
[2]Rosslenbroich H J,Stuebler D.Botrytiscinereahistory of chemical control and novel fungicides for its management[J].Crop Protection,2000,19:557-561.
[3]礼茜,严蕾艳,童英富,等.浙江两地区草莓灰霉病菌(Botrytis cinerea)对扑海因的抗药性及其分子机制[J].果树学报,2007,24(3):344-348.
[4]胡伟群,朱卫刚,张蕊蕊,等.灰葡萄孢多药抗性菌株的筛选和鉴定[J].农药学学报,2011,13(6):586-590.
[5]潘以楼,朱桂梅,郭建.江苏草莓灰霉病菌对5 种杀菌剂的抗药性[J].江苏农业学报,2013,29(2):299-304.
[6]Lerous P,Fritz R,Debiev D,et al.Mechanisms of resistance to fungicides in field strains ofBotrytiscinerea[J].Pest Management Science,2002,58(9):876-888.
[7]Oshima M,Banno S,Okada K,et al.Survey of mutations of a histidine kinase geneBcOS1in dicarboximide-resistant field isolates ofBotrytiscinerea[J].Journal of General Plant Pathology,2006,72:65-73.
[8]Cui W,Beever R E,Parkes S L,et al.Evolution of an osmosensing histidine kinase in field strains ofBotryotiniafuckeliana(Botrytiscinerea)in response to dicarboximide fungicide usage[J].Phytopathology,2004,94:1129-1135.
[9]中华人民共和国农业部.中国农业统计资料[M].北京:中国农业出版社,2012.
[10]Sun H Y,Wang H C,Chen Y.Multiple resistance ofBotrytis cinereafrom vegetable crops to carbendazim,diethofencarb,procymidone,and pyrimethanil in China[J].Plant Disease,2010,94(5):551-556.
[11]黄彰欣.植物化学保护实验指导[M].北京:农业出版社,1993:103.
[12]刘少华,陆金萍,朱瑞良,等.一种快速简便的植物病原真菌基因组DNA 提取方法[J].植物病理学报,2006,35(4):362-365.

