国外甜菜孢囊线虫发生危害、生物学和控制技术研究进展
彭德良,彭 焕,刘 慧
(1.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193;2.全国农业技术推广服务中心,北京 100125)
甜菜孢囊线虫是全世界重要检疫性有害生物,也是我国重要的进境检疫性有害生物[1]。在19世纪后半叶对欧洲甜菜生产造成毁灭性破坏。1850年德国科学家Schacht观察到甜菜块根的须根上长满了白色的球状物,后来认定须根上的这种白色生物体是一种线虫,并认为常规的管理操作是造成甜菜孢囊线虫在欧洲甜菜生产地广泛传播的原因。在欧洲多个国家甜菜产区,甜菜孢囊线虫被公认为极重要的有害生物。本文对该线虫的形态特征及其在国外的发生危害情况进行介绍,旨在为防止甜菜孢囊线虫在我国发生危害提供相关参考。
1 形态特征
1.1 形态测量数据[2]
雌虫:体长626~890μm,体宽361~494μm,口针长27μm;食道长28~30μm,角质层厚度9~12μm。
雄虫:体长1 119~1 438μm;体宽28~42μm;a:32~48,口针长29μm;交合刺长34~38μm;引带长10~11μm;
2龄幼虫:体长435~492μm;体宽21~22μm;口针长25μm。
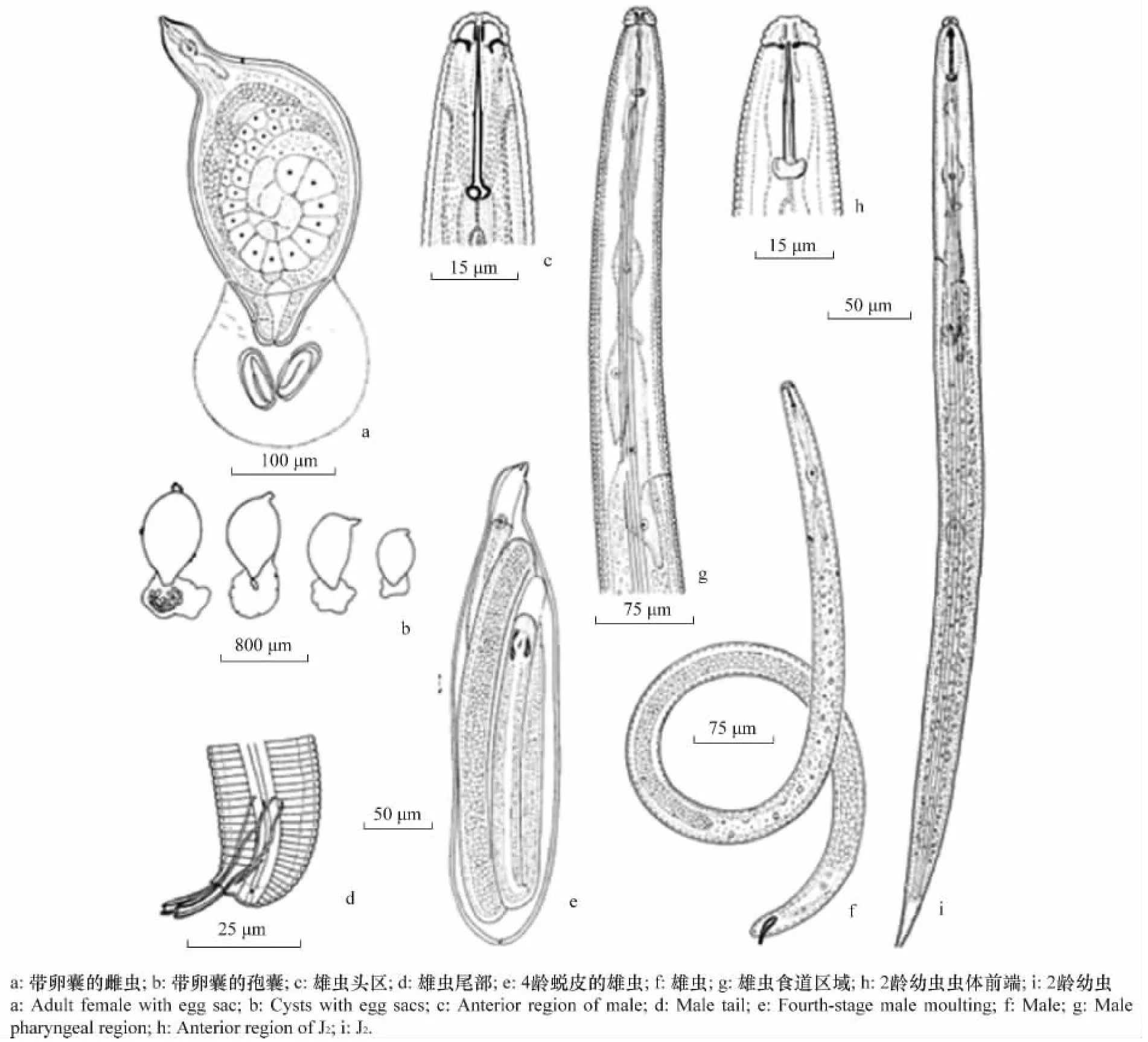
图1 甜菜孢囊线虫形态图[3]Fig.1 Morphology of Heterodera schachtii
1.2 形态特征描述[3]
2龄幼虫:头部缢缩,呈半球形,具有4个环纹,头架骨粗壮,对称。小的侧器孔位于侧区部近口的开口处。体表环纹间距在口针处为1.4μm,而在虫体中部为1.7μm。侧区刻线4条,口针中度粗壮、具有向前突出的基部球。食道前体部似雄虫,但中食道球更突出,背食道腺开口于基部球后3~4μm处。肛门模糊,位于距尾端4倍体宽处。尾部尖锐锥形,末端钝圆,尾部透明区长度为口针长度的1.25倍。生殖原基具有两个细胞核,位于虫体中部靠后位置。侧尾腺模糊,位于肛门稍后。
雌虫:虫体白色,呈瓶状。具短颈插入寄主植物根内,膨大的部分留在根外面。阴门锥被携带卵的胶质团所覆盖。头部小,颈部急剧膨大呈圆柱形;排泄孔位于肩部,从此处开始虫体膨大而呈近球形,直到阴门锥处变小,肛门位于亚尾端。头架弱小,口针弱而小,具有小的基部球,中食道球明显,球形。食道腺覆盖肠的腹面和侧面。双卵巢长而卷曲,少部分卵产于胶质团内,极大部分卵仍留在体内。表皮分3层。外层覆盖脊状的网状结构。
孢囊:表面粗糙,且有微小的皱褶。孢囊阴门锥末端阴门裂几乎等长于阴门桥,阴门裂位于孢囊表皮的肾形薄区的两侧,此区域在较老的孢囊中就只剩下2个孔或者被阴门桥分成2个半膜孔。在阴门锥内,有阴道连接的阴门下桥,下方有许多规则排列的、黑褐色臼齿型泡状突。成熟雌虫和新生孢囊的表面覆盖一层白色蜡状物俗称为“亚水晶层”,当孢囊落于土壤中时,亚水晶层自然脱落。
雄虫:虫体通常为直线形,固定后虫体后1/4部分呈螺旋形旋绕90°~180°;前部渐尖直到颈部,此处宽度仅为体宽的1/2。尾部钝圆,尾长仅为体宽的1/2。侧尾腺孔近肛型。体表环纹清晰,侧区有4条刻线,无网格状结构。头部缢缩,呈圆屋顶状,有3~4 个环纹,头部骨架对称,侧区略狭于亚侧区。裂缝状的侧器孔开口于侧区部接近口的开口处。前头色粒在第2个环纹处,后头色粒在头部缢缩处后第6~8个环纹处。一直延伸到中部形成一纺锤形有瓣膜的中食道球。狭部被神经环缠绕,食道腺覆盖肠的腹面和侧面。背食道腺开口于口针基部球后2μm 处,另2个亚腹食道腺开口处则在中食道球内近瓣膜处。排泄孔位于中食道球后2~3个体宽处。半月体在排泄孔前6~10个体环处。单卵巢,尾钝圆,交合刺弯曲,后部略呈小球状,在前端有刻痕,引带结构简单。
2 生活史
甜菜孢囊线虫以孢囊越冬,孢囊是由雌虫虫体形成,呈柠檬形。每个孢囊含有约600个卵。从孢囊中孵化出来的2龄幼虫(J2)移动到宿主的根部附近,穿刺进入根中,经过短距离的移动到达皮层,然后进入静止寄生状态,6~7d后J2幼虫经历第2次蜕皮发育成3龄幼虫(J3),10~11d后雄性幼虫开始蜕皮成4龄幼虫,14d后完全发育,并且外观上呈细线形。16d后开始从根中出来,在21~43d之间有雄虫持续从根中溢出。在11~12d后雌性3龄幼虫完全发育进行第3次蜕皮发育成典型的细颈瓶型雌虫。15~17d发育后雌虫进行第4次蜕皮。18d后雌成虫身体开始膨大,呈典型的柠檬形,卵巢中充满卵,在根表面可见白色雌虫,30d后卵充满整个体腔[4]。数量不等的卵存储于线虫后部的卵囊中,卵囊保持与雌虫相连,当寄主处在生活力强盛早期时,卵囊中的卵迅即孵化。到寄主生长晚期,由于根系衰老,卵囊中的卵不再孵化,雌虫死亡,体壁硬化,转变成红褐色孢囊。孢囊形成后雌虫内部的器官系统很快降解消失(图2)。
土壤温度对甜菜孢囊线虫的发育影响很大,完成一个世代的发育需要大约30d温度高于10 ℃[5]。2龄幼虫在15℃土壤中活动性最强,卵孵化最适宜温度为20℃,最适的发育温度为18~28 ℃,侵入寄主根系18d后出现成虫,38d后形成褐色孢囊。一年内发生的世代数取决于寄主生长的土壤平均温度,在温带,如欧洲的中西部一年可发生2个完全世代,第3个世代因秋季低温不能完成其生活史;在温暖地区,如地中海、中东地区则较多可产生3个世代,在美国加州一季甜菜上可完成3~5个世代[6]。
3 危害损失和经济重要性
甜菜孢囊线虫对甜菜具有毁灭性危害,在世界范围内给甜菜生产造成了严重的损失。在欧洲由于甜菜孢囊线虫造成的危害,每年的经济损失已经超过9 000万欧元[7]。德国西部种植甜菜每年达44万hm2,其中每年有超过1/4的甜菜面积遭受该线虫危害,一般造成5~350t/hm2的产量损失,严重威胁着当地甜菜生产和制糖业。在伊朗的甜菜种植区,甜菜孢囊线虫病发生非常普遍,已造成了很大的经济损失[8]。该线虫所造成的经济损失因土壤中线虫量的不同而有差异,最严重的可达70%[9]。当土壤中甜菜孢囊线虫幼虫的群体密度达到每克土18条时,可使菠菜减产40%、芜菁甘蓝减产35%、甘蓝减产24%、食用甜菜减产30%。当土壤中群体密度低到每克土6~9个卵和幼虫时,仍然可以造成食用甜菜和甘蓝显著的产量损失;当土壤中群体密度达到最高每克土68个卵和幼虫时,使直播甘蓝和食用甜菜显著减产分别达到51.5%和53.3%[10]。土壤中线虫群体起始数量达到每百克土壤1 000 个卵和幼虫时,不同地方甜菜的产量损失不同,加利福尼亚甜菜损失达到64%,英国矿质土壤甜菜损失达到37%,意大利19%,英国的有机土壤只有1%~14%[11]。
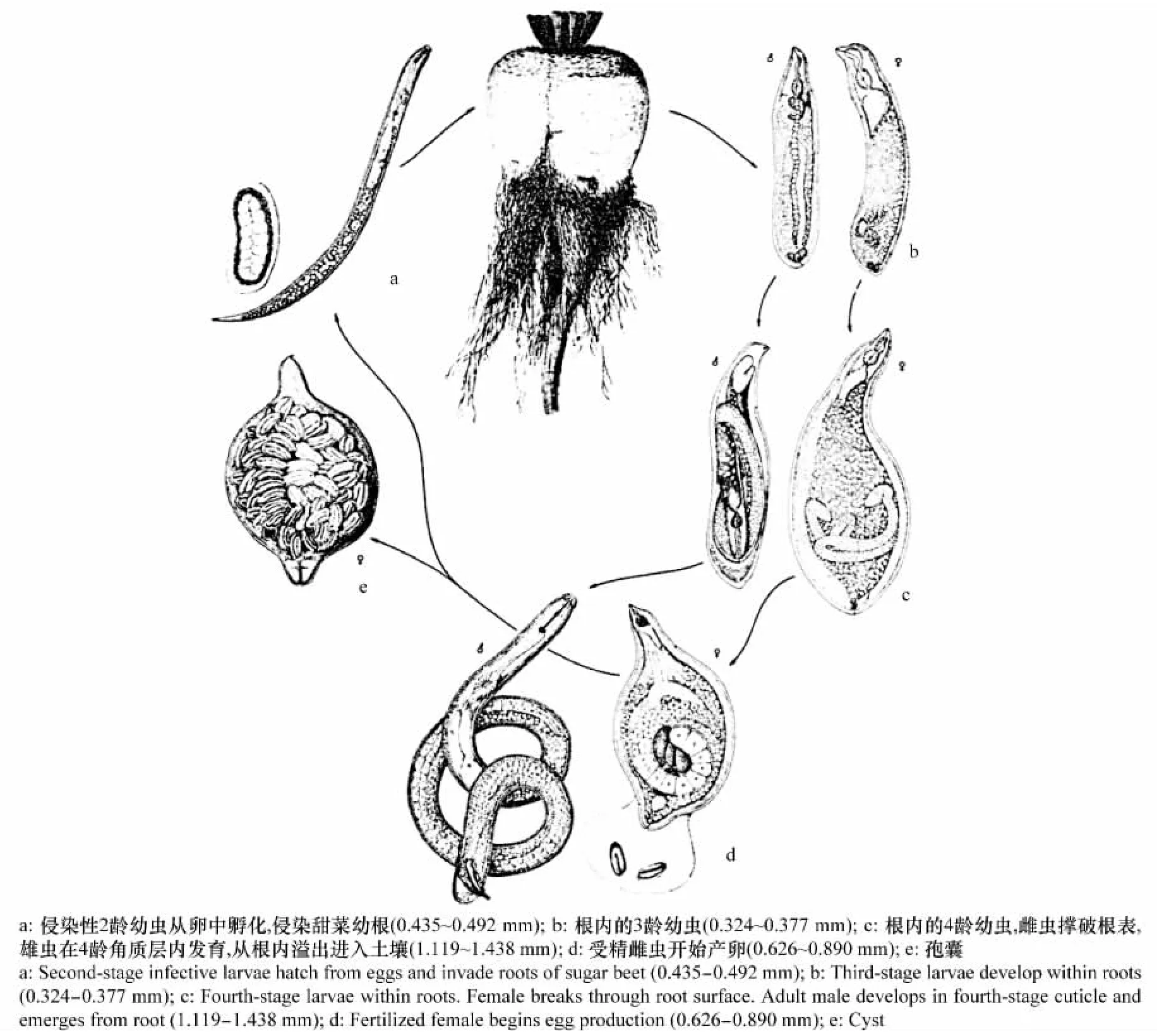
图2 甜菜孢囊线虫生活史[4]Fig.2 Life cycle of the sugar beet cyst nematode,Heterodera schachtii
4 发生分布和寄主范围
甜菜孢囊线虫适宜温带地区,但它的适应性非常广泛,在北美、南美、欧洲和中东的至少50个国家发现了甜菜孢囊线虫的分布,在澳大利亚、新西兰及夏威夷的次大陆也有报道[4]。具体分布国家和地区如下,亚洲:阿塞拜疆、伊朗、伊拉克、约旦、哈萨克斯坦、吉尔吉斯斯坦、韩国、巴基斯坦、乌兹别克斯坦;欧洲:奥地利、比利时、法国、前捷克斯洛伐克、丹麦、德国、意大利、爱沙尼亚、芬兰、英国、荷兰、卢森堡、葡萄牙、西班牙、爱尔兰、希腊、拉脱维亚、摩尔达维亚、波兰、罗马尼亚、瑞典、瑞士、乌克兰、前南斯拉夫、保加利亚;非洲:赞比亚、塞内加尔、南非、加那利群岛、佛得角共和国;北美洲:加拿大、美国(亚利桑那、加利福尼亚、科罗拉多、佛罗里达、爱达荷、堪萨斯、密执安、蒙大拿、纽约、内布拉斯加、北达科他、俄亥俄、俄勒冈、南达科他、犹他、华盛顿、威斯康星、怀俄明)、墨西哥;南美洲:智利、乌拉圭;大洋洲:澳大利亚、新西兰。在我国目前没有发生分布。
该线虫的模式寄主植物是甜菜(Betavulgaris),但是其寄主广泛,23科95属218种大田作物、蔬菜、观赏植物和杂草是其寄主植物[4,12];包括藜科的甜菜(红甜菜、野生甜菜、莙荙菜、叶甜菜)、法国菠菜、菠菜、土荆芥、藜、亨利藜、滨藜、密叶滨藜、大滨藜、臭藜;十字花科的大白菜、油菜、萝卜、野生萝卜、甘蓝、抱子甘蓝、芜菁甘蓝、羽衣甘蓝、青花菜、花椰菜、大头菜、庭荠芹、山庭芥、香雪球、哈密庭荠、辣根、辣根菜、欧洲山芥、芜菁、荠菜、毛果群心菜、七里黄、桂竹香、球状屈曲花、独行菜、诚实花、涩荠、水田芥、两栖蔊菜、沼生蔊、白芥、伦敦大蒜芥、菥蓂;豆科的大豆、胡枝子、南苜蓿、田菁;茄科的龙葵、黑龙葵、智利喇叭花;石竹科的康乃馨、繁缕、须苞石竹、西洋石竹;苋科的北美苋、广布苋、反枝苋和苋菜;白花菜科的醉蝶花;旱金莲科的五裂叶旱金莲;唇形花科的华丽鼬瓣花、鼬瓣花;荨麻科细茎荨麻;蓼科的卷茎蓼、宾州蓼、大黄、小酸模、高山酸模、皱叶酸模、刺酸模、钝叶酸模、沼泽酸模、巴天酸模、琴叶酸模、红脉酸模;马齿苋科的马齿苋;木犀草科的木犀草;玄参科的柳穿鱼;商陆科的美洲商陆;伞形科的莳萝、欧洲防风草。
5 生物学特性
5.1 危害症状
受害甜菜地上部:表现为生长缓慢,苗稀,瘦弱矮小、发育不良。黄化,病株叶片萎蔫,后期叶边缘变黄白干枯死亡,严重受害地块,甚至不能出苗,或出苗推迟或出苗后死亡。严重受害的植株过早萎蔫,枯萎,出现凋落现象,在田块中常常呈斑块状分布[13]。叶部的症状包括叶柄伸长、叶片缩小、叶绿素含量减少、光合效率降低。
受侵染的地下根部:甜菜孢囊线虫严重感染的根部表现出特征性的胡须状表型。侧根增多,根系呈簇须状,表现为白色、浅褐色或者深褐色的须根,须根表面有白色雌虫(判别甜菜孢囊线虫的重要特征),随后白色雌虫死亡变成褐色孢囊,遗落土壤中。须根有时可能表现轻微的根肿,并在线虫侵入位点表现局部坏死。早期的侵染常会导致贮藏根的严重分支和开裂。受侵甜菜的根部产量降低,糖含量也会减少。
5.2 存活时间及存活率
在没有寄主植物存在的情况下,甜菜孢囊线虫在美国犹他州的环境条件下,孢囊内的卵可以存活6年,甜菜休耕12 年后,有少量的甜菜孢囊线虫群体仍然存活[4]。在休耕和缺乏宿主条件下,由于气候及土壤因子对孵化和存活的影响,甜菜孢囊线虫种群年度下降率在40%~60%之间。在英国,休耕及侵染非寄主植物对线虫种群衰退造成的影响表现为孢囊数量、饱满孢囊数量及卵数量年下降率分别为20%、40%及50%[14]。在英国休耕的泥炭土壤中线虫种群的年下降率为48%,在荷兰非寄主植物造成卵的衰退率为38%[4]。在德国种植甜菜后,种植非寄主植物会导致种群在第一年下降60%,接下来的数年里下降45%[15]。
甜菜孢囊线虫成功地侵染和生存的关键除了土壤温度外还有土壤湿度、合适的感病寄主及土壤类型等。在干燥条件下,线虫孵化率和2龄幼虫侵染率急剧下降。湿度从100%下降到98%,孵化率持续下降[16-17]。发现在86%的空气湿度下放置30min或者在82%的空气湿度下放置20min,只有50%的2龄幼虫存活。因此在干燥条件下,甜菜孢囊线虫的繁殖将受到抑制,但浇灌条件良好的沙壤土将有利于线虫的发育和繁殖。同样,高温也将抑制线虫的发育,在干燥的土壤中,60℃条件下10min,62℃条件下5min和65 ℃条件下1min,孢囊中未孵化的幼虫将全部死亡[18]。
5.3 传播方式
线虫每年主动有效迁移距离可能在3~5cm 之间。在同一块田地中或者从一块田地到另一块田地中的迁移主要通过被动迁移。线虫不仅可以通过受侵染土壤转移或日常的农事操作迁移,而且可以通过鸟、牲畜、灌溉水、洪水等自然方式发生传播,含有被侵染土壤的种子也有发现。孢囊也可随风传播[19],这一方式可能是甜菜孢囊线虫快速传播的主要方式。
5.4 土壤中的垂直和水平分布
研究发现,几乎所有的孢囊都分布于5~76cm的土壤中,其中98%的孢囊分布于35cm 以上的土层中,2%分布于35~76cm 的土层中。在侵染早期,83%的孢囊分布在表土10cm 的土壤中,侵染晚期,孢囊垂直分布可达到50cm 深土壤中[19]。在德国,当7月末播种白菜和油用萝卜时,大部分孢囊都在土壤表层10cm 中被发现,在8月末播种植物时,几乎同样数量的孢囊达到10~20cm 的深度。在30~40cm 深的土壤中发现大量有活力的孢囊[4]。显而易见,土壤类型、湿度、温度、感染时期、耕种深度,可能还有各种寄主植物根系生长特点都是决定甜菜孢囊线虫垂直分布的因素。
6 分子检验检测技术
目前国外采用PCR-RAPD和AFLP技术对甜菜孢囊线虫不同群体进行了遗传多样性的研究[20-21]。Tanha等开发了PCR-ITS-RFLP检测甜菜孢囊线虫的技术,采用MvaI能将甜菜孢囊线虫和其他孢囊线虫区分开[22]。Amiri等[23]根据ITS序列的差异,开发了一条甜菜孢囊线虫的特异性引物SHF6,(5′-GTTCTTACGTTACTTCCA-3′),它和ITS下游通用引物rDNA2(5′-TTTCACTCGCCGTTACTAAGG-3′)组合,进行特异性PCR分子检测,能够从甜菜孢囊线虫中扩增出长度为255bp的特异性片段,大大加快了检测速度;在此基础上,Madani等[24]对上述引物进行了优化,设计出一组real time PCR 的检测引物SH6Mod和SH4,能有效地检测甜菜孢囊线虫。
7 传入我国的风险
随着经济全球化和我国一带一路战略的实施,人员交流和国际贸易的日益频繁,我国每年从甜菜孢囊线虫疫区国家进口大量的甜菜种子和加工原料,与我国新疆周边接壤的哈萨克斯坦、吉尔吉斯斯坦、乌兹别克斯坦等国家均有发生危害,该线虫随进口加工原料和种子的杂质传带传入我国的风险极高。李建中等应用MAXENT 与GARP 两种生态位模型对甜菜孢囊线虫传入我国的适生区进行了预测,结果表明该线虫适生范围为26°N~48°N,77.6°E~136°E,可在我国17个省市生存,我国内蒙古南部、新疆西部、河北中南部、山西东北部、宁夏、甘肃北部是该线虫入侵的高风险区,北京、天津、陕西、山西大部、内蒙古西部和东南部、吉林西部、新疆北部是该线虫发生的中风险区,目前我国的甜菜主要种植区域为内蒙古、新疆、甘肃等省市区,甜菜孢囊线虫暴发的风险极大[25]。
8 控制技术
8.1 加强检疫
严格控制从疫区进口种子及带根的植物繁殖材料,是防止甜菜孢囊线虫传入的首要措施。入境检验发现甜菜孢囊线虫,一律做退运、转口和销毁处理。严格禁止从疫情发生区调运甜菜种子和甜菜储存根原料,防止甜菜孢囊线虫从疫区传入非疫区;禁止种子和甜菜储备在发病区和非发病区之间流通;禁止制糖工厂的废土运回田间,以防此过程中将甜菜孢囊线虫传入其他甜菜种植区;严禁疫区感染土壤、植物、农事器械、清洁工具、装载工具、污染的农场和糖厂废料带到非发病区;孢囊还可以存活于经过牛消化道之后的甜菜残渣中,而随残渣传播,因此应注意对其进行妥善处理。
8.2 轮作
与非寄主作物轮作是一种有效的防治方法,发病中等和轻微的地块实行与非寄主轮作3~6年以上,使用禾本科玉米或豆科植物苜蓿轮作很有效。发病严重的可实行6年轮作。在合适的温度和水分条件下,甜菜孢囊线虫均可孵化,因此孵化后在没有寄主的情况下,种群数量会迅速降低50%。大范围的轮作可以很好地将线虫数量降低到危害水平以下。
8.3 调节播种期
在植物弱小时,受到孢囊线虫侵染将造成植株生长不良或死苗的现象,因而造成的危害和产量损失将更大,因此在土温相对较低,未达到甜菜孢囊线虫孵化温度时,提前播种或移栽作物,可以有效降低对植株的危害和产量损失。
8.4 生物防治
一些土壤真菌在自然条件下能协同降低甜菜孢囊线虫种群数量(或增长率),这些真菌有厚垣轮枝孢菌(Verticilliumchlamydosporium),环孢霉(Cylidrocarpondestructans),辅助链枝菌(Catenariaauxiliaris)和直立顶孢霉(Acremoniumstrictum)。
8.5 化学防治
发生严重且面积较小的田块,实行土壤熏蒸消毒处理,力争扑灭疫情点。可采用98%棉隆或者35%威百亩土壤消毒,然后实施与非寄主轮作措施,6年内不再种植寄主植物甜菜、白菜、甘蓝等作物。具体使用方法:施药前先将土壤整平耙碎,并保持土壤湿润(处理前保持土壤含水量为60%~70%左右),将98%棉隆颗粒剂10kg/667m2,均匀撒播于土壤表面,然后用细齿耙将颗粒剂混入土壤20cm深,将土面压实洒水密封或覆盖塑料薄膜(黑色薄膜或白色农膜均可),3 周后揭膜松土,松土时不要超过处理的土壤深度。棉隆对植物有毒害作用,在施药与播种之间要间隔半个月以上。
发生程度中等且面积较大的田块,使用内吸杀线虫剂处理,降低土壤线虫基数。可先施用10%阿维菌素颗粒剂、1.8%阿维菌素乳油、10%噻唑膦(福气多)颗粒剂等药剂进行土壤处理,然后采取轮作措施,与非寄主植物油葵和玉米等轮作3 年以上。1.8%阿维菌素乳油1mL/m2,兑水1 000mL,喷洒土表,然后翻耕。10%的阿维菌素颗粒剂5kg/667m2和10%噻唑膦颗粒剂2kg/667m2,在甜菜栽种行开沟、撒施、覆土。
[1]中华人民共和国进境植物检疫性有害生物名录,中华人民共和国农业部第862号公告(2007-05-29[EB/OL].http:∥www.moa.gov.cn/ztzl/gjzwbhgy/tjxx/201205/t20120506_2617764.htm.
[2]Raski D J.The life history and morphology of the sugar beet nematode,HeteroderaschachtiiSchmidt[J].Phytopathology,1950,40:135-152.
[3]Franklin M T.Heteroderaschachtii.CIH Descriptions of plant parasitic nematodes,Set 1,No.1[R].St Albans,UK:Commonwealth Institute of Helminthology,1972:4.
[4]Steele A E.Nematode parasites of sugar beets[M]∥Nickle W R.Plant and insect nematodes.New York:Marcel Dekker,1984:507-569.
[5]Greco N,Brandonisio A,de Marinis G.Tolerance limit of the sugarbeet toHeteroderaschachtii[J].Journal of Nematology,1982,14:199-202.
[6]Thomason I J,Fife D.The effect of temperature on development and survival ofHeteroderaschachtiiSchm.[J].Nematologica,1962,7:139-145.
[7]Müller J.The economic importance ofHeteroderaschachtiiin Europe[J].Helminthologia,1999,36:205-213.
[8]Esmailpour M H,Schäfer R.Auftreten von Rübennematoden(Heteroderaschachtii)in Iran(Occurrence of sugar beet nematodes(Heteroderaschachtii)in Iran)[J].Entomologie et Phytopathologie Appliquees(Teheran),1970,29:6-7.
[9]Altman J,Thomason I.Nematodes and their control[M]∥Johnson R T,Alexander J T,Rush G E,eds.Advances in sugar beet production:Principles and practices.Ames,IA:The Iowa University Press,1971:335-367.
[10]Lear B,Miyagawa S T,Johnson D E,et al.The sugar beet nematode associated with reduced yields of cauliflower and other vegetable crops[J].Plant Disease Report,1966,50:611-612.
[11]Cooke D.Nematodes parasites of sugarbeet[M]∥Evans K,Trudgill D L,Webster J M,eds.Plant parasitic nematodes in temperature agriculture.Wallingford,UK:CAB International,1993:133-170.
[12]Steel A E.The host range of the sugar beet nematodeHeteroderaschachtiiSchmidt[J].Journal of American Society of Sugar Beet Technology,1965,13:573-603.
[13]Polychronopoulos A G,Lownsbery B F.Effect ofHeteroderaschachtiion sugar beet seedings under monoxenic conditions[J].Nematologica,1968,14:526-534.
[14]Jones F G W.Soil populations of the beet eelworm(Heterodera schachtii)in relation to cropping,micro-plot and field plot results[J].Annals of Applied Biology,1956,44:25-56.
[15]Olthof T H A,Potter J W,Peterson E A.Relationship between population densities ofHeteroderaschachtiiand losses in vegetable crops in Ontario[J].Phytopathology,1974,64:549-554.
[16]Wallace H R.Factors influencing the emergence of larvae from cysts of the beet eelworm,HeteroderaschachtiiSchmidt[J].Journal of Helmintology,1955,29:3-16.
[17]Ellenby C.The survival of desiccated larvae ofHeteroderarostochiensisiandH.schachtii[J].Nematologica,1968,14:544-548.
[18]Steele A E.The effects of hot water treatments on survival ofHeteroderaschachtii[J].Journal of Nematology,1973,4:250-256.
[19]Whitehead A G.Vertical distribution of potato,beet and pea cyst nematode in same heavily infested soils[J].Plant Pathology,1977,26:85-90.
[20]Caswell-chen E P,Williamson V M,Wu F F.Random amplified polymorphic DNA analysis ofHeteroderacruciferaeandH.schachtiipopulations[J].Journal of Nematology,1992,24:343-351.
[21]Madani M,Kyndt T,Colpaert N,et al.Polymorphism among sugar beet cyst nematodeHeteroderaschachtiipopulations as inferred from AFLP and ITS rRNA gene analyses[J].Russian Journal of Nematology,2007,15:117-128.
[22]Tanha M Z,Subbotin S A,Mones M.Molecular identification of cyst-forming nematodes(Heteroderidae)from Iran and a phylogeny based on the ITS sequences of rDNA[J].Nematology,2003,5:99-111.
[23]Amiri S,Subbotin S A,Moens M.Identification of the beet cyst nematodeHeteroderaschachtiiby PCR [J].European Journal of Plant Pathology,2002,108:497-506.
[24]Madani M,Subbotin S,Moens M.Quantitative detection of the potato cyst nematodes,Globoderapallida,and the beet cyst nematode,Heteroderaschachtii,using real-time PCR with SYBR Green I dye[J].Molecular Cellular Probes,2005,19:81-86.
[25]李建中,彭德良,刘淑艳.潜在外来入侵甜菜孢囊线虫在中国的适生性风险分析[J].植物保护,2008,34(5):90-94.

