大血藤抗氧化及抗菌活性研究
孙惠芳, 马瑞丽, 徐秀泉, 汤 建*, 欧阳臻
(1.江苏大学 药学院, 江苏 镇江 212013;2.定西市农业科学研究院,甘肃 定西 743000)
大血藤抗氧化及抗菌活性研究
孙惠芳1, 马瑞丽2, 徐秀泉1, 汤 建1*, 欧阳臻1
(1.江苏大学 药学院, 江苏 镇江 212013;2.定西市农业科学研究院,甘肃 定西 743000)
本文评价了大血藤乙醇提取物和石油醚、二氯甲烷、乙酸乙酯和水部位的体外抗氧化和抑菌活性以及与总酚含量的相关性。采用清除DPPH自由基法、Fe3+还原力法评价了各部位的抗氧化活性,采用纸片扩散法评价各部位的抑菌活性。采用Folin-Ciocalteu法测定各部位总酚含量,并采用HPLC-UV解析活性部位物质基础。结果表明,水部位清除DPPH能力最强(IC505.53 μg/mL),优于对照组Vc,其它部位顺序为乙酸乙酯部位>乙醇提取物>二氯甲烷部位>石油醚部位,还原Fe3+的能力顺序与此相同。总酚含量与抗氧化活性正相关。石油醚部位、二氯甲烷部位、乙酸乙酯部位有中等强度的抑制革兰氏阴性菌作用。表明大血藤可能会成为有价值的天然抗氧化和抗菌资源。
大血藤;抗氧化;抗菌;总酚含量
大血藤为我国特有植物,是大血藤科(以前归于木通科)大血藤属大血藤[Sargentodoxacuneata(Oliv. ) Rehd. et Wils.],别名红皮藤、大活血、红藤等,为传统中药材,具有清热解毒、理气活血、祛风杀虫、消肿散结等作用,临床用以治疗阑尾炎、风湿痹痛、跌打肿痛等[1]。据文献报道其含有多种化学组分,包括酚酸类、木脂素、三萜皂苷、黄酮、蒽醌等化学成分,药材的乙醇提取物和水煎剂具有抑菌、抗氧化、抗炎免疫等作用[1,3]。
一些抗氧化天然产物,如:咖啡酸苯乙酯(CAPE)和姜黄素(curcumin) 具有显著的抗衰老和神经保护活性[4-5]。为研究大血藤抗氧化和抗菌的活性组分,本文研究中筛选了大血藤的抗氧化、抗菌活性部位,并初步分析了活性部位的咖啡酸、绿原酸和总多酚含量。
1 材料与仪器
大血藤药材购于安徽亳州药材市场,经本实验室欧阳臻教授鉴定为大血藤科大血藤属植物大血藤SargentodoxacuneataRehd. et Wils.)。DPPH自由基购于Sigma公司;Folin-Ciocalteu’s 试剂购于 Merck 公司;液相用色谱纯甲醇,双纯水;其它试剂为分析纯。绿原酸、咖啡酸为实验室自制,纯度(归一化法)>98%。
R-21旋转蒸发仪(Buchi);LC-20A高效液相色谱仪(Shimadzu);Sartorius电子天平;高速中药粉碎机(瑞安市永历制药机械有限公司)。
2 实验方法
2.1 大血藤各部位的制备
80 g 药材干燥,粉碎(10~20目),800 mL 80% 乙醇回流提取2次,每次2 h。提取液减压浓缩得浸膏17.54 g (21.9% w/w)。加水混悬后用石油醚、二氯甲烷和乙酸乙酯依次液-液萃取,蒸除溶剂得石油醚部位(ESCp)、二氯甲烷部位(ESCd)和乙酸乙酯部位(ESCe)。剩余水相上HP 20大孔树脂柱 (4.0 cm×35 cm), 用5BV的水洗去单糖、寡糖、黏液和其它杂质, 再用5BV的95%乙醇洗脱,蒸除溶剂得到剩余水部位(ESCa)。ESCp、ESCd、ESCe及ESCa的得率分别为 0.11 g (0.8% w/w)、0.77 g (5.5% w/w)、2.09 g (14.9% w/w)和4.77 g (34.1% w/w)。样品测试前保存于-20℃。
2.2 抗氧化实验
2.2.1 DPPH自由基清除实验
参照文献[6],分别取大血藤各部位待测液20,50,100,200,400 μL于具塞试管中,加蒸馏水至1 mL,再加入60%乙醇溶液2 mL,0.1 mmo1/L DPPH溶液1mL ,摇匀,暗处静置30 min。用60%乙醇(空白对照)调零,在517 nm波长下测定吸光度A。维生素C为阳性对照。DPPH清除率按公式:清除率=[A空白-(A样品-A对照)/A空白]×100% 计算。
2.2.2 Fe3+还原力测定
参文献[7],分别取大血藤各部位待测液50,100,200,300,400 μL于具塞试管中,各自补充蒸馏水至1 mL,加入pH为6.6的磷酸盐缓冲液2.5 mL和1%铁氰化钾溶液2.5 mL,混合后置于50 ℃水浴中20 min,加入10%三氯乙酸溶液2.5 mL,4 800 r/min离心10 min,取上清液2.5 mL,加入2.5 mL蒸馏水和0.1%三氯化铁2.5 mL,混匀,静置10 min,在700 nm处测定吸光度,用蒸馏水调零(空白对照)。维生素C(Vc)为阳性对照。
2.3 抗菌实验
参照纸片扩散法[8],金黄色葡萄球菌(ATCC 12600,G+), 绿脓杆菌 (ATCC 10145,G-), 大肠杆菌 (ATCC 11775,G-)和克雷伯氏肺炎菌 (ATCC 13883,G-)于4 ℃在熔融Mueller-Hinton 营养琼脂上培养。 10 μL样品(20 mg/mL) 滴加到纸片,新霉素(neomycin,500 μg/mL) 为阳性对照药,于37 ℃培养18 h后测定抑菌圈。
2.4 总多酚含量测定
参照文献[6],以Folin-Ciocalteu法测定样品中的总多酚含量。用不同浓度没食子酸 (1.0~7.0 μg/mL)制备标准曲线。吸取1 mg/mL浓度的样品溶液0.1 mL,置于10 mL容量瓶中,加入6 mL蒸馏水,和0.5 mL Folin-Ciocalteu试剂,混匀,0.5~8 min内加入1.5 mL 20%Na2CO3溶液,加蒸馏水加溶剂稀释至刻度至10 mL,混匀。75 ℃水浴10 min,以空白试剂调零,在760 nm波长下测定吸光度。
2.5 HPLC-UV分析
色谱柱:Kromasil C18(4.6 mm×250 mm,4.5 μm);流动相:A为1%冰醋酸水溶液,B为甲醇,以A ∶B=68 ∶32等度洗脱;柱温:30℃;流速:1 mL/min;检测波长:327 nm;进样量:20 μL。
配置绿原酸、咖啡酸混合标准液,浓度分别为25.6,4.2 μg/mL,采用倍半法逐级稀释,所有样品进样前经0.45 μm微滤膜过滤,制备两种化合物的标准曲线。
分别精密称取大血藤乙醇提取物、石油醚萃取物、二氯甲烷萃取物、乙酸乙酯萃取物、剩余水部位粉末8.0,8.2,8.4,5.08,8.4 mg,分别用甲醇加溶剂稀释至刻度至10 mL,进样前经0.45 μm微孔滤膜滤过,分别测定5种样品中绿原酸、咖啡酸的含量。
3 结果与讨论
3.1 清除DPPH自由基活性
除石油醚部位,其它各部位都具有良好的清除DPPH·能力。水部位的清除能力最强,其IC50为5.53 μg/mL,小于Vc的IC50(7.10 μg/mL)。乙酸乙酯部位、二氯甲烷部位、乙醇提取物和石油醚部位的IC50值分别为 5.89 μg/mL,26.62 μg/mL,26.81 μg/mL 和152.22 μg/mL (图1(A))。各部位清除DPPH·能力均呈剂量依赖性。

图1 大血藤各部位的清除DPPH·活性(A)及Fe3+还原力活性(B)
3.2 Fe3+还原力测定
还原力是抗氧化物质提供电子的重要指标。如图1(B)所示,各部位能量依赖性地还原Fe3+,水部位和乙酸乙酯部位的还原力强于其它部位,但明显弱于Vc。
3.3 抗菌活性
大血藤临床上用以治疗急性阑尾炎和盆腔炎,可能与药材的抗菌作用相关。表1数据表明,大血藤乙醇提取物和水部位抑菌活性较弱,乙酸乙酯部位和二氯甲烷部位的抑菌活性较强,并且表现出针对革兰氏阴性菌的敏感性,对革兰氏阳性菌的抑菌率几为0。石油醚部位对四种菌的抑制率接近,未表现出选择性。
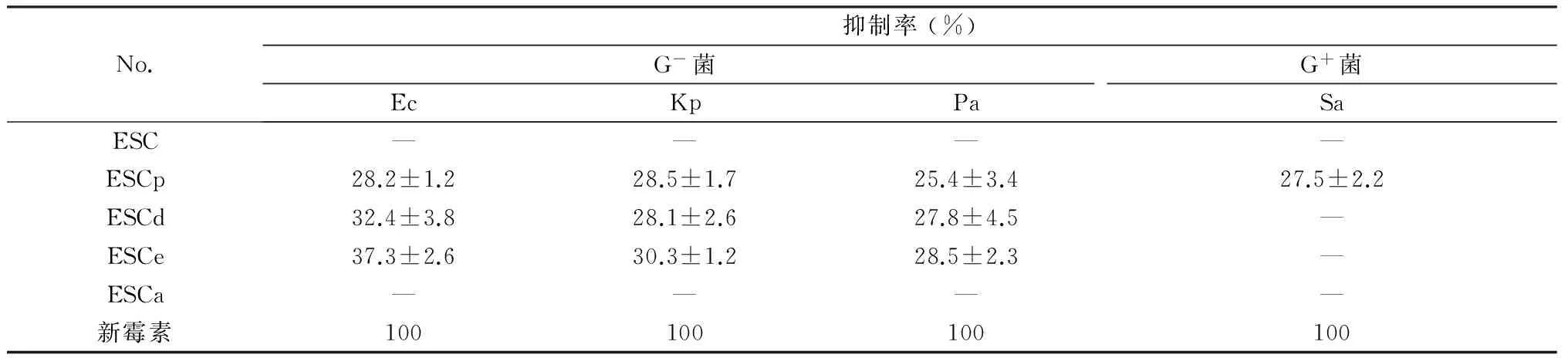
表1 大血藤各部位的抑菌活性
注:Ec:大肠杆菌,Kp:克雷伯氏肺炎菌,Pa:绿脓杆菌,Sa:金黄色葡萄球菌。
3.4 大血藤各部位总多酚含量测定
没食子酸标准曲线方程为:y=0.117 4x+0.013 9 (r2=0.999 6),在1.0~7.0 μg/mL范围内范围线性关系良好。采用Folin-Ciocalteu测定各部位总多酚含量,如表2所示,水部位的总多酚含量为449.83 mg/kg,高于乙酸乙酯部位(346.76 mg/kg),二氯甲烷部位(238.59 mg/kg) 和乙醇提取物 (242.84 mg/kg),石油醚部位的总多酚含量最低,为63.69 mg/kg。总多酚的含量与清除DPPH自由基和还原力高度相关,这意味着总多酚可能是抗氧化活性的主要活性成分。但与抗菌活性关联性不强。
3.5 大血藤各部位中绿原酸和咖啡酸的含量测定
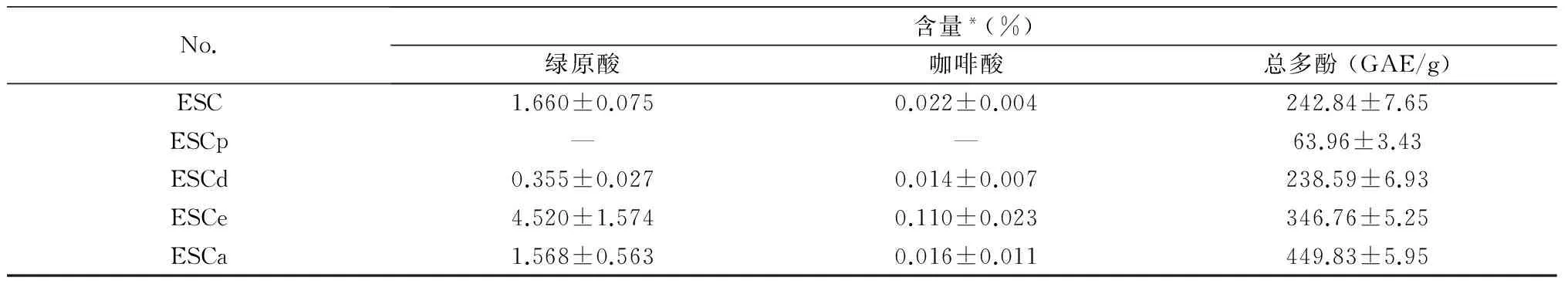
表2 大血藤各部位总多酚和2种化合物的含量测定
注:*与浸膏的质量比(w/w);—:未检测到。
前期研究中发现绿原酸、咖啡酸含量较高,且均有良好的抗氧化等活性,因此考察各部位中这两种化合物的含量。绿原酸回归方程:y=29 384x-9 917,r2=0.999 9,0.8~25.6 μg/mL范围内线性关系良好;咖啡酸回归方程:y=64 087x-618.65,r2=0.999 2,0.1~4.2 μg/mL范围内线性关系良好。绿原酸、咖啡酸的含量参见表2。 乙酸乙酯部位中绿原酸和咖啡酸的含量最高,水部位次之。说明绿原酸和咖啡酸是药材抗氧化的重要物质基础。
4 结 论
关于大血藤的抗氧化和抑菌实验数据有力佐证了该药材在抗菌抗炎的传统应用,也表明该药材可能会成为有价值的天然抗氧化和抗菌资源。优选出乙酸乙酯部位和水部位为活性部位,并利用HPLC-UV技术初步确定活性部位的主要物质基础,药材所含酚酸类化合物是大血藤药材抗氧化、抑菌作用的主要活性成分,但不是唯一的活性成分,可能存在含量较低但活性显著的化合物,需要进一步的研究,以其发掘该药材中活性更显著的抗氧化和抑菌活性组分。
[1] 中华本草编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1998: 571-574.
[2] Damu A G, Kuo P C, Shi L S, et al. Chemical constituents of the stem ofSargentodoxacuneata[J]. Heterocycles, 2003, 60: 1645-1652.
[3] Li H B, Wong C C, Cheng K W, et al. Antioxidant properties in vitro and total phenolic contents in methanol extracts from medicinal plants[J]. LWT-Food Sci Technol, 2008, 41: 385-390.
[4] Atilla I, Mustafa I, Ahmet G, et al. Caffeic acid phenethyl ester exerts a neuroprotective effect on CNS against pentylenetetrazol-induced seizures in mice[J]. Neuroch Res, 2004, 29: 2287-2292.
[5] Lima C F, Pereira-Wilson C, Rattan S I S. Curcumin induces heme oxygenase-1 in normal human skin fibro- blasts through redox signaling: Relevance for anti-aging intervention[J]. Mol Nutr Food Res, 2011, 55: 430-442.
[6] 王辉, 罗应, 梅文莉. 七叶兰叶片的抗氧化特性[J]. 天然产物研究与开发, 2012, 24: 219-223.
[7] Athukorala Y, Kim, K N, Jeon Y. Antiproliferative and antioxidant properties of an enzymatic hydrolysate from brown alga, Ecklonia cava[J]. Food Chem Toxicol, 2006, 44: 1065-1074.
[8] Rani P, Khullar N. Antimicrobial evaluation of some medicinal plants for their anti-enteric potential against multi-drug resistantSalmonellatyphi[J]. Phytother Res, 2004, 18: 370-673.
[9] 林永强, 徐丽华, 王淑华. 单一标志对引黄药物同时定量六种绿原酸多组分质量分析[J]. 中草药, 2012, 43: 706-710.
[10] Chang J, Case R. Phenolic glycosides and ionone glycoside from the stem ofSargentodoxacuneata[J]. Phytochemistry, 2005, 66: 2752-2758.
Antioxidant and Antibacterial Properties ofSargentodoxacuneata
Sun Huifang1,Ma Ruili1,Xu Xiuquan1, Tang Jian1*,Ouyang Zhen1
(1.School of Pharmacy, Jiangsu University, Zhenjiang 212013, China; 2.Dingxi Municipal Dryland Farming Research and Extension Center, Dingxi 743000, China)
In present study, the potential antioxidant and antibacterial activities of the ethanol extract (ESC) and petroleum ether-(ESCp), dichloromethane-(ESCd), ethyl acetate-(ESCe), and aqueous soluble-(ESCa) fractions ofSargentodoxacuneatawere evaluated, as well as the correlation with total phenolics content. The antioxidant activities were evaluated with scavenging DPPH radical and reducing power assays. The antibacterial activity was evaluated using the disc diffusion assay. The content of total phenolics was determined by the Folin-Ciocalteu colorimetric method, with the HPLC-UVfor further analysis of bioactive subfraction. The results showed that ESCa scavenged DPPH potently (IC505.53 μg/mL), superior to ascorbic acid, followed by ESCe, ESC, ESCd, ESCp, the same to reducing power. The total phenolics content in samples was highly correlated with the antioxidant activity. ESCp, ESCd and ESCe inhibited moderately Gram-negative bacteria. These results validated the potential use of this plant as antioxidant and anti-bacterial agent.
Sargentodoxacuneata; antioxidant; antibacterial; total phenolics content
2014-08-28
国家博士后基金(2012M521023);江苏省博士后基金(1201027B)。
孙惠芳,女,硕士研究生,主要从事神经保护植物化学成分研究。
*通讯作者:汤建,男,博士,副教授。E-mail:jt.u@hotmail.com
10.3969/j.issn.1006-9690.2015.03.004
R285;Q946.8
A
1006-9690(2015)03-0016-04

