藤茶叶片总RNA的提取及苯丙氨酸解氨酶基因(pal)片段的克隆
许 明, 杨志坚, 郑金贵
(福建农林大学 作物科学学院, 福建 福州 350002)
藤茶叶片总RNA的提取及苯丙氨酸解氨酶基因(pal)片段的克隆
许 明, 杨志坚, 郑金贵
(福建农林大学 作物科学学院, 福建 福州 350002)
藤茶叶片富含多酚、多糖以及黄酮类化合物,严重干扰了其总RNA的提取。实验在裂解前先用70%丙酮对藤茶叶片冷冻研磨材料进行多次抽提,然后采用试剂盒提取法、Trizol法和异硫氰酸胍法提取总RNA。结果表明,经丙酮预处理后,上述3种方法均能从藤茶叶片中成功提取到高质量的RNA,其完整性好,纯度高,D260 nm/D280 nm值介于1.8~2.0之间,产率为22.74~33.66 μg/g。以提取的总RNA逆转录的cDNA为模板进行RT-PCR,克隆到一条长度为817 bp的pal片段。经Blast比对分析,该基因片段与葡萄、茶树等物种的pal之间具有较高的同源性。
藤茶;叶片;总RNA提取;PAL
藤茶学名为显齿蛇葡萄(AmpelopsisgrossedentataW.T.Wan),是中国特有的一种茶药两用植物资源,主要分布于湖北、湖南、广西、江西、福建、贵州等地[1],具有抗炎、镇痛、抑菌、降血压、降血糖、保肝护肝及增强免疫力等多种功效[2-4]。研究表明,藤茶的有效活性成分主要是黄酮类化合物,其茎叶中的总黄酮含量高达40%左右[5-9],含量之高在植物界十分罕见。除此之外,藤茶还富含多糖、多酚、氨基酸、维生素等多种有效成分[9]。因此,藤茶可作为一种集营养、保健和药用功能为一体的天然植物资源加以开发利用。
目前关于藤茶黄酮类化合物的提取检测及药理功能有较多研究报道[10],但在分子生物学方面仅有少量研究[11]。黄酮类化合物是经苯丙氨酸代谢途径(phenylpropanoid pathway)合成的[12],该途径的第一个反应是苯丙氨酸解氨酶( PAL,EC 4.3.1.5)催化苯丙氨酸生成肉桂酸,苯丙氨酸解氨酶被认为是黄酮类物质生物合成的第一个关键酶和限速酶[13]。迄今已有大量植物的pal被鉴定和分离(仅在GenBank上登录的就有1000多条),但关于藤茶pal的研究尚未见报道。高质量RNA的提取是顺利开展基因克隆等分子生物学研究的重要前提,由于藤茶富含多酚、多糖及黄酮等化合物,严重干扰了其总RNA的提取,一些常规方法及试剂盒都不能有效地提取出藤茶叶片总RNA。本实验在前人研究的基础上[14-17],先利用丙酮预处理来去除多糖、多酚等物质,再采用试剂盒提取法、Trizol法和异硫氰酸胍法进行提取,成功从藤茶叶片分离到高质量的总RNA,并以其反转录的cDNA为模板进行RT-PCR,克隆出藤茶苯丙氨酸解氨酸的基因片段,为后续开展藤茶黄酮类化合物的合成与代谢调控研究奠定基础。
1 材料与方法
1.1 材料
本实验所用的藤茶引自福建尤溪县下村林场,移栽于福建农林大学作物科学学院试验基地种植。取其幼叶作为RNA提取材料。
Trizol试剂购于Invitrogen公司;EASYspin Plus植物RNA快速提取试剂盒(RN38)和胶回收试剂盒购自北京艾德莱生物科技有限公司;DEPC(Amresco)和异硫氰酸胍(Amresco)购自北京鼎国生物科技有限公司;Prime Script RT-PCR Kit、DNA marker及pMD18-T载体购于Takara公司。引物由上海英骏生物技术有限公司合成,其他试剂均为国产分析纯。
实验所用的研钵、药勺、量筒等与实验材料有接触的器皿用铝箔纸包裹,于180℃烘烤2h后备用;各种枪头、离心管用0.1%的DEPC水浸泡过夜,再高压灭菌后备用。
1.2 方法
1.2.1 RNA提取
取0.2 g新鲜的叶片材料置于预冷的研钵中,加少量PVP,用液氮快速研磨成粉末,分装于两个预先装有1 mL冰冷70%丙酮的1.5 mL离心管中,温和震荡,8000 r/min,4℃离心10 min,去上清液,重复抽提3次。然后分别采用试剂盒提取法、Trizol和异硫氰酸胍法进行RNA提取。其中试剂盒提取法和Trizol法的操作步骤按照厂商提供的操作说明书进行。异硫氰酸胍法参考李志能等[18]的方法进行操作并略有改进,具体步骤如下:1)在上述丙酮抽提后的样品中加入预冷的500 μL异硫氰酸胍buffer(0.75 mol/L柠檬酸钠pH值7.0,10%十二烷基肌氨酸,4.0 mol/L异硫氰酸胍,2%PVP),轻轻摇动离心管使混合均匀。2)依次加入0.4 mol/L NaAc 0.5 mL、水饱和苯酚5 mL、氯仿/异戊醇1 mL,混合均匀,冰浴15 min。3)4℃条件下12000 r/min离心30 min,转移上层水相至另一离心管,加入等体积的异丙醇,-20℃放置1 h。4)4℃条件下12000 r/min离心25 min,去上清,沉淀用70%乙醇洗一次,晾干后溶于30 μL体积的DEPC水中。
1.2.2 RNA检测
用U2000紫外分光光度计测D260 nm和D280 nm,并计算它们的比值以分析RNA的纯度。用1.0%琼脂糖凝胶电泳检测RNA的完整性。
RNA产率=D260 nm×N(稀释倍数)×40 mg/L×V(体积)/样品质量(g)[17]
1.2.3pal片段的克隆
采用Takara公司的Prime Script RT-PCR Kit合成第一链cDNA。在GeneBank中检索其他植物的pal序列信息,用DNAMAN6.0软件进行多序列比对,根据同源性较高的区域设计简并引物PALRT-1(5′-GGCACVRTCACYGCCTCCGG-3′)和PALRT-2(5′-TCTCCTCCAAATGCCTCAARTC-3′)。以第一链cDNA为模板进行PCR扩增。PCR反应体系为25 μL:反转录产物的10倍稀释液1 μL,上下游引物(10 μmol/L )各1 μL,10×PCR Buffer 2.5 μL,EXTaq酶1 μL,dNTP (10mmol/L each) 2.0 μL,ddH2O补齐至25 μL。PCR扩增程序为:94 ℃变性5 min;94 ℃变性45 s, 56℃退火40 s, 72℃延伸1 min,共30个循环;72 ℃终延伸10 min。PCR产物经1%的琼脂糖凝胶电泳,回收后与pMD18-T载体连接,转化大肠杆菌E.coliDH5α。选取PCR阳性克隆送至上海英骏生物技术有限公司测序,在NCBI网站上通过BLAST程序对测序结果进行同源性比对分析。
2 结果
2.1 RNA质量分析
藤茶叶片先经过70%的冷丙酮抽提处理后,再分别采用试剂盒提取法、Trizol法和异硫氰酸胍法对其总RNA进行提取和分析,结果如表1和图1所示。从表1可以看出,3种方法提取的RNA的D260 nm/D280 nm均在1.8~2.0之间,表明所提取RNA的纯度均较好。其中试剂盒提取的RNA的D260 nm/D280 nm达到1.927,是3种方法中最高的,说明该法提取的RNA纯度最好。从RNA产率上看,Trizol法的RNA产率最高,为33.66 μg/g FW,异硫氰酸胍法次之,为27.60 μg/g FW,试剂盒提取法最低,为22.74 μg/g FW。在RNA完整性方面,3种提取方法获得的总RNA经琼脂糖凝胶电泳,均可见明显的28S和18S两条带(图1),未见明显降解和DNA污染。由此可见,先用70%丙酮对藤茶叶片预处理后,上述3种方法均可以提取到高质量的RNA。

表1 3种方法提取藤茶叶片总RNA的D(入)值及产率

1—丙酮预处理+RNA提取试剂盒; 2—丙酮预处理+Trizol法; 3—丙酮预处理+异硫氰酸胍法。
图1 3种方法提取藤茶叶片总RNA电泳检测结果
Fig 1 Electrophoresis result of total RNA extracted with three methods fromAmpelopsisgrossedentataleaves.
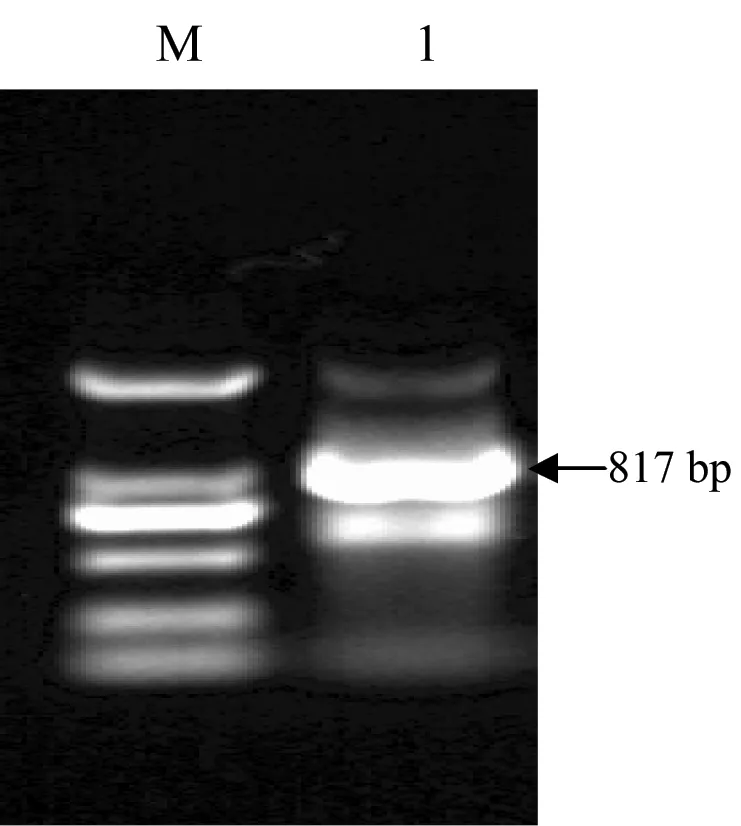
M—DL2000 DNA Marker; 1—pal片段。
图2 RT-PCR扩增产物的电泳图
Fig 2 RT-PCR amplified products separated on 1% agarose gel
2.2 藤茶pal保守区段的克隆与序列分析
以试剂盒提取的藤茶叶片总RNA反转录的第一链cDNA为模板,用简并引物PALRT1和PALRT2进行藤茶pal片段的RT-PCR扩增,结果在750 bp和1000 bp之间出现一条清晰的特异性条带(图2)。经测序,该片段长度为817 bp,推导编码272个氨基酸(图3)。将获得片段序列提交到NCBI网站进行BLAST同源性比对,发现该序列与葡萄(Vitisvinifera)、茶树(Camelliasinensis)、香蕉(Musaacuminata)、荔枝(Litchichinensis)、红麻(Hibiscuscannabinus)、李(Prunussalicina)、桔梗 (Platycodongrandiflorus)、土肉桂(Cinnamomumosmophloeum)、小油桐(Jatrophacurcas)和咖啡(Coffeacanephora)等物种pal的核苷酸序列同源性高达77%以上,推导的氨基酸序列与这些物种的同源性则高达90%以上(表2),推测它是pal的一个片段。

图3 藤茶pal片段核苷酸序列和推导的氨基酸序列

pal来源GenBank登录号核苷酸同源性(%)氨基酸同源性(%)葡萄VitisviniferaEF19246918895茶树CamelliasinensisD2659618194香蕉MusaacuminataEU10468018194荔枝LitchichinensisFJ94401818193红麻HibiscuscannabinusJQ77902218193李PrunussalicinaJQ35280418093桔梗PlatycodongrandiflorusJN39274918092土肉桂CinnamomumsmophloeumJF81102917990小油桐JatrophacurcasDQ88380517894咖啡CoffeacanephoraJN42034517793
3 讨论
一些植物由于未能有效地分离纯化其组织中的RNA,阻碍了其分子生物学方面研究的进展。一般认为在这些植物组织中,含有较多酚类化合物、多糖以及次生代谢产物,或RNase的活性较高。在完整的细胞内这些物质在空间上与核酸是分离的,但当组织被研磨,细胞破碎后,这些物质就会与RNA相互作用,从而增加了RNA提取的难度[19]。我们前期采用一些常规的植物RNA提取方法(例如Trizol法、异巯氰酸胍法)和试剂盒都无法提取到藤茶叶片总RNA,这可能是由于藤茶叶片中含有非常丰富的黄酮、多酚和多糖类化合物造成的。比如,在使用常规Trizol法进行提取时,发现经异丙醇沉淀后可以看到一些褐色沉淀,却很难溶解于DEPC水中,电泳检测也没有观察到条带,推测这些沉淀可能为多酚类物质氧化后再与RNA结合形成的不溶性复合物。而采用试剂盒进行提取时,结果发现柱膜表面会积聚一层褐色粘稠物,造成RNA难以洗脱,既使有少量溶液被洗脱下来,但也检测不到RNA。因此,在保证RNA不被降解的前提下,能否有效去除藤茶叶片中大量存在的黄酮、多酚和多糖类化合物,是顺利提取高质量藤茶叶片总RNA的关键。
许多研究表明,在进行RNA提取之前先用70%丙酮抽提可以有效的去除多糖、多酚以及色素等物质,减少其对RNA干扰的机会。Schneiderbauer等[14]用-70℃的丙酮抽提冷冻研磨后的植物材料,可以有效地从云杉、松树、山毛榉等富含酚类化合物的植物材料中分离到高质量的RNA。肖洁凝等[15]在提取富含多糖和次生物质的芒果子叶总RNA时,发现经70%丙酮处理,RNA质量和得率明显优于未经70%丙酮处理。周波等[16]在提取草莓果实RNA时也发现用冷的丙酮能有效去除类黄酮类色素的干扰。张玲等[17]用70%丙酮和80%乙醇对富含多糖、蛋白质、多酚等次生代谢产物的枇杷果实进行预处理,并结合CTAB-LiCl法得到高质量的RNA。鉴于前人的研究结果,本实验在藤茶叶片组织裂解前先用70%的冷丙酮预处理再进行RNA提取,结果发现之前尝试失败的3种RNA提取方法(试剂盒提取法、Trizol法和异硫氰酸胍法)均能够从藤茶叶片中获得高质量的RNA。
苯丙氨酸解氨酶(PAL) 是黄酮类生物合成途径的第一个关键酶和限速酶,分离克隆pal对研究黄酮类物质的代谢调控具有重要意义[20]。本研究根据GenBank已登录的植物pal保守区设计引物,用上述方法提取的RNA为模板进行RT-PCR,克隆得到一条817 bp的基因片段,其核苷酸和氨基酸序列与其他物种具有较高的同源性,推测它是pal的一个片段。下一步计划采用RACE技术获得该基因的全长cDNA序列,并对其进行表达分析,以期为探明藤茶高黄酮含量形成的分子机理提供基础。
[1]中国科学院植物研究所.中国高等植物图鉴(二册)补编[M].北京:人民卫生出版社,1983, 349-356.
[2]何桂霞,杨伟丽,裴 刚,等.二氢杨梅素抗脂质过氧化作用的研究[J].中国中药杂志,2003,28(12): 1188-1190.
[3]熊皓平,何国庆,杨伟丽,等.显齿蛇葡萄提取物抗菌作用的研究[J].中国食品学报,2004,4(1): 55-59.
[4]陈玉琼,倪德江,程 倩,等.藤茶总黄酮及二氢杨梅素降血脂作用研究[J].茶叶科学,2007, 27(3):221-225.
[5]Zhou F Z, Zhang X Y, Zhan Y J, et al. Dihydromyricetin inhibits cell Invasion and down-regulates MMP-2/-9 protein expression levels in human breast cancer cells[J].Progress in Biochemistry and Biophysics, 2012, 39(4): 352-358.
[6]范世明,梁一池,王河山.HPLC 法测定闽产显齿蛇葡萄中二氢杨梅素的含量[J].福建中医药大学学报,2012 22(1):46-47.
[7]Zhang Y S, Yang W L. Study on functional constituents ofAmpelopsisGrossdentata[J]. Food Science, 2001, 22(9): 75-77.
[8]何桂霞,裴 刚.显齿蛇葡萄中总黄酮和二氢杨梅素的含量测定[J].中国中药杂志, 2000, 25(7): 423-425.
[9]熊皓平,何国庆,杨伟丽,等.显齿蛇葡萄生化成分分析[J].中国食品学报,2004,4(3):68-71.
[10]肖晓莹,陈继承,庞杰. 藤茶的功能性及黄酮类化合物提取研究进展[J].热带作物学报,2012, 33(8):1522-1527.
[11]付 明,魏 麟,余 娟,等.显齿蛇葡萄查耳酮合成酶基因cDNA克隆及蛋白质序列分析[J].中草药,2013,44(1):85-89.
[12]诸 姐,胡宏友,卢昌义,等.植物体内的黄酮类化合物代谢及其调控研究进展[J].厦门大学学报,2007,46(1):136-14.
[13]CaPell T, Christou P. Progress in plant metabolic engineering[J]. Current Opinion in Biotechnology, 2004, 15:148-154.
[14]Schneiderbauer A, Sandermann H Jr, Ernst D. Isolation of functional RNA from plant tissues rich in phenolic compounds[J]. Analytical Biochemistry, 1991, 197:91-95.
[15]肖洁凝,黄学林,黎 茵,等.富含多糖和次生物质的芒果子叶总RNA的提取[J].中国生物工程杂志,2003,23(11):83-86.
[16]周 波,张 肠,李玉花.富含多糖草莓果实总RNA提取方法的改进[J].生物技术通讯,2004,15(1):48-50.
[17]张 玲,林顺权,杨向晖.枇杷果实总RNA的提取及八氢番茄红素合成酶基因(PSY)片段的克隆[J].果树学报,2012, 29(4):577-582.
[18]李志能,黄文俊,张佳琪,等.异硫氰酸胍法快速提取二球悬铃木组织总RNA的研究[J].武汉植物学研究,2007,25(3):266-269.
[19]李 宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999(1):36-39.
[20]程水源,陈昆松,刘卫红,等.植物苯丙氨酸解氨酶基因的表达调控与研究展望[J].果树学报,2003,20(5):351-357.
Extraction of total RNA from leaves ofAmpelopsisgrossedentataand cloning of phenylalanine ammonia lyase gene fragment
XU Ming, YAN Zhi-jian, ZHENG Jin-gui
(College of Crop Science,Fujian Agriculture and Forestry University, Fuzhou 350002, China)
The leaves ofAmpelopsisgrossedentataare rich of flavones, polyphenols and polymeric carbohydrateds, which hinder the iso lation of RNA. The total RNA with good integrity and high purtity can be extracted from the leaves treated with 70% acetone before lysis by the three methods of RNA Extract Kit, Trizol and Guandine thiocyanate. The values of D260 nm/D280 nmof the extracted RNA were between 1.8 to 2.0, the yields were between 22.74-33.66 μg/g FW. A 817 bp phenylalanine ammonia lyase (pal) fragment was successfully amplified from cDNAs reverse-transcribed from the total RNA. By homology analysis,the clonedpalfragment inAmpelopsisgrossedentatais highly identical to the corresponding genes invitisviniferaandcamelliasinensis.
Ampelopsisgrossedentata; leaf; isolation of total RNA;PAL
2014-06-16;
2014-09-15
国家科技支撑计划项目(2013BAD01B05);福建省自然科学基金(2012J01090);福建农林大学科技创新平台建设项目(ptjh12015)
许明,博士,研究方向为植物基因工程,E-mail:xmfau@163.com;
郑金贵,教授,研究方向为农业生物技术,E-mail:jgzheng@fafu.edu.cn。
Q943.2
B
2095-1736(2015)02-0096-04
doi∶10.3969/j.issn.2095-1736.2015.02.096

