无脊椎动物β-胸腺素的功能研究进展
康志琼, 郝丽娟, 马上上, 吕 鹏, 陈克平
(江苏大学 生命科学研究院, 江苏 镇江 212013)
无脊椎动物β-胸腺素的功能研究进展
康志琼, 郝丽娟, 马上上, 吕 鹏, 陈克平
(江苏大学 生命科学研究院, 江苏 镇江 212013)
β-胸腺素(β-thymosin)是肌动蛋白单体(G-actin)的锚定因子,它可以阻止后者多聚化形成微丝。当前关于β-胸腺素的研究主要集中在脊椎动物中,发现其在淋巴系统的发育、维持免疫系统的平衡、中枢神经系统的发育等生命过程中起着重要作用。人体中胸腺素β4(Thymosinβ4,Tβ4)参与了机体抗菌过程,并且能促进伤口愈合,组织、器官的修复重塑。在无脊椎动物中,也发现了β-胸腺素的存在,研究发现这类蛋白与Tβ4具有一定的相似性,但是在结构及功能上却比Tβ4更为复杂,详细讨论了β-胸腺素在无脊椎动物中的研究进展。
无脊椎动物;β-胸腺素; 肌动蛋白; 结构; 功能
1 无脊椎动物β-胸腺素蛋白的分布及同源性
哺乳动物中,Tβ4是一个含有43个氨基酸的短肽,包含一个thymosin(THY)结构域,它广泛存在于所有细胞中,但红细胞除外[1]。THY结构域中有一个极其保守的G-actin螯合序列LKKT/LKHV。然而,在无脊椎动物中,发现了这样一类蛋白,与Tβ4相比,它们通常具备多个THY结构域,因此又称多聚胸腺素(multirepeat β-thymosin,multimeric β-thymosin)[2-3]。笔者对所有具有多聚胸腺素的物种做一统计, 并选取部分已经测序的物种做简要分析。结果表明,除多孔动物与棘皮动物外,其他后生动物等都存在这类蛋白;植物中只在衣藻、黄豆和高粱等少数几种中有所发现,此外在真菌中也发现了它的存在[4](表1)。部分海洋无脊椎动物(多孔动物,棘皮动物)则只存在单体胸腺素(表1),笔者对其氨基酸序列进行分析发现它们的序列比人类Tβ4的序列长度更短。
从表1中可以看出,胸腺素多聚体形式主要分布在低等真核生物与原生生物中,然而笔者查证单体也存在于原始的原生生物,因此从进化角度上很难辨别究竟哪种形式更为原始。Van Troys 等人推测脊椎动物的Tβ4在进化过程中很可能删除了一部分基因,而使功能达到最大化[2]。研究表明,无脊椎动物中的多聚形式和脊椎动物中存在单体形式二者是旁系同源,而不是直系同源[4]。
更有趣的是,同一物种中可能会存在多个多聚胸腺素同源异构体,它们几乎都来源于同一基因,只是由于内含子的剪切方式不同而导致序列之间存在差异[5],进而导致功能上有所不同[5-6]。多聚胸腺素各个结构域之间相似性较高,分析中华绒螯蟹(Eriocheirsinensis)各个THY结构域,发现他们之间的相似性最高达到90%[6]。
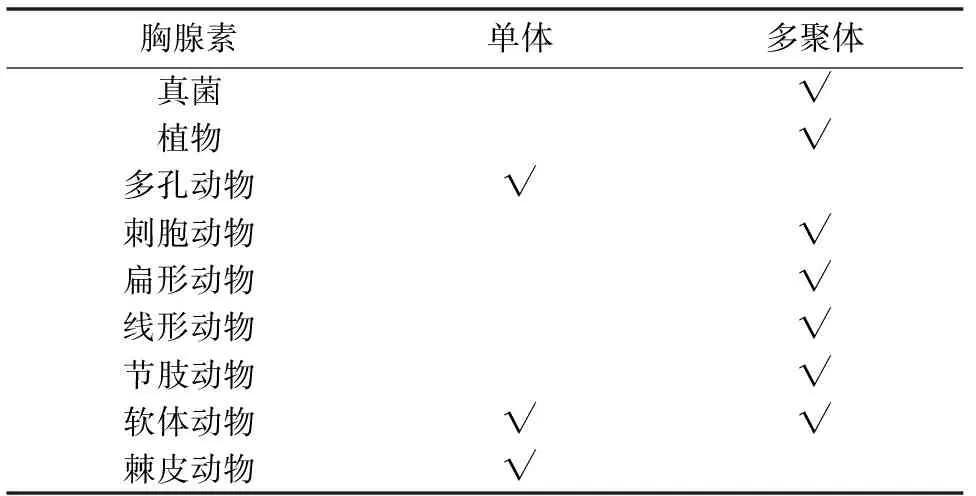
表1 胸腺素的分布情况
2 无脊椎动物β-胸腺素蛋白的结构特征
无脊椎动物多聚胸腺素的结构也与Tβ4相似,即保守序列LKKT/LKHV两端各有一个α螺旋,且N端α螺旋比C端复杂,分子其余部分结构不规则,呈伸展状态,几乎没有折叠,这种结构有利于它识别多种分子靶标[2]。序列对比得出,无脊椎动物多聚胸腺素N端比Tβ4的N端更长,这种结构使得其与G-actin结合能力更紧密[7]。
3 无脊椎动物β-胸腺素蛋白的功能
3.1 与G-actin相互作用
海洋无脊椎动物的单体胸腺素与Tβ4功能类似:它能与G-actin单体结合,进而防止G-actin在纤维状肌动蛋白(F-actin)“+,-”端延伸聚合[8]。当细胞运动过程需要网状分布的F-actin协调而快速地组装时,它又能迅速释放G-actin,提供F-actin合成所需的原料[9]。Tβ4之所以能与G-actin结合,是因为在螯合序列LKKT/LKHV的两侧都具备α螺旋结构[2]。由于C端相对于N端的结合力较弱,这就使得该蛋白在抑制/促进G-actin的组装上可以来回切换,以适应机体对于G-actin的需求[7]。
然而,果蝇多聚胸腺素Ciboulot的功能却发生了变化:只有当F-actin“+”末端被包被时Ciboulot才起到解聚作用;但当“+”暴露时,Ciboulot与G-actin的复合物则可以促进F-actin的延长[2, 10]。变形虫中以及线虫中多聚胸腺素也可以促进F-actin组装。造成两种形式功能上差异的主要原因可能有:1)多聚胸腺素可以与两种形式的actin结合;2)结构域与Tβ4之间序列存在差异;3)结构域的多重复;4)保守基序LKKT/LKHT的T被A/V替代,下游重要的E36Q37被非极性氨基酸取代[2, 7]。
此外,个别氨基酸的不同也会对多聚胸腺素结合能力造成一定影响,尤其是在节肢动物中,部分多聚胸腺素的第一个氨基酸由丝氨酸变为丙氨酸后,发现其结合能力较Tβ4增强了约4倍[11]。鉴于肌动蛋白的多聚化是细胞生命运动所必不可少的,笔者推测由于胸腺素与游离G-actin的结合,可能会影响细胞的增殖和分化。
3.2 参与机体免疫反应
研究显示,在海参中肠中多聚胸腺素可能是重要的免疫因子[12],但具体机制还尚未明确。棉铃虫在受到细菌和病毒刺激后,脂肪体和血细胞中多聚胸腺素的表达量明显升高[5],类似现象也在红螯螯虾,九孔鲍中也发现[13-14]。由于胸腺素可以与G-actin结合,有研究表明胸腺素可能参与了机体的抗病毒过程:宿主的细胞骨架F-actin对于病毒的生存是必不可少的[15-17],Zhang等人在棉铃虫精巢细胞中发现胸腺素可以调节F-actin的组装进而改变细胞形态来抵抗AcMNPV感染[18]。因此可以推测,在病毒侵染过程中,宿主通过调节胸腺素的表达进而调控F-actin的组装以阻碍病毒复制子代,从而起到协助抗病毒的作用[19]。
3.3 与ATP合成酶结合促进ATP合成,促进细胞迁移
Tβ4可以与F0-F1ATP合成酶结合,这种结合会促进ATP的合成,进而促进细胞的迁移[20]。无脊椎动物也发现了类似的现象,小龙虾体内的两种多聚胸腺素均能与F0-F1ATP合成酶结合,但是作用机制却不相同:Thymosin 1可直接促进ATP合成,Thymosin 2却需要在造血因子(Ast1)的协助下才可以合成ATP,进而促进造血组织细胞的迁移[19]。
3.4 降低机体活性氧
Tβ4可以通过调节与抗氧化相关的酶的表达量来降低体内活性氧簇(reactive oxygen species, ROS) 的积累,从而阻止线粒体膜电位的消失[21]。类似的研究在甲壳动物小龙虾中也有发现,运用RNA干扰技术使得多聚胸腺素基因沉默后,会降低机体内超氧化物歧化酶的表达[19]。同时定量研究也证明,多聚胸腺素的存在会降低体内活性氧的含量[19]。由于多聚胸腺素可以帮助清除体内活性氧分子,因此它能有效降低由于ROS引起的细胞凋亡,保护细胞免于死亡[20]。
3.5 促进蜕皮动物的发育
棉铃虫在蜕皮、变态过程中多聚胸腺素的表达量明显升高;此外,体外运用20-羟基蜕皮激素(20E)刺激虫体也会增强其表达[5]。这都说明,这类蛋白都参与到蜕皮动物的完全变态过程中[5]。
3.6 参与神经系统发育
在无脊椎动物中,发现多聚胸腺素大量存在于物种的头部[10, 22]。社会性昆虫白蚁的变态过程中,兵蚁会分化出更强大的头部,在此过程中多聚胸腺素表达量极高[22]。海蛤蝓中的多聚胸腺素Csp24在发生磷酸化后,机体会产生强烈的兴奋性,这一过程对于中期记忆的产生和持久性是必不可少的[23-24]。果蝇中多聚胸腺素Ciboulot基因的缺失则会导致脑中部神经轴突生长缺陷[3, 25]。
3.7 促进组织和器官再生
Tβ4有促进毛发、牙齿生长的作用[26]。在无脊椎动物中,研究发现Tβ4类似蛋白会刺激水螅的足部再生[27]。
3.8 促进伤口愈合
Tβ4可以加速伤口修复[28]。在昆虫中,也发现了多聚胸腺素促进伤口愈合的例子,例如中华绒螯蟹在受到伤害后,两种胸腺素的表达会随着时间呈现异于正常水平的表达[6]。
3.9 与生殖相关
Tetrathymosin 基因发生突变的线虫,虽然成虫表型正常,但是由于卵缺乏肌动蛋白结构因而丧失生殖能力[29]。
3.10 其他功能
内含子的选择性剪切会使蛋白功能上存在一定的差异,这一点在无脊椎动物中也有体现:中华绒螯蟹中存在EsTRP1和EsTPR2两种多聚胸腺素蛋白,这两者就存在功能上的不同,后者明显促进人肝癌细胞的增殖,而前者却不能。此外,二者在参与免疫反应的时间顺序上也不相同[5-6]。无脊椎动物中由于存在多种多聚胸腺素的异构体,且组织分布因物种不同也存在差异,因此可以推测在不同组织中,多聚胸腺素的不同异构体相互之间起到代补偿的作用,可能作用完全相同,也有可能作用截然相反。
4 总结与展望
无脊椎动物胸腺素β4蛋白由于具备多个THY结构域,因此可以获得与Tβ4完全不同的功能,如促进肌动蛋白组装。脊椎动物与无脊椎动物中的Tβ4,究竟谁起源更早,谁保持了祖先的功能,谁又获得了新的功能,尚待研究。哺乳动物胸腺素已经用于临床治疗病症,由于其多聚形式的相似性与复杂性,有可能也具备良好的药用效果。人类Tβ4在代谢过程中可以酶解产生小肽段分子,进而参与体内的反应,然而,无脊椎动物中尚无相关报道,因此,探索多聚形式的降解以及降解产物的功能也是接下来关于无脊椎动物胸腺素研究的一个重点。
[1]Sosne G, Qiu P, Goldstein A L, et al. Biological activities of thymosin beta4 defined by active sites in short peptide sequences[J]. Faseb J, 2010, 24(7):2144-2151.
[2]Van Troys M, Dhaese S, Vandekerckhove J L, et al. Multirepeat β-Thymosins[M]. Actin-Monomer-Binding Proteins. Springer New York, 2007: 71-81.
[3]Koshikawa S, Cornette R, Matsumoto T, et al. The homolog of Ciboulot in the termite (Hodotermopsissjostedti): a multimeric beta-thymosin involved in soldier-specific morphogenesis[J]. BMC Dev Biol, 2010, 10:63.
[4]Telford M J. The multimeric β-thymosin found in nematodes and arthropods is not a synapomorphy of the Ecdysozoa[J]. Evol Dev, 2004, 6(2):90-94.
[5]Zhang F X, Shao H L, Wang J X, et al. Beta-thymosin is upregulated by the steroid hormone 20-hydroxyecdysone and microorganisms[J]. Insect Mol Biol, 2011, 20(4):519-527.
[6]Gai Y, Zhao J, Song L, et al. Two thymosin-repeated molecules with structural and functional diversity coexist in Chinese mitten crabEriocheirsinensis[J]. Dev Comp Immunol, 2009, 33(7):867-876.
[7]Hertzog M, van Heijenoort C, Didry D, et al. The beta-thymosin/WH2 domain; structural basis for the switch from inhibition to promotion of actin assembly[J]. Cell, 2004, 117(5):611-623.
[8]Safer D, Chowrashi P K. Beta-thymosins from marine invertebrates: primary structure and interaction with actin[J]. Cell Motil Cytoskeleton, 1997, 38(2):163-171.
[9]Huff T, Zerzawy D, Hannappel E. Interactions of beta-thymosins, thymosin beta 4-sulfoxide, and N-terminally truncated thymosin beta 4 with actin studied by equilibrium centrifugation, chemical cross-linking and viscometry[J]. Eur J Biochem, 1995, 230(2):650-657.
[10]Boquet I, Boujemaa R, Carlier M F, et al. Ciboulot regulates actin assembly duringDrosophilabrain metamorphosis[J]. Cell, 2000,102(6):797-808.
[11]Didry D, Cantrelle F X, Husson C, et al. How a single residue in individual beta-thymosin/WH2 domains controls their functions in actin assembly[J]. Embo J, 2012, 31(4):1000-1013.
[12]Ramirez-Gomez F, Ortiz-Pineda P A, Rojas-Cartagena C, et al. Immune-related genes associated with intestinal tissue in the sea cucumberHolothuriaglaberrima[J]. Immunogenetics, 2008, 60(1):57-71.
[13]Liu H P, Chen R Y, Zhang Q X, et al. Differential gene expression profile from haematopoietic tissue stem cells of red claw crayfish,Cheraxquadricarinatus, in response to WSSV infection[J]. Dev Comp Immunol, 2011, 35(7):716-724.
[14]Wu L, Wu X. Molecular cloning and expression analysis of a beta-thymosin homologue from a gastropod abalone,Haliotisdiversicolorsupertexta[J]. Fish Shellfish Immunol, 2009, 27(2):379-382.
[15]Cibulka J, Fraiberk M, Forstova J. Nuclear actin and lamins in viral infections[J]. Viruses, 2012, 4(3):325-347.
[16]Kasman L M, Volkman L E. Filamentous actin is required for lepidopteran nucleopolyhedrovirus progeny production[J]. J Gen Virol, 2000, 81(Pt 7):1881-1888.
[17]Xu H, Yao L, Lu S, et al. Host filamentous actin is associated withHeliothisarmigerasingle nucleopolyhedrosis virus (HaSNPV) nucleocapsid transport to the host nucleus[J]. Curr Microbiol, 2007, 54(3):199-206.
[18]Zhang X, Chen M, Ma X, et al. Suppression of AcMNPV replication by adf and thymosin protein up-regulation in a new testis cell line, Ha-shl-t[J]. Arch Insect Biochem Physiol, 2013, 82(3):158-171.
[19]Saelee N, Noonin C, Nupan B, et al. Beta-thymosins and hemocyte homeostasis in a crustacean[J]. PLoS One, 2013, 8(4):e60974.
[20]Freeman K W, Bowman B R, Zetter B R. Regenerative protein thymosin beta-4 is a novel regulator of purinergic signaling[J]. Faseb J, 2011, 25(3):907-915.
[21]Kumar S, Gupta S. Thymosin beta 4 prevents oxidative stress by targeting antioxidant and anti-apoptotic genes in cardiac fibroblasts[J]. PLoS One, 2011, 6(10):e26912.
[22]Zhang W, Zhang C, Lv Z, et al. Molecular characterization, tissue distribution, subcellular localization and actin-sequestering function of a thymosin protein from silkworm[J]. PLoS One, 2012, 7(2):e31040.
[23]Crow T, Redell J B, Tian L M, et al. Inhibition of conditioned stimulus pathway phosphoprotein 24 expression blocks the development of intermediate-term memory inHermissenda[J]. J Neurosci, 2003, 23(8):3415-3422.
[24]Crow T, Xue-Bian J J, Neary J T. 14-3-3 proteins interact with the beta-thymosin repeat protein Csp24[J]. Neurosci Lett, 2007, 424(1):6-9.
[25]Koshikawa S, Cornette R, Hojo M, et al. Screening of genes expressed in developing mandibles during soldier differentiation in the termiteHodotermopsissjostedti[J]. Febs Lett, 2005, 579(6):1365-1370.
[26]Cha H J, Philp D, Lee S H, et al. Over-expression of thymosin beta 4 promotes abnormal tooth development and stimulation of hair growth[J]. Int J Dev Biol, 2010, 54(1):135-140.
[27]Herrmann D, Hatta M, Hoffmeister-Ullerich S A. Thypedin, the multi copy precursor for the hydra peptide pedin, is a beta-thymosin repeat-like domain containing protein[J]. Mech Dev, 2005, 122(11):1183-1193.
[28]Huff T, Muller C S, Otto A M, et al. beta-thymosins, small acidic peptides with multiple functions[J]. Int J Biochem Cell Biol, 2001, 33(3):205-220.
[29]Van Troys M, Ono K, Dewitte D, et al. Tetra thymosinbeta is required for actin dynamics inCaenorhabditiselegansand acts via functionally different actin-binding repeats[J]. Mol Biol Cell, 2004, 15(10):4735-4748.
Research progress on functions of invertebrate β-thymosin
KANG Zhi-qiong, HAO Li-juan, MA Shang-shang, LV Peng, CHEN Ke-ping
(Institute of Life Science, Jiangsu University, Zhenjiang 212013, China)
Thymosin β4 proteins are well known for their actin-binding activity and preventing G-actin polymerization. Current studies focuesed on the protein in vertebrates and found it plays an important role in developing the lymphatic system and the central nervous system, maintaining the balance of the immune system in vertebrates. Thymosin β4 ( Tβ4) is involved in the anti-bacterial process and can promote wound healing, tissue, organ repair remodeling. In invertebrates, there also exists thymosin β4-like protein-multimeric β-thymosin. The researchers found that these proteins are similar to Tβ4, but the structure and function are more complex than these of Tβ4. This article will discuss the progress on the funtion of thymosin β4-like protein in vertebrates in detail.
invertebrates; multimeric β-thymosin; actin; structure; function
2014-07-31;
2014-09-29
国家重点基础研究发展计划“973项目”(No.2012CB1146-04)
康志琼,硕士研究生,专业方向为生物化学与分子生物学,E-mail:zhiqiong0922@126.com;
陈克平,研究员,教授,研究方向为分子遗传学,E-mail:kpchen@ujs.edu.cn。
R
A
2095-1736(2015)02-0076-04
doi∶10.3969/j.issn.2095-1736.2015.02.076

