蚤状溞(Daphniapulex) Chk1基因的克隆与表达分析
方增冰, 戴新宇, 邹 秀, 郭晓鸽, 徐善良, 王丹丽, 赵云龙
(1. 宁波大学海洋学院, 宁波 315211; 2. 华东师范大学生命科学学院,上海 200062)
蚤状溞(Daphniapulex) Chk1基因的克隆与表达分析
方增冰1, 戴新宇1, 邹 秀1, 郭晓鸽1, 徐善良1, 王丹丽1, 赵云龙2
(1. 宁波大学海洋学院, 宁波 315211; 2. 华东师范大学生命科学学院,上海 200062)
用RACE技术从蚤状溞(Daphniapulex)中克隆到Chk1基因cDNA全长为1767 bp,开放阅读框为1497 bp,编码了498个氨基酸,其结构中存在3个保守的Ser-Gln (SQ)和Thr-Gln (TQ) 序列。同源性比对结果显示,蚤状溞Chk1基因与丽色扇头蜱、切叶蜂、转基因捕食螨、豌豆长管蚜和黑腹果蝇等的同源性均为51%~55%。进化分析发现,蚤状溞Chk1基因与豌豆长管蚜、切叶蜂、黑腹果蝇、丽色扇头蜱和转基因捕食螨等节肢动物亲缘关系最近。Real Time PCR实验结果表明,Chk1 mRNA在两性溞的表达量显著高于孤雌溞(P<0.05),且在休眠卵中表达量最低。推测Chk1基因可能在蚤状溞的生殖转化调控中发挥重要作用。
蚤状溞;Chk1;Real time-PCR;生殖转化
蚤状溞(Daphniapulex)为枝角亚目(Cladocera)一种常见的小型枝角类,该溞分布广、易繁殖、适应性强,易于观察,个体发育迅速,发育阶段明显,是实验动物学研究和教学的好材料。枝角类具两种生殖模式:春、夏季节,当外界水温合适、食物充足时,蚤状溞行孤雌生殖,雌性产不受精卵,发育成雌体。当气温降低,光照变短,生活环境变得恶劣时,雌溞产生卵鞍,行有性生殖。蚤状溞两种生殖方式的交替,通过有性生殖产生的卵鞍来适应、抵御不良环境,对于种的延续有重大的生物学意义。
Chk1是一种丝氨酸/苏氨酸蛋白质激酶(checkpoint kinase 1),其在生物进化中具有较强的保守性,调控S期、G2/M检测点细胞周期的进程[1]。细胞周期检测点激酶1(Chk1)最早由Walwrot[2]在裂殖酵母中发现,当DNA受损时,ATM/ATR基因立即激活,并磷酸化Chk1的第317位丝氨酸(S317)和第345位丝氨酸(S345)而使激酶激活,激活后的Chk1又可进一步作用于它的下游蛋白Cdc25A/B/C,从而引起S期或G2期阻滞,为修复损伤的DNA争取时间[3-4]。目前对Chk1的研究主要集中在细胞周期调控方面,检测DNA是否损伤[5-6]及抗肿瘤方面[7-9]。尚未见Chk1调控动物生殖转化方面的报道。但近年来,本课题组通过构建枝角类孤雌溞和两性溞cDNA文库及对EST序列进行基因的特异表达分析,筛选得到了在表达上差异极为显著的与生殖转化相关的功能基因,发现其中Chk1单一序列在表达上有显著性差异,即在两性溞中Chk1基因表达量高于孤雌溞,其有可能参与调控卵母细胞不同的成熟方式,推测有可能参与了枝角类的生殖转化调控[10]。本研究以蚤状溞为研究对象,通过PCR进行cDNA末端快速克隆的技术(rapid-amplification of cDNA ends, 简称RACE PCR) 和同源序列法,克隆了蚤状溞Chk1的cDNA全长,采用实时荧光定量PCR分析Chk1 mRNA在蚤状溞各生殖状态下的表达水平,通过以上方法来探索枝角类生殖转化的规律和分子机理。
1 材料与方法
1.1 实验溞来源及驯化
本实验用蚤状溞为单克隆培养获得, 溞体大小(3.1±0.6)mm。 选择健康活泼的成溞培养在盛有 3g兔子粪+4 g 干稻草+20 g 土壤+1900 mL自来水的“Banta 粪土培养液” 玻璃缸内, 每天投喂2次小球藻。水温控制在24~26℃;pH值7~8;约培养2周后, 溞密度即可达到3000 只/L 以上, 高密度种群条件下,缸内溞逐渐转为有性生殖, 数天后出现两性溞。蚤状溞不同生殖状态下的形态结构如图1所示。
1.2 引物设计
从GenBank获得了转基因捕食螨(Metaseiulusoccidentalis) Chk1基因(XM_003745270.1),欧洲熊蜂(Bombusterrestris) Chk1基因(XM_003401009.1),切叶蜂(Megachilerotundata)Chk1基因(XM_003705944.1)和豌豆长管蚜(Acyrthosiphonpisum)Chk1基因(XM_001944700.2)。根据此序列, 运用Vector NTI 11.0软件,设计1对简并引物Chk1-F/R,此对引物扩增Chk1基因cDNA部分片段;由该片段再设计5′ RACE和3′ RACE的特异性引物Chk1-5′R 和Chk1-3′F,扩增出蚤状溞DpChk1cDNA全长序列;实时荧光定量PCR引物为DpChk1-F和DpChk1-R。根据蚤状溞18S(AF014011.1)cDNA序列设计18S-F和18S-R内参基因序列,用1对特异性引物DpChk1-F和DpChk1-R 和1对内参基因引物18S-F和18S-R来检测在不同生殖状态下蚤状溞Chk1 mRNA的表达(引物见表1)。

表1 试验中用到的引物名称及序列
M—A or C; K—G or T; R—A or G。
1.3 总RNA 的提取及cDNA第一链的合成
孤雌溞、两性溞和休眠卵的总RNA采用RNA提取试剂盒(RNA Extraction Kit,Axygen)提取,反转录cDNA则用试剂盒 (PrimeScript RT Master Mix Perfect Real Time Kit)进行反转录(37℃反转录15min,85℃5s灭活反转录酶),合成的cDNA产物保存在-20℃或直接用于PCR。
1.4 Chk1基因cDNA片段的克隆
用上述获得的两性溞cDNA为模板,通过简并引物Chk1-F/R进行PCR扩增,反应体系为50 μL,扩增条件优化:94℃预变性3 min;94℃下变性30 s,55℃退火30 s,72℃延伸1 min,连续30~35个循环;72℃延伸10 min后4℃保存。经1.5%琼脂糖凝胶电泳检测PCR产物,送上海桑尼生物公司进行测序。
1.5 RACE扩增Chk1基因的全长序列
在NCBI数据库(http://www.ncbi.nlm.nih.gov)中对测序结果进行BlastX比对,分析实验所得的Chk1序列与其它物种Chk1的同源性,若有部分同源,则根据测得序列再设计正向(Chk1-5′R)、反向(Chk1-3′F)引物用于RACE扩增。进一步采用SMARTTM RACE cDNA试剂盒(Clontech)对5′和3′ 端进行RACE,从而获得cDNA全长。
1.6 生物信息学分析
蛋白理化特性用Protparam软件(http://au.expasy.org/tools/protparam.htm1)进行预测,核酸和蛋白序列相似性比较用BlastX工具(http://www.ncbi.nlm.nih.gov);氨基酸序列通过NCBI的ORF Finder进行开放阅读框分析预测;用ExPASy-PROSITE(8Hhttp://prosite.expasy.org/)预测氨基酸功能域;信号肽分析用SignalP程序;Smart软件预测功能域;多序列比对分析采用Clustal W软件进行。用MEGA5.1 软件构建进化树。用自展法进行1000 次重复检验。
1.7 实时荧光定量PCR分析
为获得最佳模板浓度,将各类模板稀释成10、10-1、10-2、10-3、10-4、10-5、10-6和10-7μM 8个浓度梯度,用引物分别进行扩增。并对引物退火温度也进行优化:95℃预变性30 s;95℃变性5 s,57℃退火30 s,72℃30 s,40个循环。反应结束后确定Real-time PCR的扩增曲线和溶解曲线,数据采集和处理在ABI StepOnePlusTMInstrument上进行。每种生殖状态的样品设3个重复。
用平均值(Mean, M)±标准差(Stdeva, SD)表示以上处理得到的数据,测得数据经过以下处理:使用SPSS 14.0软件来进行数据统计分析,显著性检验采用单因素方差分析法进行,并用邓肯检验法进行多重比较。本实验PCR产物特异性根据Livak[11]的方法进行引物的效率检测。qRT-PCR结果采用2-△△Ct法分析处理,内标18S Ct 值与目的基因(DpChk1)Ct 值的差值定义为ΔCt 。

图1 蚤状溞不同生殖形态图
依次为孤雌溞(未带卵)(40×);孤雌溞(带夏卵)(100×);孤雌溞(背面观)(40×);两性溞(带冬卵)(40×);休眠卵(100×)。
2 结果
2.1 蚤状溞细胞周期检测点激酶1 DpChk1全长cDNA的克隆
以蚤状溞两性溞的cDNA为模板,用简并引物Chk1-F/R进行PCR扩增,得到约700 bp的片段,经BlastX分析与已登录的欧洲熊蜂Bombusterrestris(XP_003401057.1)、转基因捕食螨Metaseiulusoccidentalis(XP_003745318.1)、长牡蛎Crassostreagigas(EKC39820.1)、囊舌虫Saccoglossuskowalevskii(XP_002741282.1)和紫海胆Strongylocentrotuspurpuratus(NP_001091925.1)Chk1基因具有较高的同源性。以这段700 bp序列继续设计5′和3′ RACE引物,分别进行5′和3′RACE,通过测序得到序列并比对拼接获得一条1767 bp的全长序列(GenBank登录号:KC713933)。为进一步验证序列的可靠性,重新设计Chk1-S/V克隆Chk1全长序列,结果与上述全长序列一致,证明蚤状溞Chk1cDNA克隆有效。
2.2 蚤状溞细胞周期检测点激酶1 DpChk1序列特征分析
蚤状溞 Chk1全长核苷酸序列和推导出的氨基酸序列如图2,全长为1767 bp的蚤状溞Chk1 cDNA序列包含了一个186 bp的5′-UTR区域和84 bp的3′-UTR(非编码区)区域,两端各含有一个终止密码子(TAA)和 polyA尾。1497 bp的开放阅读框(ORF)编码了498个氨基酸,包含有多个磷酸化位点(phosphorylation site)。蚤状溞Chk1的理论等电点(pI)为8.40,计算分子质量56.16 ku。

图2 蚤状溞Chk1的cDNA全长及推断的氨基酸
阴影部分aga为起始密码子; taa为终止密码子。
2.3 蚤状溞细胞周期检测点激酶1 DpChk1结构分析
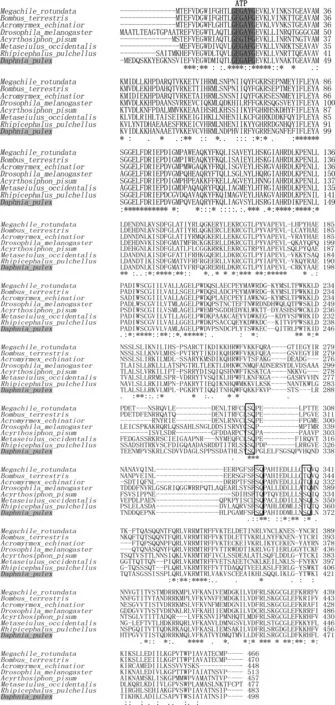
图3 蚤状溞细胞周期检测点激酶1与其它甲壳类同源序列的多序列比对Fig 3 Multiple alignment of D. Pulex Chk1 with the other crustacean Chk1灰色阴影显示的是GxGxxG域;方框显示3个SQ/TQ域。
蚤状溞 DpChk1N端含有3个串联的Chk1功能域,分别为PKc结构域(残基27~273位)、PKc-like superfamily结构域(残基27~273位)、S-TKc结构域(残基21~275位)。C端是调节域,含有调控必需的SQ/TQ域,该结构域中含有3个保守的Ser-Gln (SQ)和Thr-Gln (TQ) 序列,其中的Ser或Thr能被ATR或ATM磷酸化,激活Chk1蛋白的N端功能域。3个保守的Ser-Gln (SQ)和Thr-Gln (TQ) 序列在蛋白中的位置分别为:321~322、357~358、369~370(图3)。
2.4 蚤状溞细胞周期检测点激酶1DpChk1氨基酸序列同源性分析
利用ClustalW 对蚤状溞 DpChk1和其它7种节肢动物Chk1的多序列比对见图3。蚤状溞DpChk1与转基因捕食螨(Metaseiulusoccidentalis)、切叶蜂(Megachilerotundata)、顶切叶蚁(Acromyrmexechinatior)、黑腹果蝇(Drosophilamelanogaster)、欧洲熊蜂(Bombusterrestris)、丽色扇头蜱(Rhipicephaluspulchellus)、豌豆长管蚜(Acyrthosiphonpisum)的同源性都较高,同源性均为51%~55%。
利用MEGA4.0软件对19个不同物种的Chk1序列进行了分子系统学分析,在构建系统发生树的基础上研究了蚤状溞和其它种类Chk1之间的进化关系(见图4)。从系统进化树上可以看到Chk1基因在上述动物中主要被分为3个亚群:蚤状溞与豌豆长管蚜、黑腹果蝇、顶切叶蚁、切叶蜂、转基因捕食螨、丽色扇头蜱等节肢动物分为第1亚群;吉富罗非鱼(Oreochromisniloticus)、黄牛(Bostaurus)、人(Homosapiens)、家马(Equuscaballus)等脊椎动物聚为第2亚群;紫海胆Strongylocentrotuspurpuratus、囊舌虫 (Saccoglossuskowalevskii)等棘皮半索动物为第3亚群。蚤状溞与豌豆长管蚜、切叶蜂和黑腹果蝇等首先聚类,之后与转基因捕食螨、丽色扇头蜱等节肢动物聚为一支,再与棘皮半索动物聚在一起,最后与脊椎动物聚类。蚤状溞Chk1与脊椎动物在分子进化上距离相对较远。
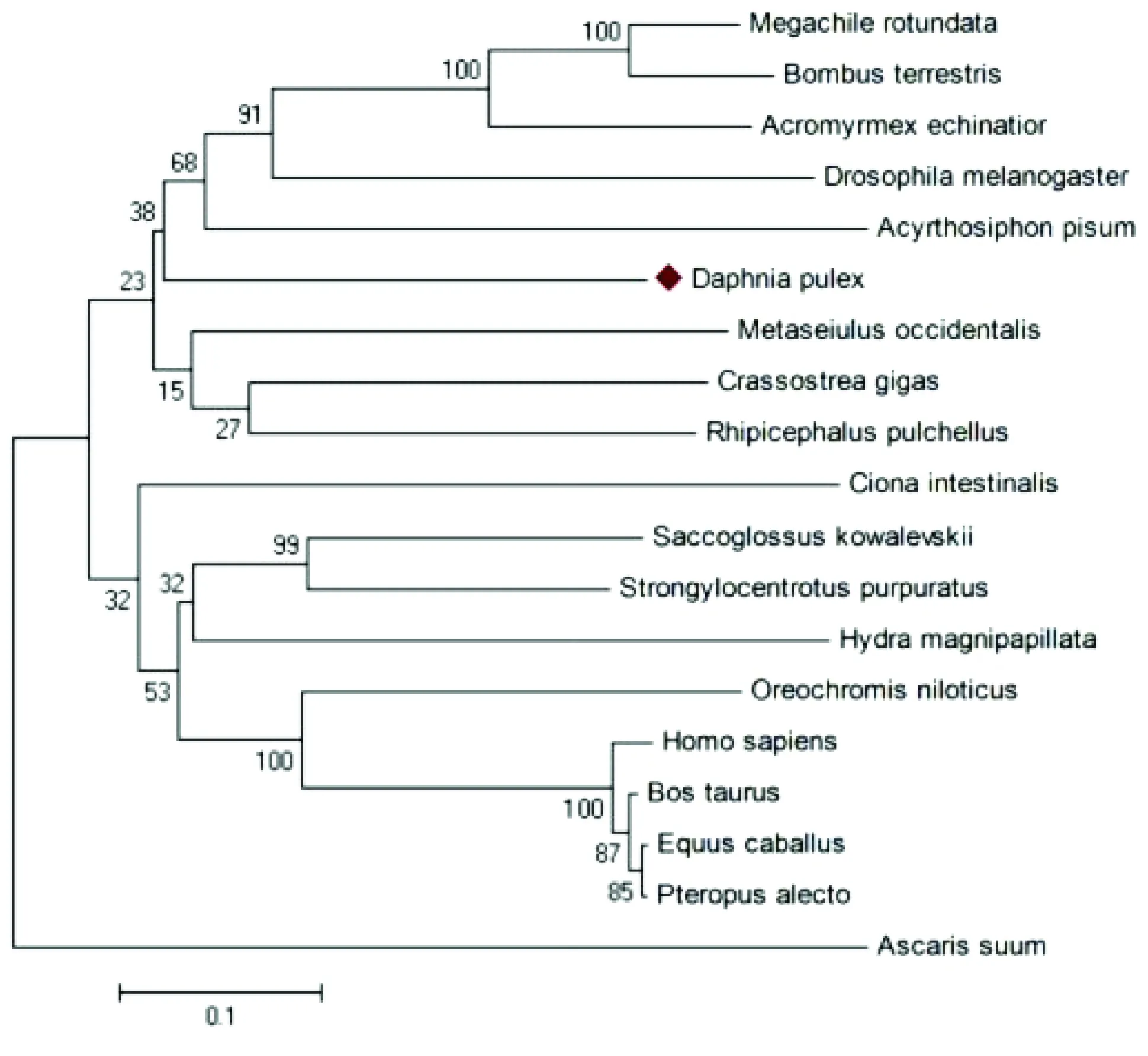
图4 根据N-J法绘制的Chk1基因进化树
2.5 DpChk1 mRNA在蚤状溞各生殖状态下的表达差异
以筛选后最为理想的18S作为本实验荧光定量的内参基因。Chk1基因在孤雌溞、两性溞、休眠卵中的表达差异如图5所示。实验结果显示:DpChk1在两性溞中表达最高,在休眠卵中的表达量最低。Chk1 mRNA在两性溞的表达量显著高于孤雌溞(P<0.05),推测Chk1基因与蚤状溞的生殖转化可能有相关性。
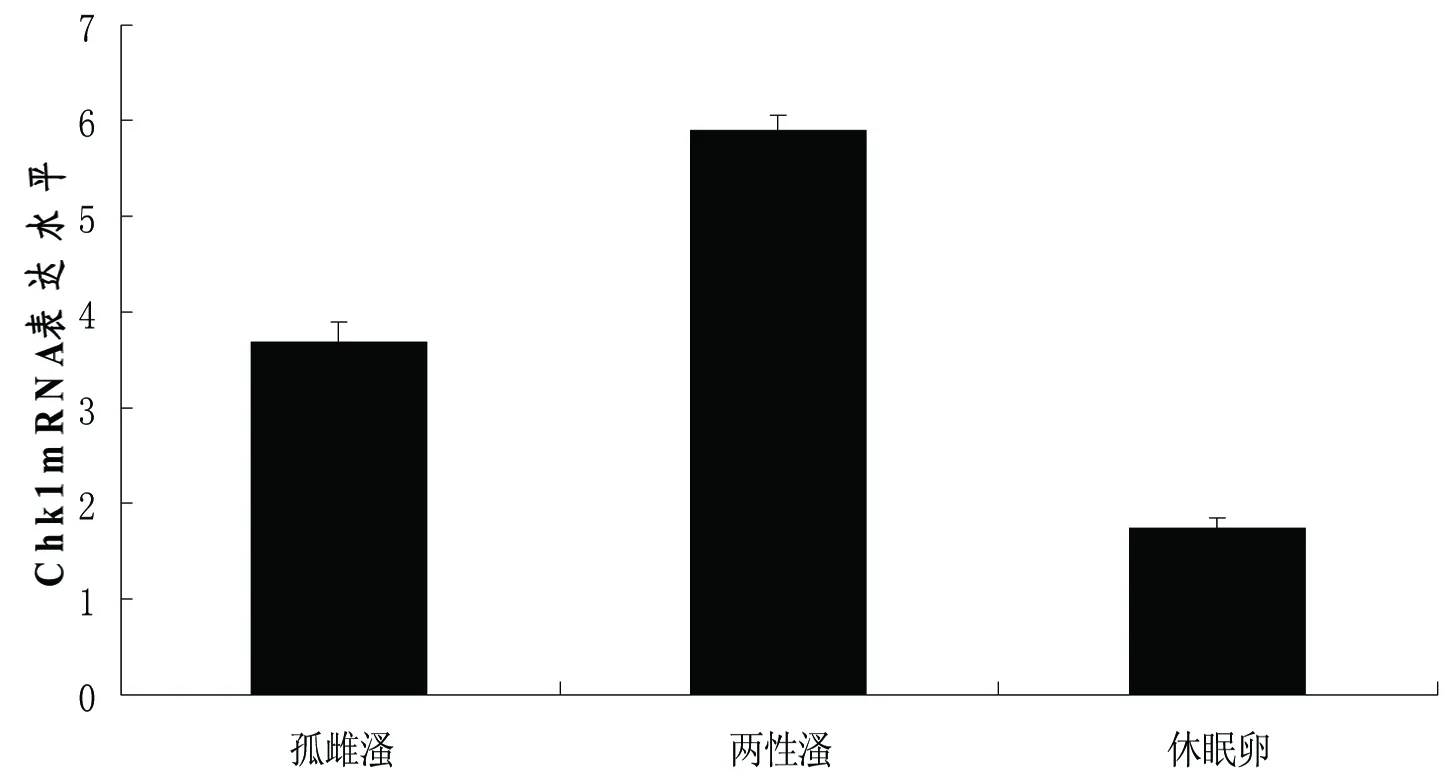
图5 Chk1 mRNA 在不同生殖状态下的表达水平
3 讨论
已有许多学者证实了枝角类雌体生殖细胞发生过程中,都是在夏卵和冬卵出现以后,出现两次成熟分裂[12-14]。 蒋燮治等[15]研究发现,孤雌溞卵子的成熟只伴随一次均等分裂,孤雌溞为二倍体;但是两性溞的卵子成熟时和正常减数分裂一样,染色体均等裂,每个卵子都为单倍体。但是Bacci[16]等认为孤雌溞不止经历一次分裂,且细胞未分裂,故产生的卵子为二倍体。因此,枝角类的生殖细胞的两次成熟分裂,对其两种生殖方式有很大影响。卵母细胞成熟的调控不是一个单因子的作用,它的调控过程很复杂,由多个因子共同参与[17],需要特定的基因在特定的时期准确地表达。
细胞周期检测点激酶1(Chk1)的主要功能是调控细胞周期,当DNA受损时,Chk1基因能使细胞周期阻滞在S期,为DNA修复损伤争取时间[18]。近些年的研究发现Chk1基因还可能与枝角类的生殖转化相关[14,17]。本实验中蚤状溞两种生殖状态下Chk1 mRNA的表达水平显示:其两性溞的表达量最高,是孤雌溞的1.6倍,在休眠卵中的表达量最低。Chk1基因的表达在两性生殖和孤雌生殖中有显著性差异(P<0.05),推测其有可能是参与调控卵母细胞不同的成熟方式;另一方面由于受到环境因素胁迫,溞体DNA的损伤程度增大,导致了与修复损伤DNA有关的Chk1基因的表达量上升,从而提高或维持两性溞的种群密度。同时我们也注意到,两性溞在两性生殖时所产生的休眠卵随卵鞍排到体外发育至囊胚期即停止发育,在外界经过滞育期,待环境适宜后才继续发育[14]。Chk1基因在休眠卵中表达量明显低于两性溞和孤雌溞,是否这个细胞周期调节因子也作用于休眠卵,使其终止分裂,停止发育。目前我们对Chk1基因在生殖转化中的作用,都是推测性的,还有待于今后通过原位杂交和RNA干扰等技术进一步研究确定。
本研究克隆得到了蚤状溞Chk1基因的cDNA全长序列,其中包括一个编码了498个氨基酸的全长为1497 bp的开放阅读框(ORF)。与NCBI公布的蚤状溞全基因组(2011年)中的假设蛋白序列(GenBank登录号:EFX87696.1)相比有97%的相似度,后者ORF编码了489个氨基酸。从ORF包含的氨基酸序列中我们可以看到有多个磷酸化位点和1个N-糖基化位点,其生理功能的结构基础就是通过蛋白质的磷酸化、糖基化来完成。蚤状溞DpChk1的ORF有多个位点有可能发生磷酸化修饰和糖基化修饰,这些存在的位点可能就是DpChk1被转运到某个特定的细胞器后的加工位点,通过此翻译后加工来实现其生理功能。至于这些可能与生殖细胞分裂相关的位点以及DpChk1确切的翻译后加工机制还需要进一步的深入研究。蚤状溞Chk1基因由1个265残基的N-末端激酶功能域和1个233残基的C-末端调节域组成。激酶功能域中含有一个“GxGxxG”域,是ATP结合部位[1],调节域中含有6个Ser-Gln (SQ)和Thr-Gln (TQ) 序列,是蛋白激酶的激活部位(见图3)。Zhao等[19]的研究指出人Chk1蛋白由一个257残基的N-末端激酶功能域和1个211残基的C-末端调节域构成,调节域中有5个SQ/TQ位点,其中Ser-317和Ser-345被磷酸化后,才能激活激酶功能域。Shiromizu等[20]发现HeLa细胞中Chk1蛋白的激活依赖于其Ser-286和Ser-301的磷酸化。本实验中,蚤状溞Chk1蛋白调节域中有3个保守的SQ/TQ序列(321~322、357~358、369~370),但是具体是哪几个Ser(Thr)被磷酸化也有待进一步的研究。
[1]Liu Q, Guntuku S, Cui X S, et al. Chk1 is an essential kinase that is regulated by Atr and required for the G2/M DNA damage checkpoint[J]. Genes & Development, 2000, 14(12): 1448-1459.
[2]Walworth N, Davey S, Beach D. Fission yeast chkl protein kinase links the rad checkpoint pathway to cdc2[J]. Nature, 1993, 363: 368-371.
[3]Furnari B,Rhind N,Russell P. Cdc25 mitotic inducer targeted by chk1 DNA damage checkpoint kinase[J]. Science,1997,277(5331): 1495-1497.
[4]Xiao Z, Chen Z, Gunasekera A H, et al. Chk1 mediates S and G2 arrests through Cdc25A degradation in response to DNA-damaging agents[J]. Journal of Biological Chemistry, 2003, 278(24): 21767-21773.
[5]Peddibhotla S, Lam M H, Gonzalez-Rimbau M, et al. The DNA-damage effector checkpoint kinase 1 is essential for chromosome segregation and cytokinesis[J]. Proceedings of the National Academy of Sciences, 2009, 106(13): 5159-5164.
[6]Ward I M, Minn K, Chen J. UV-induced ataxia-telangiectasia-mutated and Rad3-related (ATR) activation requires replication stress[J]. Journal of Biological Chemistry, 2004, 279(11): 9677-9680.
[7]Matsumoto K, Nagahara T, Okano J, et al. The growth inhibition of hepatocellular and cholangiocellular carcinoma cells by gemcitabine and the roles of extracellular signal-regulated and checkpoint kinases[J]. Oncology Reports, 2008, 20(4): 863-872.
[8]Tsimaratou K, Kletsas D, Kastrinakis N G, et al. Evaluation of claspin as a proliferation marker in human cancer and normal tissues[J]. The Journal of Pathology, 2007, 211(3): 331-339.
[9]Yuki T, Maniwa Y, Doi T, et al. DNA damage sensor protein hRad9, a novel molecular target for lung cancer treatment[J]. Oncology Reports, 2008, 20(5): 1047-1052.
[10]秦 芬, 李 强, 徐晓倩, 等. 隆线溞孤雌卵胚胎发育的形态学研究[J]. 华东师范大学学报:自然科学版, 2010(2):67-76.
[11]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT methods[J]. Methods, 2001, 25: 402-408.
[12]Ojima Y. A cytological study on the development and maturation of the parthenogenetic and sexual eggs ofDaphniapulex(Crustacea-Cladocera)[J]. Kwansei Gakuen Univ Ann Stud, 1958, 6: 123-176.
[13]Zaffagnini F, Sabelli B. Karyologic observations on the maturation of the summer and winter eggs ofDaphniapulexandDaphniamiddendorffiana[J]. Chromosoma, 1972, 36(2): 193-203.
[14]秦 芬. 隆线溞孤雌卵胚胎发育及其两性溞EST的初步研究[D]. 上海:华东师范大学, 2009.
[15]蒋燮治,堵南山. 中国动物志. 节肢动物门. 甲壳纲. 淡水枝角类[M]. 北京:科学出版社,1979.
[16]Bacci G, Cognetti G, Vaccari A M. Endomeiosis and sex determination inDaphniapulex[J]. Experientia ,1961, 17(11): 505-506.
[17]赵云龙. 枝角类动物生殖生物学研究进展[J]. 生物学教学, 2012(1): 2-4.
[18]王海燕, 张 敏, 邹 萍. 细胞周期检测点激酶1的研究进展[J]. 医学分子生物学杂志, 2005, 2(2): 147-149.
[19]Zhao H, Piwnica-Worms H. ATR-mediated checkpoint pathways regulate phosphorylation and activation of human Chk1[J]. Molecular and Cellular Biology, 2001, 21(13): 4129-4139.
[20]Shiromizu T, Goto H, Tomono Y, et al. Regulation of mitotic function of Chk1 through phosphorylation at novel sites by cyclin‐dependent kinase 1 (Cdk1)[J]. Genes to Cells, 2006, 11(5): 477-485.
Clonning and expression analysis of Chk1 gene inDaphniapulex
FANG Zeng-bing1, DAI Xin-yu1, ZOU Xiu1, GUO Xiao-ge1,XU Shan-liang1, WANG Dan-li1, ZHAO Yun-long2
(1. College of Marine Science, Ningbo University, Ningbo 315211;2. College of Life Science, East China Normal University, Shanghai 200062, China)
The full-length cDNA of a Chk1 (DpChk1) was cloned from cladoceranDaphniapulexusing rapid amplification of complementary DNA ends (RACE) method. The DpChk1 cDNA is 1767 bp in length; and it has a 1497-bp open reading frame that encodes a 498-amino-acid polypeptide containing three conserved Ser-Gln (SQ), and Thr-Gln (TQ) sequence. In addition, DpChk1 shared homology of 51%-55% with gene inRhipicephaluspulchellus,Megachilerotundata,Metaseiulusoccidentalis,AcyrthosiphonpisumandDrosophilamelanogaster. Phylogenetic analysis revealed that DpChk1 protein has a close genetic relationship withPhylumarthropodasuch asAcyrthosiphonpisum,Megachilerotundata,Drosophilamelanogaster,Rhipicephaluspulchellus,Metaseiulusoccidentalisand so on. qPCR results (real-time quantitative PCR) showed that the DpChk1 expression was significantly higher (P<0.05) in ephippial female than in parthenogenetic female and was the lowest in the resting egg. Therefore, Chk1 was closely related to the reproduction conversion ofDaphniapulex.
Daphniapulex; Chk1; Real time-PCR; reproductive conversion
2014-09-28,
2014-11-07
国家自然科学基金项目(31172043); 浙江省自然科学基金项目(LY12C19003); 上海市科技创新行动计划项目(12391900700); 宁波市创新团队项目(2011B81003); 宁波大学胡岚优秀博士基金
方增冰,硕士研究生,研究方向为鱼类资源及养殖,E-mail: ice19870906@163.com;
王丹丽, 教授,研究方向为从事水生动物学研究,E-mail: wangdanli@nbu.edu.cn; 赵云龙, 教授,研究方向为从事甲壳动物学研究,E-mail: ylzhao@bio.ecnu.edu.cn。
S917.4;Q78
A
2095-1736(2015)02-0012-05
doi∶10.3969/j.issn.2095-1736.2015.02.012

