LEEP术治疗宫颈上皮内瘤变145例临床观察
李永胜
近年来年轻宫颈癌患者每年以2%~3%的速度增长,呈明显上升趋势[1]。对宫颈上皮内瘤变(CIN)的早期诊断及治疗是预防宫颈癌的关键,因CIN 是宫颈浸润癌发生演变过程中的前期病变阶段。正因宫颈癌的发生演变是一个较长的过程,也就为宫颈病变的早期诊治提供了较好的时机。目前CIN 的诊断率在宫颈细胞学和阴道镜的广泛应用下得到了明显的提升,而高频电波刀(loop electrosurgical excision procedure,LEEP)宫颈锥切术对其治疗已获得临床的广泛认可。笔者采用LEEP 治疗CIN145 例,现报告如下。
1 资料与方法
1.1 一般资料 选择2011年4月-2013年4月我院门诊145 例经阴道镜检查、宫颈活检、病理学检查诊断为CIN 并行LEEP 宫颈锥切术的患者,均符合手术指征,无手术禁忌,对其全部资料进行回顾性分析。其中CINⅠ58 例,CINⅡ73 例,CINⅢ14 例,术后标本进行病理学检查,年龄25~50 岁,平均年龄35 岁。平均随访2年。
1.2 手术方法(1)设备:采用韩国UM-150A 高频电波刀,技术参数:输出功率50 W,电圈尺寸根据病变范围确定。(2)术前准备:患者术前1 周内进行进行阴道镜检查,获取转化去最新变化信息,确定CIN 解剖学位置及分布特征;于月经干净后3~7 d 手术,术前进行血常规、凝血功能、尿常规、盆腔B超等常规检查,无出血性疾病、阴道炎、盆腔炎、宫颈炎等。患者确诊为宫颈浸润癌的不宜使用LEEP 术。(3)操作方法:患者取膀胱截石位,常规消毒铺巾,充分消毒外阴、阴道、宫颈;2%利多卡因于宫颈6 点和12 点局麻,电圈尺寸的选用根据转化区横向范围的大小和病变是否扩展到宫颈管内深度来确定,在转化区病变边缘外侧3~5 mm 处进出电极,从边到边直线移动,360 度切除整个转化区及部分宫颈管组织,必要时周边及基底部可以补切。记录出血量及手术时间,标记切下的组织送病检。宫颈创面采用热凝棒或电凝止血,出血较多者可用2~4 单位巴曲亭10 ml 生理盐水溶解,明胶海绵湿敷填塞压迫止血或术前静脉注射巴曲亭2 单位,可减少术中及术后出渗血,术后3 d 口服抗生素。1 个月内每周随访,关注阴道分泌物及宫颈创面恢复情况。2 个月内禁盆浴及性生活。
2 结果
2.1 手术时间、出血及并发症发生情况 手术时间3~15 min,平均6 min,术中出血量3~30 ml,7 例(4.8%)出现并发症,其中因术中出血多缝合宫颈1 例;术后创面感染2 例;宫颈口粘连、狭窄3 例;2 周内创面经期大出血1 例。
2.2 手术前后病理结果比较 其中宫颈病理诊断术后111例与术前相符,符合率76.6%。术前阴道镜下宫颈活检宫颈上皮内瘤变与术后病理诊断呈正相关(r=0.796,P<0.01)。
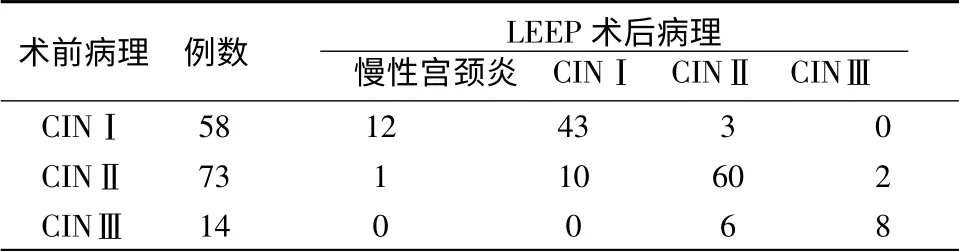
表1 LEEP 术前与术后病理结果对照
2.3 宫颈塑形情况 术后3~6月修复再生的宫颈质软、光滑、弹性好则为塑形满意,宫颈口柱状上皮外翻或显露、宫颈红斑、宫颈口狭窄或松弛,有息肉增生等。本组研究塑形满意率91.7%。
2.4 术后随访 平均随访2年无复发。CINⅢ级患者术后病变持续存在1年以上3 例,2年后随访结果正常;4 例出现下腹疼痛,可以忍受,未作处理。
3 讨论
宫颈上皮内瘤变(CIN)是宫颈浸润癌的癌前病变,包括宫颈原位癌及宫颈不典型增生。CIN 大约10年可发展演变为宫颈癌,因此CIN 的诊断和治疗是预防宫颈癌的关键所在。早在上世纪90年代LEEP 就在欧美迅速发展开来,目前LEEP几十种不同形状和尺寸的电极适宜切除各种病变组织并完整地保留标本,即可诊断也可用于治疗。该手术操作简单、耗时短、成功率高、不需住院,易被患者接受,避免了激光锥切热损伤大,很难提供完整的组织病理检查的缺点,同时克服了冷刀锥切出血多、缝合困难等问题[2]。
文献报道显示,LEEP 术术后并发症发生率为3%~14.1%[3],主要是术后出血、感染、宫颈管狭窄粘连等。本组研究并发症发生率为4.8%(7/145),术中及术后出渗血较少,因在术前静脉注射巴曲亭、术中局部使用巴曲亭进行止血,效果较好。1 例因术中出血多缝合宫颈的患者为CINⅢ,可能是一方面宫颈病变较重,另一方面切除宫颈深度及范围较大。减少术中出血除了应用止血药外,还要选择合适的电圈一次性完整切除病灶,避免多次切除增加出血机会,并且电圈不能移动过快,以防止切口表面广泛渗血[4]。术后2 周出血一般是脱痂期出血,若出血较多应及时治疗;如果术后出血时间较长是因感染及宫颈愈合不佳所导致。所以说,提高LEEP 术操作熟练程度及认真管理和随访患者都可以最大限度地减少并发症的发生。
本组资料中,术前阴道镜LEEP 术前阴道镜下活检与术后病理诊断符合率76.6%,相关系数呈正相关关系(rs =0.796,P<0.01),说明术前阴道镜下活检可作为LEEP 手术依据。阴道镜下定位活检都是在病变最严重的位置取标本,并且本来病灶较小的活检时又被取出,这就导致术后病理结果较术前轻,病理诊断级别下降占20%(29/145)。考虑到阴道镜下多点活检不能取到宫颈管内病变组织,同时其视野及取材有限、表浅,会无法判断有无浸润、累及腺体的深度及宫颈管受累情况,可能易造成原位癌及浸润癌的漏诊[5]。
LEEP 术可在门诊实施,患者并发症低且易于接受,但对年轻妇女的未来妊娠有早产或胎膜早破的风险,发生产科并发症的风险增加[6-7]。2006年《ASCCP 循证医学指南》指出多数青年期与年轻的成年妇女CIN 可自发消退,所以要严格把握CIN 的诊断和治疗指征,结合阴道镜诊断、细胞学,合理应用高频电波刀子宫锥切术。
[1]乐 杰.妇产科学[M].北京:人民卫生出版社,2003:285-286.
[2]徐晓英,龙雯晴,王秀美,等.改良冷刀锥切与LEEP 治疗宫颈高级别上皮内瘤样病变的疗效比较[J].右江医学,2015,41(1):61-62.
[3]Johnson N,Khalili M,Hirschwitz L,et al.Predicting residual disease after excision of cervical dysplasia[J].BJOG,2003,110(10):952.
[4]付 婷,董俊英,晋雅凌.LEEP 刀在宫颈上皮内瘤变治疗中的应用[J].陕西医学杂志,2010,39(6):738.
[5]黄 琼.术前阴道镜与LEEP 术后病理检查宫颈病变对比分析[J].中国计划生育杂志,2010,18(7):432.
[6]翟宏华,刘艳青,翟红梅.LEEP 刀治疗宫颈病变后妇女妊娠结局及分娩方式的影响[J].2015,38(5):789-790.
[7]Duesing N,Schwarz J,Choschzick M,et al.Assessment of cervical intraepithelial neoplasia(CIN)with colposcopic biopsy and efficacy of loop electrosurgical excision procedure(LEEP)[J].Arch Gynecol Obstet,2012,286(6):1549-1554.

