添加乳酸菌制剂和丙酸对全株玉米全混合日粮青贮发酵品质和有氧稳定性的影响
陈 雷,原现军,郭 刚,2,闻爱友,肖慎华,巴 桑 ,余成群,邵 涛*
(1.南京农业大学 饲草调制加工与贮藏研究所,南京 210095; 2.山西农业大学 动物科学技术学院,太谷030801;3.中国科学院 地理科学与资源研究所,北京100101; 4.西藏日喀则地区草原工作站,日喀则 857000)
添加乳酸菌制剂和丙酸对全株玉米全混合日粮青贮发酵品质和有氧稳定性的影响
陈 雷1,原现军1,郭 刚1,2,闻爱友1,肖慎华1,巴 桑4,余成群3,邵 涛1*
(1.南京农业大学 饲草调制加工与贮藏研究所,南京 210095; 2.山西农业大学 动物科学技术学院,太谷030801;3.中国科学院 地理科学与资源研究所,北京100101; 4.西藏日喀则地区草原工作站,日喀则 857000)
为评价乳酸菌制剂和丙酸对西藏地区全株玉米全混合日粮(TMR)发酵品质和有氧稳定性的影响。试验设对照组、乳酸菌制剂和丙酸添加组3个处理。全混合日粮青贮45 d后全部开封取样,测定其发酵品质,并分别在有氧暴露第6、9和12天取样评定其有氧稳定性。每个处理组每个时间点开5个青贮窖即5个重复。结果表明,全株玉米全混合日粮干物质含量适宜、乳酸菌数量和水溶性碳水化合物含量充足,因此对照组发酵品质良好,添加乳酸菌制剂进一步改善了发酵品质,虽然丙酸一定程度上抑制了乳酸发酵,但发酵品质仍属良好。在有氧暴露阶段,对照组和乳酸菌添加组乳酸含量持续下降,pH﹑氨态氮/总氮和酵母菌数量显著上升(P<0.05)。丙酸添加组乳酸含量前9 d逐渐升高,之后显著下降(P<0.05),pH基本趋于稳定,12 d后降至3.75,酵母菌数目显著(P<0.05)低于其他组。综合全株玉米TMR的发酵品质和有氧稳定性,添加乳酸菌制剂改善了全株玉米TMR的发酵品质但没有提高其有氧稳定性,添加丙酸尽管一定程度抑制了乳酸发酵,但明显提高了发酵全混合日粮的有氧稳定性。
乳酸菌制剂;丙酸;全株玉米全混合日粮;发酵品质;有氧稳定性
近年来,西藏地区从内地引进高产奶牛对当地奶牛进行杂交改良,奶牛生产性能一定程度上得到了改善。但饲草料严重不足、饲养管理落后、饲养水平低是目前西藏奶牛养殖业中最突出的问题,影响了奶牛健康生长和生产力的发挥,导致产奶量和乳品质低下。目前西藏地区致力于推广以全株玉米为主要粗饲料的发酵全混合日粮(TMR)饲养技术,应用该技术可提高奶牛的干物质采食量和饲料利用率,改善瘤胃功能,降低了奶牛发病率,提高生产性能;此外应用该技术还可以降低生产中由原来少量、多批次购入精料原料带来的交通运输成本,提高奶产品的生产效率。但是由于农牧民TMR加工管理技术经验不足,发酵TMR饲料在农区长途运输及农户开窖饲喂过程中易引起包膜破损,空气浸入,导致发酵TMR饲料腐败变质,影响了发酵TMR饲料的适口性和营养价值。因此,如何提高发酵TMR品质和有氧稳定性成为此项技术在西藏地区得以顺利推广的关键。
同型乳酸菌如植物乳杆菌(Lactobacillusplantarum)能够加速青贮初期乳酸发酵,快速降低pH[1],而异型乳酸菌如布氏乳杆菌(Lactobacillusbuchneri)在青贮过程中产生乳酸的同时能产生乙酸等挥发性短连脂肪酸,可有效抑制酵母和霉菌,提高有氧稳定性。I.Filya[2]指出植物乳杆菌和布氏乳杆菌组合添加不仅改善了玉米青贮发酵品质也提高了其有氧稳定性。短链脂肪酸中,丙酸具有较强的抗菌效果,丙酸及丙酸盐已广泛应用于青贮饲料的生产中,在抑制青贮饲料有氧腐败方面具有良好的效果[3]。丙酸通过抑制酵母菌等有害微生物的活性,减少其对乳酸、水溶性碳水化合物和粗蛋白的降解,从而提高青贮饲料开窖运输和饲喂过程中的营养损失,提高有氧稳定性[4]。
本试验旨在探讨添加乳酸菌制剂和丙酸对TMR发酵品质和有氧稳定性的影响,为西藏发酵TMR饲料的生产提供技术支撑,促进当地奶牛业的发展。
1 材料与方法
1.1 试验材料
将种植于西藏山南地区贡嘎县吉那奶牛场试验地的全株玉米于2012年9月19日刈割,全株玉米处于1/2乳熟期,用铡刀切成2 cm左右,之后将全株玉米和精料按照配方(表2)充分混匀。
精料混合料(主要包括玉米、菜籽粕、DDGS、棉粕、小麦麸等)由西藏吉那奶牛场配制。
乳酸菌制剂主要由植物乳酸杆菌和布氏乳杆菌组成,保证每克青贮原料中含有1×106cfu·g-1FW,由南京农业大学饲草调制加工与贮藏研究所和西藏高原草业工程技术研究中心研制。
1.2 试验设计
试验采用完全随机设计,设对照组(C),0.4%丙酸添加组(P),乳酸菌制剂添加组(LAB):1 g·kg-1TMR饲料,均以鲜重为基础,全混合日粮青贮45 d后全部开封取样,测定其发酵品质,并分别在有氧暴露第6、9和12天取样评定其有氧稳定性。每个处理组每个时间点开5个青贮窖即5个重复,共计80个实验室青贮窖。
表1 全混合日粮青贮前化学和微生物成分
Table 1 Chemical and microbial composition of whole-crop corn and TMR before being ensiling

项目Item全株玉米Whole-cropcorn全混合日粮TMR水溶性碳水化合物/(g·kg-1DM)WSC276.15223.54缓冲能/(mEq·kg-1DM)BC222.06230.67乳酸菌/(log10cfu·g-1FW)Lacticacidbacteria6.605.56酵母菌/(log10cfu·g-1FW)Yeast4.114.59
表2 全混合日粮组成和化学成分
Table 2 Ingredient and chemical composition of total mixed ration

%DM
精料:7.5%玉米,20%菜籽粕,20%全棉籽,27.5%DDGS,20%小麦麸, 5%维生素矿物质(% DM)。非纤维性碳水化合物(NFC)=100-CP-NDF-EE-Ash
Concentrate:7.5%corn,20%rapeseed meal,20%cottonseed meal,27.5%distiller dried grains with soluble,20% wheat bran,5% vitamin and minerals(% DM).NFC=100-CP-NDF-EE-Ash
1.3 试验方法
1.3.1 发酵TMR饲料的调制 取配制好的TMR饲料,按试验设计分别将乳酸菌制剂和丙酸均匀喷洒在TMR饲料上,并填充到15 L的实验室青贮窖中,压实后盖上盖,并用胶带密封,置于室温下保存。
1.3.2 样品处理 在青贮第45天打开实验室青贮窖,取出全部饲料混合均匀,采用四分法称取35 g放入100 mL的广口三角瓶中,加入70 g的去离子水,4 ℃浸提24 h,然后通过2层纱布和定性滤纸过滤,并将浸提液置于-20 ℃冷冻保存待测。浸提液用来测定pH、乳酸、氨态氮和挥发性脂肪酸含量。将剩余部分发酵TMR饲料收集烘干,测定干物质、总氮以及水溶性碳水化合物。
1.3.3 测定项目及分析方法 干物质(Dry matter,DM)、粗脂肪(Ether extract,EE)、粗灰分(Ash)、粗蛋白(Crude protein,CP)含量采用AOAC方法测定[5];干物质回收率(Dry matter recovery,DMR)按TMR发酵前后重量和干物质含量计算;中性洗涤纤维(Neutral detergent fiber,NDF)和酸性洗涤纤维(Acid detergent fiber,ADF)采用范氏纤维测定法测定[6],测定NDF加入耐高温α淀粉酶和亚硫酸钠;非结构性碳水化合物(NFC)依据NRC(2001)公式计算(100-CP-NDF-EE-Ash)[7];pH用HANNA pH 211型pH计测定;缓冲能(Buffer capacity,BC)用盐酸、氢氧化钠滴定法测定。乳酸含量(Lactic acid,LA)用对羟基联苯比色法测定[6];水溶性碳水化合物含量(Water soluble carbohydrate,WSC)采用蒽酮-硫酸比色法测定[6];氨态氮含量(Ammonia nitrogen,AN)采用苯酚-次氯酸钠比色法测定[6];挥发性脂肪酸(Volatile fatty acids,VFAs)采用高效气相色谱仪(日本岛津 GC-14B)测定,包括乙酸(Acetic acid,AA)、丙酸(Propionic acid,PA)与丁酸(Butyric acid,BA),测定条件:色谱柱为毛细管柱,柱温 140 ℃,汽化室温度180 ℃,氢气检测器温度220 ℃,检测器FID,载气为氮气,压力为0.05 MPa,氢气压力为0.05 MPa,氧气压力为0.05 MPa。乳酸菌和酵母菌数量分别采用MRS(de Man,Rogosa,Sharpe)琼脂培养基、马铃薯葡萄糖琼脂培养基(Potato dextrose agar,上海盛思生化科技有限公司)培养计数[1]。乳酸菌用厌氧箱,37 ℃培养3 d;酵母菌用生化培养箱,30 ℃培养4 d。
1.3.4 有氧稳定性分析 青贮45 d后打开全部实验室青贮窖,暴露于空气中,分别于6、9和12 d取样评定有氧稳定性,测定pH,乳酸,氨态氮/总氮和水溶性碳水化合物含量以及乳酸菌和酵母菌的数量。
1.4 数据处理与统计
采用SAS(8.2)软件对试验数据进行方差分析(ANOVA),其中TMR发酵品质的数据采用单因素方差分析,有氧稳定性数据采用双因素(处理和暴露时间)方差分析,并用Tukey’s方法对处理间及有氧暴露天数间数据进行多重比较。
2 结 果
2.1 TMR原料化学成分
全株玉米和TMR原料化学和微生物成分见表1。青贮发酵前TMR干物质含量为354 g·kg-1FW,WSC含量为223.54 g·kg-1DM,缓冲能为230.67 mEq·kg-1DM,乳酸菌数目大于105cfu·g-1FW,酵母菌大于104cfu·g-1FW。
2.2 添加剂对TMR发酵品质的影响
TMR发酵品质见表3,乳酸菌添加组干物质含量和回收率显著高于对照组和丙酸添加组(P<0.05)。乳酸菌制剂添加组pH显著低于对照组和丙酸添加组(P<0.05)。与对照组相比,丙酸添加组显著降低了乳酸含量(P<0.05),而乳酸菌制剂添加组显著提高了乳酸含量(P<0.05)。添加剂处理组均显著降低了乙酸含量(P<0.05),其中乳酸菌制剂添加组乙酸含量显著低于丙酸添加组(P<0.05)。相应地乳酸菌制剂添加组乳酸/乙酸显著高于其2组(P<0.05),达到对照和丙酸添加组的2倍多。与对照组相比,添加剂组显著降低了丁酸含量和氨态氮/总氮(P<0.05),其中乳酸菌制剂添加组显著低于丙酸添加组(P<0.05)。青贮发酵45 d,各添加剂组水溶性碳水化合物含量均显著高于对照组(P<0.05),其中丙酸添加组又显著高于乳酸菌制剂添加组(P<0.05)。丙酸添加组酸性洗涤纤维含量显著低于乳酸菌制剂添加组和对照组(P<0.05)。但乳酸菌制剂组乳酸菌数量显著高于对照组(P<0.05),而丙酸添加组乳酸菌数量显著低于对照组(P<0.05),各组均有少量酵母菌检出。
表3 全混合日粮发酵45 d的化学和微生物成分
Table 3 Chemical and microbial composition of total mixed ration after 45 days of fermentation
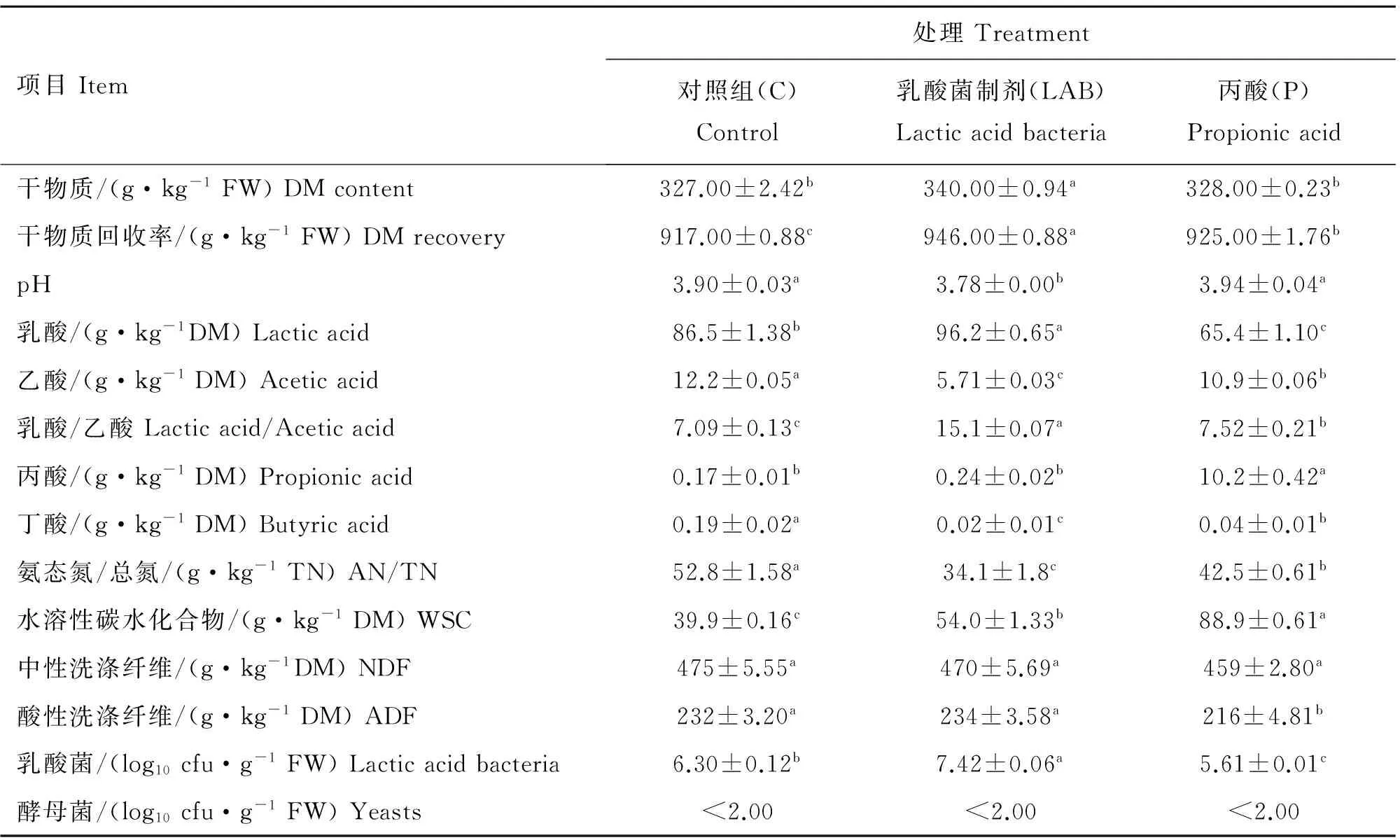
项目Item处理Treatment对照组(C)Control乳酸菌制剂(LAB)Lacticacidbacteria丙酸(P)Propionicacid干物质/(g·kg-1FW)DMcontent327.00±2.42b340.00±0.94a328.00±0.23b干物质回收率/(g·kg-1FW)DMrecovery917.00±0.88c946.00±0.88a925.00±1.76bpH3.90±0.03a3.78±0.00b3.94±0.04a乳酸/(g·kg-1DM)Lacticacid86.5±1.38b96.2±0.65a65.4±1.10c乙酸/(g·kg-1DM)Aceticacid12.2±0.05a5.71±0.03c10.9±0.06b乳酸/乙酸Lacticacid/Aceticacid7.09±0.13c15.1±0.07a7.52±0.21b丙酸/(g·kg-1DM)Propionicacid0.17±0.01b0.24±0.02b10.2±0.42a丁酸/(g·kg-1DM)Butyricacid0.19±0.02a0.02±0.01c0.04±0.01b氨态氮/总氮/(g·kg-1TN)AN/TN52.8±1.58a34.1±1.8c42.5±0.61b水溶性碳水化合物/(g·kg-1DM)WSC39.9±0.16c54.0±1.33b88.9±0.61a中性洗涤纤维/(g·kg-1DM)NDF475±5.55a470±5.69a459±2.80a酸性洗涤纤维/(g·kg-1DM)ADF232±3.20a234±3.58a216±4.81b乳酸菌/(log10cfu·g-1FW)Lacticacidbacteria6.30±0.12b7.42±0.06a5.61±0.01c酵母菌/(log10cfu·g-1FW)Yeasts<2.00<2.00<2.00
FW.鲜重;AN/TN.氨态氮/总氮。不同小写字母表示不同处理相同青贮天数间差异显著(P<0.05)
FW.Fresh weight;AN/TN.Ammonia nitrogen/total nitrogen.Values with different lower case letters show significant differences among treatments in the same ensiling day(P<0.05)
2.3 添加剂对发酵TMR有氧稳定性的影响
各组发酵TMR有氧暴露阶段化学成分和微生物组成变化见表4。对照组和乳酸菌制剂添加组乳酸含量随着有氧暴露时间的延长显著下降(P<0.05),相应地pH逐渐上升,其中6 d后显著上升(P<0.05),到有氧暴露第12天两组pH均升至7.0以上,而丙酸添加组乳酸含量呈现先升高后下降的趋势,pH基本趋于稳定且9 d后略有下降。
各组氨态氮/总氮随着有氧暴露时间的延长呈上升趋势,有氧暴露前9 d各添加组氨态氮/总氮均显著低于对照组(P<0.05),之后乳酸菌制剂组显著上升(P<0.05),至第12天与对照组持平,而丙酸添加组仍显著低于对照组(P<0.05)。对照组水溶性碳水化合物在有氧暴露前9 d显著下降(P<0.05),之后趋于稳定,乳酸菌制剂添加组水溶性碳水化合物含量随着有氧暴露时间的延长显著下降(P<0.05),而丙酸添加组水溶性碳水化合物含量有氧暴露前期保持稳定,9 d后显著下降(P<0.05)。
在整个有氧暴露阶段,对照组和乳酸菌制剂组乳酸菌数量逐渐下降,其中乳酸菌制剂组始终高于对照组,而丙酸添加组乳酸菌数量先逐渐升高,到第9天达到最高值,之后又显著下降至开窖时水平(P<0.05)。各组酵母菌数量随着有氧暴露时间的延长呈上升趋势,有氧暴露12 d后,对照组和乳酸菌制剂组酵母菌数量均大于 108cfu·g-1,而添加丙酸组显著(P<0.05)降低了酵母菌数量(<104cfu·g-1)。
表4 发酵全混合日粮有氧暴露12 d的化学和微生物成分
Table 4 Chemical and microbial composition of total mixed ration silages after exposure to air for 12 days
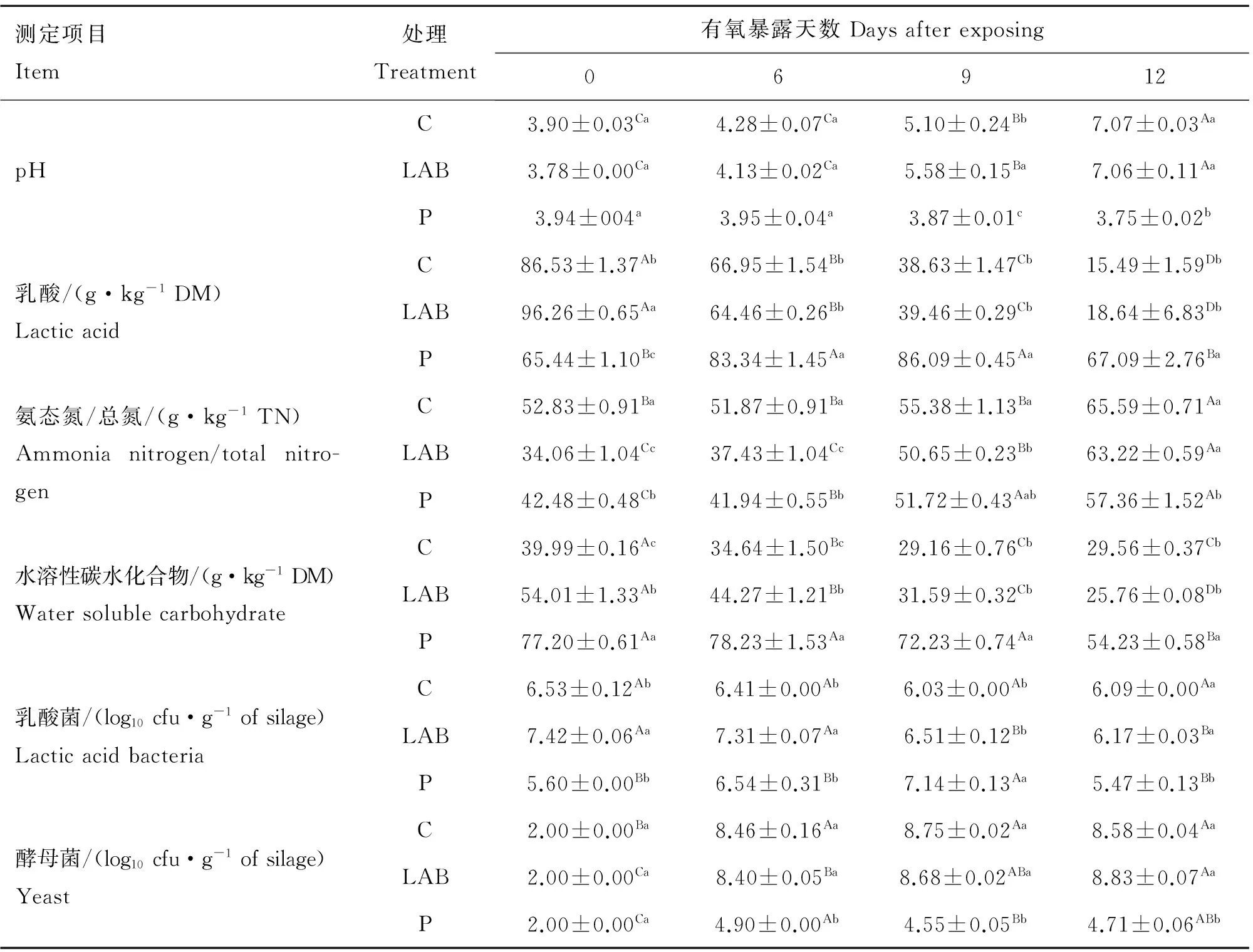
测定项目Item处理Treatment有氧暴露天数Daysafterexposing06912pHC3.90±0.03Ca4.28±0.07Ca5.10±0.24Bb7.07±0.03AaLAB3.78±0.00Ca4.13±0.02Ca5.58±0.15Ba7.06±0.11AaP3.94±004a3.95±0.04a3.87±0.01c3.75±0.02b乳酸/(g·kg-1DM)LacticacidC86.53±1.37Ab66.95±1.54Bb38.63±1.47Cb15.49±1.59DbLAB96.26±0.65Aa64.46±0.26Bb39.46±0.29Cb18.64±6.83DbP65.44±1.10Bc83.34±1.45Aa86.09±0.45Aa67.09±2.76Ba氨态氮/总氮/(g·kg-1TN)Ammonianitrogen/totalnitro-genC52.83±0.91Ba51.87±0.91Ba55.38±1.13Ba65.59±0.71AaLAB34.06±1.04Cc37.43±1.04Cc50.65±0.23Bb63.22±0.59AaP42.48±0.48Cb41.94±0.55Bb51.72±0.43Aab57.36±1.52Ab水溶性碳水化合物/(g·kg-1DM)WatersolublecarbohydrateC39.99±0.16Ac34.64±1.50Bc29.16±0.76Cb29.56±0.37CbLAB54.01±1.33Ab44.27±1.21Bb31.59±0.32Cb25.76±0.08DbP77.20±0.61Aa78.23±1.53Aa72.23±0.74Aa54.23±0.58Ba乳酸菌/(log10cfu·g-1ofsilage)LacticacidbacteriaC6.53±0.12Ab6.41±0.00Ab6.03±0.00Ab6.09±0.00AaLAB7.42±0.06Aa7.31±0.07Aa6.51±0.12Bb6.17±0.03BaP5.60±0.00Bb6.54±0.31Bb7.14±0.13Aa5.47±0.13Bb酵母菌/(log10cfu·g-1ofsilage)YeastC2.00±0.00Ba8.46±0.16Aa8.75±0.02Aa8.58±0.04AaLAB2.00±0.00Ca8.40±0.05Ba8.68±0.02ABa8.83±0.07AaP2.00±0.00Ca4.90±0.00Ab4.55±0.05Bb4.71±0.06ABb
不同大写字母表示相同处理不同天数间差异显著(P< 0.05);不同小写字母表示相同天数不同处理间差异显著(P< 0.05)
Values with different capital lower case letters show significant differences among exposing days in the same treatment,values with different lower letters show significant differences among treatments in the same exposing day(P<0.05)
3 讨 论
3.1 添加剂对全株玉米TMR发酵品质的影响
经过45 d发酵,各组发酵TMR均显示良好的发酵品质,这归因于发酵前TMR干物质含量为300~400 g·kg-1,原料附着乳酸菌超过1×105cfu·g-1FW,发酵底物充足,缓冲能低[7-8]。
乳酸菌制剂组干物质含量及回收率显著高于对照和丙酸添加组,其原因是全株玉米TMR发酵底物充足,添加乳酸菌促进了青贮前期乳酸发酵,加速了实验室青贮窖内环境的酸化,进而抑制了有害微生物的活性及对营养物质的降解利用,减少了干物质损失[9-10],这也表现在乳酸菌制剂组有较高的乳酸含量、较低的pH和氨态氮/总氮。L.E.Phillip等[11]对经过凋萎的紫花苜蓿青贮时接种植物乳杆菌(Lactobacillusplantarum),缩短了pH下降过程,抑制了蛋白降解,减少了氨态氮含量。本试验所添加乳酸菌制剂包括植物乳酸杆菌和布氏乳杆菌,其中布氏乳杆菌为异型乳酸菌,在产生乳酸的同时可以产生乙酸,但本研究乳酸菌制剂组乙酸含量却显著低于对照组,可能是由于全株玉米TMR饲料主要以同型发酵为主,布氏乳杆菌活性被抑制。C.C.Taylor等[12]研究表明,布氏乳杆菌对青贮饲料中乙酸含量的影响与贮藏时间有关,他们发现添加布氏乳杆菌的玉米青贮49 d后仍未显著提高乙酸含量。
丙酸添加组降低了乳酸、乙酸和丁酸含量及氨态氮/总氮,表明添加丙酸不仅抑制了梭菌等有害微生物的活性,减少了对水溶性碳水化合物和蛋白质等营养成分的降解,从而减少了丁酸和氨态氮的生成,也对乳酸菌产生一定的抑制作用,这点与丙酸添加组有较高的WSC含量和较少的乳酸菌相映证。丙酸已作为一种有效的青贮发酵抑制剂广受关注,R.Crawshaw[13]评价了不同水平丙酸对禾本科牧草青贮饲料发酵品质的影响,结果表明丙酸改善了发酵品质,对丁酸菌的抑制力较强,且明显降低了氨态氮含量。
3.2 添加剂对发酵全株玉米TMR有氧稳定性的影响
青贮窖开封后,厌氧环境立即被破坏,好氧性微生物开始活跃。通常情况下,青贮饲料的腐败变质主要由酵母菌增殖引起,当青贮饲料中酵母菌数目大于1×105cfu·g-1时,青贮饲料易发生腐败变质[14]。有氧腐败变质的青贮饲料,乳酸含量下降,pH升高[15]。本试验中,对照组和乳酸菌制剂组乳酸和水溶性碳水化合物含量持续下降,pH、氨态氮/总氮和酵母菌数量显著上升,有氧稳定性较差,这是由于对照组和乳酸菌制剂组发酵品质较好,短链脂肪酸含量较低,难以有效地抑制好氧性酵母菌和霉菌活性。另外,这2组乳酸含量较高,为酵母和霉菌增殖提供了底物,因此也加剧了发酵TMR的腐败变质。K.Ranjitn等[16]指出当青贮饲料暴露到空气中后,有害微生物以发酵产物(如乳酸)和水溶性碳水化合物为底物,生成二氧化碳和水,释放热量,提高了青贮饲料温度,增加了青贮饲料营养成分损失。
丙酸添加组有氧暴露前期乳酸含量继续升高至第9天,而后显著下降,这可能是由于氧气进入青贮饲料后好氧性微生物活跃,丙酸对乳酸菌的抑制作用相对较弱,部分乳酸菌利用剩余的WSC继续产生乳酸,因此整个有氧暴露过程中pH未发生显著变化,D.G.Britt等[17]在玉米青贮时添加不同比例甲酸、丙酸及其组合,发现青贮期间抑制了乳酸菌的活性,降低了乳酸生成,而开窖后由于甲酸与丙酸的挥发和代谢作用,导致乳酸菌可以继续利用青贮过程中节省的发酵底物,从而在有氧暴露14 d后出现一个乳酸含量高峰,这与本研究结果相似。丙酸添加组氨态氮/总氮和酵母菌数量均有升高,但始终低于对照组和乳酸菌制剂组,这是由于丙酸能够有效地抑制真菌、酵母菌和霉菌等微生物的生长繁殖。J.M.Wilkinson等[18]指出未解离短链脂肪酸以被动运输的形式进入微生物细胞内部,之后释放H+降低内部pH,改变微生物细胞渗透性,使微生物不能进行正常的繁殖活动,从而抑制了真菌等微生物的生长繁殖。本试验中有氧暴露9 d后,丙酸添加组乳酸和水溶性碳水化合物含量及乳酸菌数量显著下降,pH、氨态氮/总氮和酵母菌数量基本维持稳定,而对照组和乳酸菌制剂组在有氧暴露第6天已经开始出现腐败变质现象,因此添加丙酸明显推迟了发酵TMR有氧腐败进程。
4 结 论
综上所述,由于全混合日粮干物质含量适宜、乳酸菌数量和水溶性碳水化合物含量充足,因此对照组发酵品质良好,添加乳酸菌制剂进一步改善了发酵品质,虽添加丙酸一定程度抑制了乳酸发酵,但发酵品质仍属良好。发酵45 d开窖后将发酵TMR暴露到空气中,对照组和乳酸菌制剂组在第6天已出现腐败迹象,而添加丙酸可使发酵TMR良好保存12 d以上。
[1] HUISDEN C M,ADESOGAN A T,KIM S C,et al.Effect of applying molasses or inoculants containing homofermentative or heterofermentative bacteria at two rates on the fermentation and aerobic stability of corn silage[J].JDairySci,2009,92(2):690-697.
[2] FILYA I.The Effect of lactobacillus buchneri and lactobacillus plantarum on the fermentation,aerobic stability,and ruminal degradability of low dry matter corn and sorghum silages[J].JDairySci,2003,86(11):3575-3581.
[3] 张增欣,邵 涛.丙酸对多花黑麦草青贮发酵动态变化的影响[J].草业学报,2009,18(2):102-107. ZHANG Z X,SHAO T.The effect of propionic acid addition on the dynamic fermentation changes of Italian ryegrass(Loliummultiflorum) silage[J].ActaPrataculturaeSinica,2009,18(2):102-107.(in Chinese)
[4] WOOLFORD M K.Microbiological screening of the straight chain fatty acids(C1-C12) as potential silage additives[J].JSciFoodAgric,1975,26(2):219-228.
[5] AOAC.Official Methods of Analysis,15th ed.Association of Official Analytical Chemists,Arlington,VA,USA,1990.
[6] 原现军,余成群,夏 坤,等.添加青稞酒糟对西藏箭筈豌豆与苇状羊茅混合青贮发酵品质的影响[J].畜牧兽医学报,2012,43(9):1408-1414. YUAN X J,YU C Q,XIA K,et al.Effect of adding wet hullessbarley distillers’ grains on fermentation quality of mixed silage of common vetch(Vicia sativa) and tall fescue(Festucaarundinacea) in Tibet[J].ActaVeterinariaetZootechnicaSinica,2012,43(9):1408-1414.(in Chinese)
[7] NRC.Nutrient Requirements of Dairy Cattle.7th rev.Ed.National Academy Press,Washington,DC,2001.
[8] WEINBERG Z G.Preservation of forage crops by solid-state lactic acid fermentation-ensiling[M].Current Developments in Solid-state Fermentation.Springer New York,2008:443-467.
[9] CAI Y.The role of lactic acid bacteria in the preparation of high fermentation quality[J].GrasslSci,2001,47:527-533.
[10] CAI Y,FUJITA Y,MURAI M,et al.Application of lactic acid bacteria(Lactobacillus plantarum Chikuso-1) for silage preparation of forage paddy rice[J].GrasslSci,2003,49(5):477-485.
[11] PHILLIP L E,UNDERHILL L,GARINO H.Effects of treating lucerne with an inoculum of lactic acid bacteria or formic acid upon chemical changes during fermentation,and upon the nutritive value of the silage for lambs[J].GrassForageSci,1990,45(3):337-344.
[12] TAYLOR C C,RANJIT N J,MILLS J A,et al.The effect of treating whole-plant barley with Lactobacillus buchneri 40788 on silage fermentation,aerobic stability,and nutritive value for dairy cows[J].JDairySci,2002,85(7):1793-1800.
[13] CRAWSHAW R.The effect of formic and propionic acids on the aero-bic deterioration of grass silage in laboratory units[J].JSciFoodAgric,1981,31:685-694.
[14] MCDONALD P,HENDERSON A R,HERON S J E.The biochemistry of silage(2th ed)[M].Aberystwyth:Cambrian Printers Ltd,1991.
[15] BAYATKOUHSAR J,TAHMASEBI A M,NASERIAN A A.The effects of microbial inoculation of corn silage on performance of lactating dairy cows[J].LivestSci,2011,142(1):170-174.
[16] RANJITN K,KUNG JR L.The effect of lactobacillus buchneri,lactobacillus plantarum or a chemical preservative on the fermentation and aerobic stability of corn silage[J].JDairySci,2000,83(3):526-535.
[17] BRITT D G,HUBER J T,ROGERS A L.Fungal growth and acid production during fermentation and refermentation of organic acid treated corn silages[J].JDairySci,1975,58(4):532-539.
[18] WILKINSON J M,DAVIES D R.The aerobic stability of silage:key findings and recent developments[J].GrassForageSci,2013,68(1):1-19.
(编辑 郭云雁)
The Effects of Lactic Acid Bacteria and Propionic Acid on the Fermentation Quality and Aerobic Stability of Total Mixed Ration Silages Prepared with Whole-crop Corn in Tibet
CHEN Lei1,YUAN Xian-jun1,GUO Gang1,2,WEN Ai-you1,XIAO Shen-hua1, BA Sang4,YU Cheng-qun3,SHAO Tao1*
(1.InstituteofEnsilingandProcessingofGrass,NanjingAgriculturalUniversity,Nanjing210095,China; 2.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China; 3.InstituteofGeographicSciencesandNaturalResourcesResearch,ChineseAcademyofSciences,Beijing100101,China;4.ThePrairieWorkStationofShigatse,Shigatse857000,China)
The objective of this study was to evaluate the effects of lactic acid bacteria and propionic acid on the fermentation quality and aerobic stability of total mixed ration(TMR) silage prepared with whole-crop corn in Tibet.The treatments were as follow:control(no additives),inoculated lactic acid bacteria with 1 g·kg-1or propionic acid adding with 0.4% on fresh matter basis of TMR.All silos per treatment were opened after 45 days of ensiling,5 silos per treatment were used for fermentation quality determination,and then sampled on 6,9 and 12 days after exposure to air which were subjected to aerobic stability evaluation,5 replicates for each treatment at every time point.The results showed that the fermentation quality of control was good as indicated by the appropriate dry matter content,abundance of lactic acid bacteria count and water soluble carbohydrate content.The addition of lactic acid bacteria further improved fermentation quality.Although the addition of propionic acid inhibited the lactic acid fermentation,the fermentation quality was also good.During aerobic exposure stage,control and lactic acid bacteria addition silages showed decrease in lactic acid content,increase in pH,ammonia nitrogen/total nitrogen and the number of yeast.Lactic acid content in propionic acid silages increased during the first 9 days of aerobic exposure,and then significantly(P<0.05) decreased.The pH and the number of yeast in propionic acid silages were significantly(P<0.05) lower than those of control and lactic acid bacteria addition silages.Adding lactic acid bacteria improved fermentation quality but did not affect the aerobic stability;adding propionic acid inhibited lactic acid production during fermentation,while delayed aerobic deterioration of TMR silages,thus adding propionic acid improved the aerobic stability of whole-crop corn total mixed ration silage.
lactic acid bacteria;propionic acid;whole-crop corn TMR;fermentation quality;aerobic stability
10.11843/j.issn.0366-6964.2015.01.013
2013-11-11
“十二五”国家科技支撑计划(2011BAC09B03);中国科学院西藏区域创新平台建设项目;西藏主要农作物秸秆与栽培牧草混合青贮关键技术研究(XZ20093ZD)
陈 雷(1987-),男,吉林长春人,硕士生,主要从事饲草调制加工与反刍动物营养研究,E-mail:CL1016ZJ@126.com
*通信作者:邵 涛,教授,E-mail:taoshaolan@163.com
S816.34
A
0366-6964(2015)01-0104-07

