ISG15和OAS1在奶牛早期妊娠阶段外周血中的表达规律
程 蕾,王定发,刘晓华,向 敏,凌明湖,胡修忠,夏 瑜
(武汉市农业科学技术研究院畜牧兽医科学研究所,武汉 430208)
ISG15和OAS1在奶牛早期妊娠阶段外周血中的表达规律
程 蕾*,王定发,刘晓华,向 敏,凌明湖,胡修忠,夏 瑜
(武汉市农业科学技术研究院畜牧兽医科学研究所,武汉 430208)
本研究旨在揭示干扰素刺激基因ISG15和OAS1在中国荷斯坦奶牛早期妊娠阶段外周血中的表达规律,为利用干扰素刺激基因进行早期妊娠诊断提供理论和方法上的指导。试验用青年母牛共27头,其中自然发情牛10头,同期发情牛17头;人工授精后0、14、18、21和28 d采集外周血并分离总白细胞或白细胞亚类(淋巴细胞、单核细胞、NK细胞);采用荧光定量PCR检测ISG15和OAS1的相对表达量。结果表明:人工授精后18 d妊娠牛外周血中ISG15和OAS1的相对表达量均显著高于空怀牛;ISG15在妊娠牛中一致上调(平均3.92倍),空怀牛中一致下调(平均1.46倍);OAS1在妊娠牛中平均上调3.49倍,空怀牛平均下调1.28倍。自然发情条件下,妊娠牛外周血中ISG15和OAS1的相对表达量均显著高于空怀牛,同期发情条件下两个基因在表达趋势上与之类似,但差异不显著;进一步分析显示:人工授精后18 dOAS1在妊娠牛淋巴细胞中的表达显著高于空怀牛,其中妊娠牛中OAS1一致上调表达,平均上调2.14倍,空怀牛中OAS1一致下调,平均下调1.80倍。研究提示:人工授精后第18 天妊娠牛与空怀牛之间ISG15的差异表达比OAS1更明显;自然发情状态下,妊娠牛与空怀牛之间两个基因差异表达情况比同期发情状态下更明显;相对于外周血总白细胞,妊娠牛与空怀牛外周血淋巴细胞中ISG15、OAS1的差异表达倍数更低。综上表明,利用外周血中ISG15的表达水平可望能够在人工授精后18 d对自然发情奶牛较为准确地做出早期妊娠诊断;对于ISG15、OAS1在外周血免疫细胞亚类中的表达分析,为深入研究奶牛早期妊娠识别的分子机制奠定了基础。
奶牛;ISG15;OAS1;妊娠诊断;基因表达
妊娠诊断是奶牛生产管理中的重要环节,通过判断奶牛的妊娠与否,可及时对空怀牛采取措施进行复配,以尽可能地提高繁殖效率。血清/牛奶中孕酮或妊娠相关蛋白的检测以及直肠检查是目前较常见的妊娠诊断方法,但是这些手段均是在奶牛人工授精3周后才能进行准确诊断[1-4]。如果奶牛人工授精不成功或者发生早期胚胎损失,在3周左右会返情,但是有些空怀牛的返情日期可能会延迟。如果在人工授精后3周能排查空怀牛,可对其实施快速同期发情,在第21~23天进行复配,减少空怀天数和提高奶牛的繁殖率,同时可以减少空怀导致的经济损失,进而提高奶牛养殖的经济效益[5]。目前,能否于奶牛人工授精后一个情期内做出判断的早期妊娠诊断技术已经成为国内外研究的热点之一。
干扰素-τ(IFN-τ)是反刍动物妊娠识别的关键信号[6]。它作为一种旁分泌因子,可以与子宫内膜细胞的相关受体结合,下调催产素受体表达,破坏PGF2α脉冲释放,使得黄体不被溶解,进而维持孕酮分泌以维持妊娠。孕体发育到囊胚期,滋养外胚层开始分泌IFN-τ,随着囊胚的延伸,分泌量也不断增加,孕体附着于子宫上皮即着床之前IFN-τ含量达到峰值,着床之后其分泌量减退。IFN-τ并不是仅在子宫中分泌,它可以分泌到子宫腔,进入子宫静脉,由于该细胞因子含量极低,目前尚不能通过对其直接检测进行妊娠诊断[7-8]。但IFN-τ可引起外周血细胞中干扰素刺激基因的上调表达[7,9],这些干扰素刺激基因的上调表达一方面有助于促进妊娠建立[9],另一方面为建立新的早期妊娠诊断方法提供了契机。
干扰素刺激基因15(Interferon stimulated gene 15,ISG15)和2′-5′寡腺苷酸合成酶1(2′-5′-oligoadenylate Synthetase 1,OAS1)基因是目前研究比较集中的两个重要干扰素刺激基因,已被证实与妊娠相关[8,10-11]。但是,利用干扰素刺激基因的表达量进行妊娠诊断受诸多因素的影响,例如奶牛品种、胎次、检测和分析方法等,它们均可能影响到妊娠诊断的准确性,截至目前,相关技术在国内外仍处于研究阶段。基于此,本研究以中国荷斯坦奶牛为试验牛群,分别于人工授精后14、18、21和28 d采集奶牛外周血,用荧光定量PCR方法检测了ISG15和OAS1基因在不同发情诱因奶牛外周血中表达变化规律;通过分离人工授精后18和21 d奶牛外周血中的淋巴细胞、NK细胞和单核细胞,进一步检测了ISG15和OAS1基因在不同白细胞亚类中的表达量。本研究为深入揭示ISG15和OAS1基因的表达规律和利用基因转录水平建立科学的早期妊娠诊断方法提供依据和参考。
1 材料与方法
1.1 试验动物及样本采集
选择武汉市惠尔康扬子江乳业有限公司和金旭畜牧科技发展有限公司奶牛场体况一致的青年牛,10头自然发情的奶牛按照奶牛场的正常程序进行人工授精,9头达到配种条件但尚未发情的青年牛采用生源2+1(宁波三生药业有限公司)实施同期发情和定时输精程序:即先注射1支生源(注射用促性腺激素释放激素GnRH,100 μg·支-1),7 d后注射1支诱情素(注射用氯前列醇钠PG-Cl,0.5 mg·支-1),接着48 h之后再注射1支生源,16~18 h后不用观察母牛的发情表现直接输精。利用EDTAK2自动定量静脉采血管(武汉致远医疗科技有限公司)分别于人工授精后0、14、18、21和28 d尾静脉采集血液5~10 mL(n=19),2 h内冷藏运输至实验室后立即进行总RNA提取。人工授精后50~60 d进行直肠检查,根据直肠检查的结果将试验牛只分为妊娠牛和空怀牛。其中,自然发情妊娠牛5头,空怀牛5头;同期发情妊娠牛6头,空怀牛3头。
对同期发情青年牛(n=8)分别于人工授精后0、18和21 d采集外周血,样本2 h内冷藏运输至实验室后分别进行白细胞亚类分离和细胞总RNA提取。根据直肠检查结果将试验牛只分为妊娠牛(n=4)和空怀牛(n=4)。
1.2 白细胞亚类分离、总RNA提取及反转录
采用单核细胞、淋巴细胞和NK细胞分离试剂盒(天津市灏洋生物制品科技有限责任公司)分离外周血中白细胞亚类。利用RNAprep pure血液总RNA提取试剂盒或RNAprep pure培养细胞总RNA提取试剂盒(天根生化科技有限公司)分别提取全血和白细胞亚类中总RNA,具体步骤参照试剂盒说明书进行。利用NanoDrop 2000超微量分光光度计(Thermo Scientific)计算RNA样本浓度并进行纯度分析(OD260 nm/OD280 nm=1.9~2.1);利用改良的常规琼脂糖凝胶(1.2%)电泳检测RNA完整性[12];通过质检的样本分装后,于-80 ℃保存备用。反转录采用RevertAidTMFirst-Strand cDNA Synthesis kit(Fermentas)进行,每个反应RNA用量为500 ng,具体步骤参照试剂盒说明书进行。
1.3 牛ISG15和OAS1基因的荧光定量PCR检测
用于荧光定量PCR扩增的预混液(SYBR®Green Mix)购自东洋纺(上海)生物科技有限公司,反应体系共20 μL:2×SYBR®Green 10 μL,上、下游引物各0.5 μL(10 μmol·L-1),cDNA模板0.3 μL,最后用ddH2O补至20 μL。牛ISG15、OAS1及内参基因β-Actin引物信息见表1[8,10]。每个样本重复3次,定量PCR试验在罗氏LightCycler®480实时荧光PCR仪上进行。反应条件:95 ℃预变性60 s,95 ℃变性15 s,60~62 ℃退火30 s;72 ℃延伸30 s,共40个循环;熔解曲线及信号采集:58~95 ℃,0.5 ℃·s-1,共10 s。
表1 定量PCR引物的序列及参数
Table 1 Primer sequences and parameters used for the real-time quantitative PCR

目的基因Targetgenes引物序列(5'-3')Primersequences退火温度/℃Tm扩增长度/bpProductsizeISG15F:GGTATCCGAGCTGAAGCAGTTR:ACCTCCCTGCTGTCAAGGT6287OAS1F:ACCCTCTCCAGGAATCCAGTR:GATTCTGGTCCCAGGTCTGA60199β-ActinF:CTGGACTTCGAGCAGGAGATR:GGATGTCGACGTCACACTTC60/62208
1.4 数据分折
基因相对表达以2-△△Ct表示样品中目的基因mRNA相对表达量[13],0 d 时各基因的相对表达量较正为1,其他时间点的表达量均为0 d 时表达量的倍数。试验数据用“平均值±标准误(X±SEM)”表示,妊娠牛与空怀牛各时间点基因表达量的差异采用t检验。P<0.05和P<0.01分别表示差异显著和极显著。
2 结 果
2.1ISG15和OAS1基因在奶牛外周血液中的表达
人工授精后一个情期内,干扰素刺激基因ISG15和OAS1在妊娠牛外周血液中的表达量发生显著变化(图1);二者整体上呈上升趋势并于21 d 达到峰值,28 d 时轻微下调或保持不变。空怀牛ISG15和OAS1基因的表达量在14和18 d 无明显变化,而21和28 d上调表达且幅度较大。人工授精后14、21和28 d,妊娠牛ISG15、OAS1基因的表达量与空怀牛均无显著差异;而人工授精后18 d,妊娠牛外周血液中ISG15基因的表达量极显著高于空怀牛(P<0.01),妊娠牛OAS1基因的表达量显著高于空怀牛(P<0.05)。人工授精后第18天,妊娠牛中ISG15基因一致上调表达,平均上调表达3.92倍,空怀牛中ISG15基因一致下调表达,平均下调表达1.46倍(表2)。与ISG15基因相比,尽管第18天妊娠牛或空怀牛某些个体中OAS1基因的表达趋势不同,但总体上妊娠牛中OAS1基因平均上调表达3.49倍,空怀牛平均下调表达1.28倍(表2)。

**.差异极显著(P<0.01);*.差异显著(P<0.05),下同**.Significance level of 0.01;*.Significance level of 0.05;The same as below图1 ISG15和OAS1在奶牛外周血液中的相对表达量Fig.1 Relative gene expressions of bovine ISG15 and OAS1 in peripheral blood
表2 人工授精后18 d妊娠牛和空怀牛中ISG15、OAS1相对于0 d(对照)的表达量
Table 2 The comparative gene expressions(18 dvs.0 d) ofISG15 andOAS1 on 18 d post artificial insemination
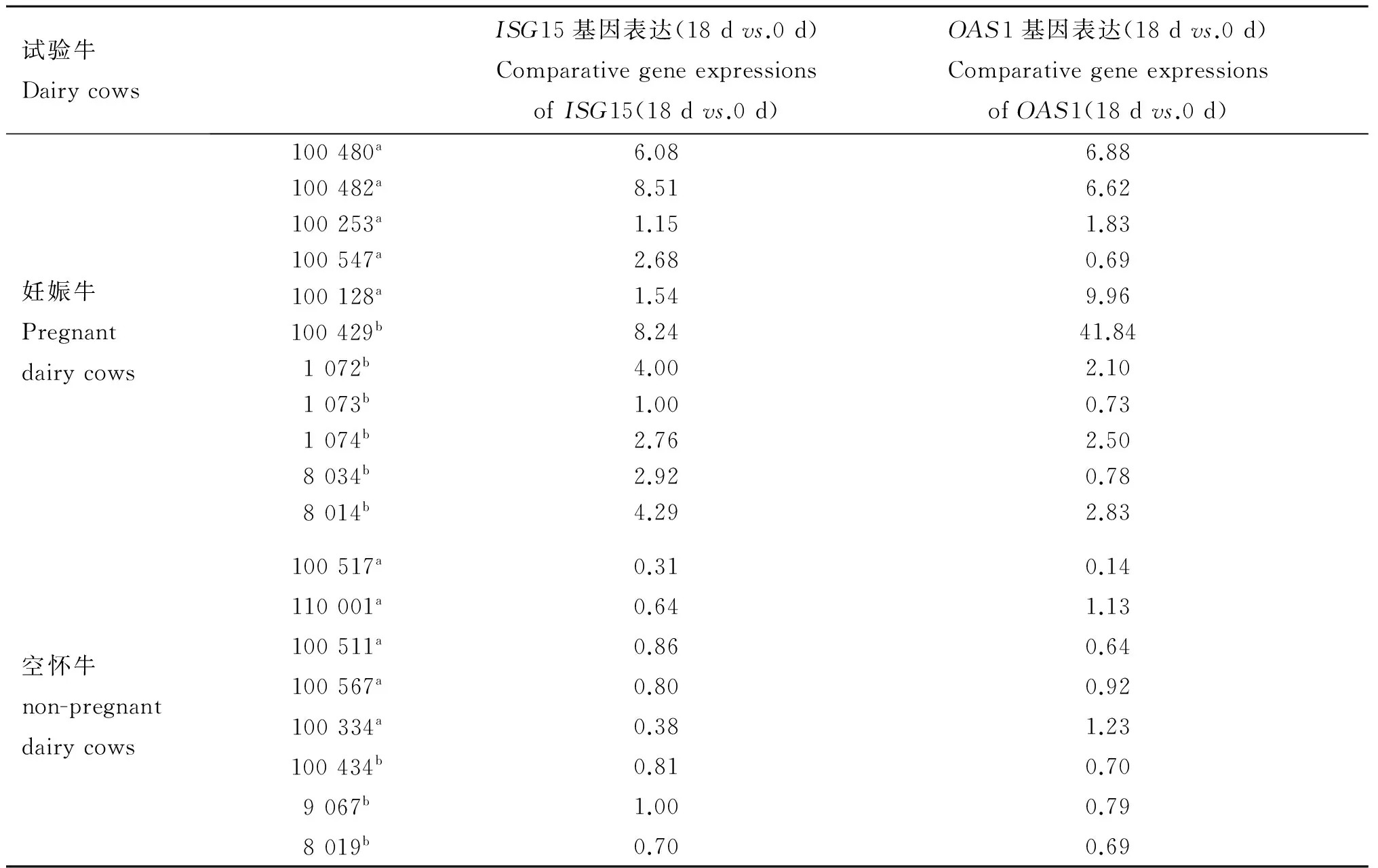
试验牛DairycowsISG15基因表达(18dvs.0d)ComparativegeneexpressionsofISG15(18dvs.0d)OAS1基因表达(18dvs.0d)ComparativegeneexpressionsofOAS1(18dvs.0d)妊娠牛Pregnantdairycows100480a6.086.88100482a8.516.62100253a1.151.83100547a2.680.69100128a1.549.96100429b8.2441.841072b4.002.101073b1.000.731074b2.762.508034b2.920.788014b4.292.83空怀牛non-pregnantdairycows100517a0.310.14110001a0.641.13100511a0.860.64100567a0.800.92100334a0.381.23100434b0.810.709067b1.000.798019b0.700.69
a.自然发情;b.同期发情
a.Dairy cows of spontaneous estrus;b.Dairy cows of oestrus synchronisation
2.2 不同发情诱因下ISG15和OAS1基因在奶牛外周血中的表达
在不同的发情诱因下,人工授精后外周血中干扰素刺激基因ISG15和OAS1的表达量变化不同(图2)。总体上,人工授精后一个情期内,自然发情妊娠牛和同期发情妊娠牛ISG15和OAS1基因的表达趋势一致,均表现为持续上调并于21 d达到峰值。自然发情空怀牛与同期发情空怀牛在人工授精后14和18 d表达趋势一致,且变化幅度较小;21和28 d表达趋势相反,其中,自然发情的空怀牛在21和28 d呈上调表达,而同期发情的空怀牛无明显变化。人工授精后第18天,自然发情妊娠牛外周血中ISG15的表达量显著高于空怀牛(P<0.05),其中,妊娠牛中ISG15基因平均上调3.99倍,空怀牛中ISG15基因平均下调1.68倍;对应的,同期发情奶牛在人工授精后第18天, 妊娠牛中ISG15基因平均上调3.87倍,空怀牛平均下调1.20倍,分析显示P值(P=0.076)与0.05接近,但仍不具备统计学上的显著性差异。OAS1基因在不同发情诱因下的表达变化和ISG15基因相似:人工授精后18 d,自然发情妊娠牛中OAS1基因的表达量显著高于空怀牛(P<0.05),而同期发情妊娠牛与空怀牛间外周血中其表达变化无显著性差异。人工授精后21 d,在两种不同发情诱因下,妊娠牛与空怀牛ISG15和OAS1基因的表达量虽然在统计学上差异没有达到显著水平,但是P值均与0.05相差不大(P值分别为0.098和0.090)。人工授精后14和28 d,妊娠牛与空怀牛ISG15和OAS1基因的表达量均差异不显著。

图2 不同发情诱因下ISG15和OAS1在奶牛外周血中的相对表达量Fig.2 Relative gene expressions of bovine ISG15 and OAS1 in peripheral blood at different estrus conditions
2.3ISG15和OAS1基因在奶牛外周血不同白细胞亚类中的表达
分析结果显示,人工授精后18和21 d,妊娠牛与空怀牛外周血淋巴细胞、NK细胞和单核细胞中ISG15基因的相对表达量差异不显著;而妊娠牛与空怀牛外周血液淋巴细胞中OAS1基因的相对表达量呈现显著性差异(P<0.05)(图3)。趋势上,人工授精后18和21 d妊娠牛外周血淋巴细胞、NK细胞和单核细胞中ISG15和OAS1基因呈持续上调表达;而空怀牛中ISG15和OAS1基因的相对表达量无明显的变化。其中,第18天妊娠牛外周血淋巴细胞中OAS1基因一致上调,平均上调2.14倍,空怀牛中一致下调,平均下调1.8倍;妊娠牛外周血淋巴细胞中ISG15基因平均上调3.39倍,空怀牛中平均上调1.20倍,但二者ISG15基因的表达量差异不显著。

图3 ISG15和OAS1在奶牛外周血白细胞亚类中的相对表达变化Fig.3 Relative gene expressions of bovine ISG15 and OAS1 in subpopulations of peripheral blood leukocytes
3 讨 论
外周血白细胞已被有效应用于挖掘人以及奶牛等动物特殊生理条件下的生物标志物研究,机体由于感染和/或激素内分泌,相关炎症和细胞因子等因素会导致体液物质发生改变,进而引起基因表达模式发生广泛、快速和复杂的变化[14-15]。因此,外周血白细胞的基因表达模式为发掘引起生理显著变化的生物标志物提供了有效手段[16]。本研究利用荧光定量PCR技术检测了中国荷斯坦奶牛妊娠早期阶段干扰素刺激基因ISG15和OAS1在外周血白细胞中的表达规律,结果表明:人工授精后18 d,妊娠牛外周血中ISG15和OAS1基因的相对表达量均显著高于空怀牛,与前人的研究结果基本一致[8,10-11]。据 J.C.Green等[8]报道,人工授精后18 d 奶牛外周血白细胞中OAS1基因上调表达1.4倍以上的均为妊娠牛,利用此方法进行妊娠诊断的准确性达100%。但是,本研究发现,虽然奶牛外周血白细胞中OAS1基因表达上调1.4倍以上的均为妊娠牛(人工授精后18 d),但部分妊娠牛只上调倍数低于1.4倍甚至下调表达,说明不同品种间存在一定的差异,并暗示在诊断中利用该基因的表达变化仍存在假阴性判断风险,实际生产管理中可能会造成很大的不必要损失。本研究揭示妊娠牛中ISG15基因一致上调,空怀牛个体ISG15基因一致下调,表明:ISG15基因的相对表达量在妊娠牛与空怀牛之间的临界点较OAS1基因更加明显。这为人们有针对性地在中国荷斯坦牛群中进行早期妊娠诊断提供了有价值的参考,但由于本试验样本的限制,通过外周血利用ISG15基因在人工授精后18天进行妊娠诊断的可靠性还需要进一步验证。
同期发情技术主要是通过利用外源激素处理,人为控制并调整奶牛在预定时间内的集中发情、排卵并施以配种、管理,据此可提高牛群的繁殖效率,因而被广泛应用于奶牛生产。但是,由于药物以及劳动成本的限制,该技术仅在特定的情况下,例如胚胎移植和奶牛乏情的状态下采用,实际生产中国内大部分奶牛场还是在自然发情的条件下实施人工授精。本研究通过进一步分析不同发情诱因条件下基因的表达变化揭示了一个比较有意思的现象:人工授精后18 d自然发情妊娠牛中ISG15和OAS1在外周血白细胞中的表达量均显著高于自然发情的空怀牛;同期发情状态下的妊娠牛与空怀牛外周血白细胞中ISG15和OAS1基因的表达量与自然发情状态下的表达趋势类似,尽管分析显示P值与0.05接近,但仍不具备统计学上的显著性差异。这可能与本试验中同期发情空怀牛头数较少并且动物个体间差异较大有关,具体机制如遗传、营养、个体状态(疾病)等尚有待深入研究;也可能与所采用的同期发情处理方法有关。已有研究表明,采用不同的同期发情处理方法,由于发情药物的种类、剂量和处理时间不同,会对排卵和妊娠率产生不同影响[17-18]。即使采用同样的同期发情处理方法和药物,对不同的品种或者品系也会产生不同的效果,因此,尽管试验牛在配种前都有明显的发情表现,而且血清中孕酮的含量都低于1 ng·mL-1,但是不同同期发情方法处理后胚胎生长发育可能存在差异,而胚胎的大小直接影响IFN-τ的分泌量[8]。据此,这也可能是本试验中干扰素刺激基因的表达变化与之前的相关报道略微存在差异的原因[8,10-11],但在某些情况下如果生硬套用国外的诊断标准,1倍以内的差别就有可能致使误判风险大大增加。
外周血白细胞由不同的细胞亚类组成,包括颗粒细胞、淋巴细胞,单核细胞等。研究发现,干扰素刺激基因在这些不同细胞亚类中的表达量存在差异[11]。奶牛妊娠识别阶段,外周血白细胞参与的先天免疫应答被激活,尤其是NK细胞、γδT细胞和调节性T细胞被募集至子宫内膜,促进母体免疫系统识别和接纳孕体[19]。NK细胞的数量与分布在早期妊娠阶段发生了显著的变化[20]。为了深入分析ISG15、OAS1在这些关键细胞亚类中的表达变化,本研究在前阶段分析基础之上进一步分离了人工授精后18和21 d外周血中的淋巴细胞、单核细胞和NK细胞。结果表明,妊娠牛淋巴细胞中OAS1基因在人工授精后18 d的相对表达量显著高于空怀牛,但是在单核细胞和NK细胞中无显著差异。IFN-τ信号通过JAK信号转导和转录激活通路(STAT1)发挥作用[21],STAT1磷酸化是I型干扰素(包括IFN-τ)刺激引起的细胞信号应答的关键步骤,I型干扰素刺激后淋巴细胞的磷酸化程度显著上升[22],这也可能是导致淋巴细胞中OAS1基因相对表达量差异显著的原因,为进一步揭示OAS1基因于早期妊娠识别阶段的作用机制指明了方向。
人工授精后18 d,尽管妊娠牛外周血淋巴细胞中OAS1相对于空怀牛的表达量呈显著差异,但是差异程度(倍数)不如在总白细胞中明显,而从妊娠诊断方法学上来看,细胞亚类的分离无疑增加了妊娠诊断的繁琐程度。K.Kizaki等[23]通过对妊娠牛外周血白细胞、中性粒细胞、淋巴细胞、单核细胞检测后发现,人工授精后14 dISG15和OAS1基因在中性粒细胞中的表达量显著高于其它亚类,提示:中性粒细胞可能对包括IFN-τ在内的妊娠识别信号反应比较敏感;但同时该研究表明,人工授精后14 d空怀牛外周血中性粒细胞中ISG15和OAS1基因也呈上调表达趋势,因此,授精后14 d利用这两个基因在中性粒细胞中的表达进行妊娠诊断的准确性尚存在很大疑问;同时细胞分离步骤会增加检测的繁琐程度,可能会对干扰素刺激基因表达量检测的准确性造成影响,增加误判机率。针对这一问题,本研究结果提示,ISG15基因在外周血中(总白细胞中)的表达水平可望能够对自然发情的奶牛较为准确地做出诊断,即人工授精后18 d,上调1倍(相对于0 d)以上为妊娠牛,下调为空怀牛。下一步需要扩大群体样本规模进一步验证,并通过优化基因表达阈值来提高判断的准确性。多个干扰素刺激基因(目前发现至少有ISG15和OAS1)可能在不同的免疫细胞中通过相同或不同的机制共同影响母体妊娠识别(母体-孕体互作)。暂且不考虑其中复杂的分子信号,单从方法学上讲:也可以综合利用多基因,通过特异性基因扩增引物设计实现ISG15和OAS1在定量PCR中的双通道同时检测来增加奶牛早期妊娠诊断的可靠性和准确性。
4 结 论
中国荷斯坦奶牛人工授精后18 d,妊娠牛外周血中ISG15、OAS1基因的相对表达量均显著高于空怀牛,但ISG15基因的表达量在妊娠牛与空怀牛之间的差异更明显;自然发情状态下,妊娠牛与空怀牛外周血白细胞ISG15、OAS1基因的差异表达程度比同期发情状态下明显;利用ISG15基因在外周血中(总白细胞中)的表达水平可望能够对自然发情奶牛做出较为准确的妊娠诊断,但在此基础上的相关判别标准还可以进一步优化;另外,ISG15和OAS1基因在免疫细胞亚类中的相关研究为深入探讨它们在奶牛早期妊娠识别阶段作用的分子机制奠定了基础。
[1] NAKAO T,SUGIHASHI A,KAWATA K,et al.Milk progesterone levels in cows with normal or prolonged estrous cycles,referenced to an early pregnancy diagnosis[J].JpnJVetSci,1983,45:495-499.
[2] MORTON J M,WYNN P C.Assessing ovulation detection performance in commercial dairy herds using progesterone concentrations from limited numbers of strategically collected milk samples[J].JDairySci,2010,93:3019-3030.
[3] ZOLI A P,GUIBAULT L A,DELAHAUT P,et al.Radioimmunoassay of a bovine pregnancy-associated glycoprotein in serum:its application for pregnancy diagnosis[J].BiolReprod,1992,46:83-92.
[4] FRICKE P M.Scanning the future - ultrasonography as a reproductive management tool for dairy cattle[J].JDairySci,2002,85:1918-1926.
[5] LUCY M C,MCDOUGALL S,NATION D P.The use of hormonal treatments to improve the reproductive performance of lactating dairy cows in feedlot or pasture-based management systems[J].AnimReprodSci,2004,82-83:495-512.
[6] SPENCER T E,BAZER F W.Conceptus signals for establishment and maintenance of pregnancy[J].ReprodBiolEndocrinol,2004,2:49-63.
[7] BOTT R C,ASHLEY R L,HENKES L E,et al.Uterine vein infusion of interferon tau(IFNT) extends luteal life span in ewes[J].BiolReprod,2010,82(4):725-735.
[8] GREEN J C,OKAMURA C S,POOCK S E,et al.Measurement of interferontau(IFN-tau) stimulated gene expression in blood leukocytes for pregnancy diagnosis within 18-20 d after insemination in dairy cattle[J].AnimReprodSci,2010,121:24-33.
[9] OLIVEIRA J F,HENKES L E,ASHLEY R L,et al.Expression of interferon(IFN)-stimulated genes in extrauterine tissues during early pregnancy in sheep is the consequence of endocrine IFN-tau release from the uterine vein[J].Endocrinology,2008,149(3):1252-1259.
[10] GIFFORD C A,RACICOT K,CLARK D S,et al.Regulation of interferon-stimulated genes in peripheral blood leukocytes in pregnant and bred,Nonpregnant dairy cows[J].JDairySci,2007,90:274-280.
[11] HAN H,AUSTIN K J,REMPEL L A,et al.Low blood ISG15 mRNA and progesterone levels are predictive of non-pregnant dairy cows[J].JEndocrinol,2006,191:505-512.
[12] 谢胜松,李新云,苏立杰,等.一种简易快速鉴定动物组织总RNA质量的方法[J].农业生物技术学报,2009,2:282-287. XIE S S,LI X Y ,SU L J,et al.A facile,rapid and effective method for RNA quality determination[J].JournalofAgriculturalBiotechnology,2009,2:282-287.(in Chinese)
[13] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J].Methods,2001,25:402-408.
[14] BURTON J L,MADSEN S A,CHANG L C,et al.Gene expression signatures in neutrophils exposed to glucocorticoids:a new paradigm to help explain “neutrophil dysfunction” in parturient dairy cows[J].VetImmunolImmunopath,2005,105:197-219.
[15] SUKUMARAN B,CARLYON J A,CAI J L,et al.Early transcriptional response of human neutrophils to Anaplasma phagocytophilum infection[J].InfectImmun,2005,73:8089-8099.
[16] OTT T L,GIFFORD C A.Effects of early conceptus signals on circulating immune cells:lessons from domestic ruminants[J].AmJReprodImmunol,2010,64:245-254.
[17] BUSCH D C,WILSON D J,SCHAFER D J,et al.Comparison of progestin-based estrus synchronization protocols before fixed-time artificial insemination on pregnancy rate in beef heifers[J].JAnimSci,2007,85:1933-1939.
[18] COLAZO M G,KASTELIC J P,SMALL J A,et al.Resynchronization of estrus in beef cattle:Ovarian function,estrus and fertility following progestin treatment and treatments to synchronize ovarian follicular development and estrus[J].CanVetJ,2007;48:49-56.
[19] OTT T L,GIFFORD C A.Effects of early conceptus signals on circulating immune cells:lessons from domestic ruminants[J].AmJReprodImmunol,2010,64(4):245-54.
[20] OLIVEIRA L J,MANSOURRI-ATTIA N,FAHEY A G,et al.Characterization of the profile of the bovine endometrium during the oestrous cycle and early pregnancy[J].PLoSONE,2013,8(10):e75571.
[21] SAMUEL C E.Antiviral actions of interferons[J].ClinMicrobiolRev,2001,14:778-809.
[22] TOCHIZAWA S,OHMOTO Y,MORI T.A novel modification of a flow cytometric assay of phosphorylated STAT1 in whole blood lymphocytes for rapid detection of interferon-alpha signalinvivo[J].JImmunolMethods,2006,313:29-37.
[23] KIZAKI K,SHICHIJO-KIZAKI A,FURUSAWA T,et al.Differential neutrophil gene expression in early bovine pregnancy[J].ReprodBiolEndocrinol,2013,11:6.
(编辑 程金华)
Study onISG15 andOAS1 Transcriptions in Peripheral Blood of Dairy Cows during Early Pregnancy
CHENG Lei*,WANG Ding-fa,LIU Xiao-hua,XIANG Min,LING Ming-hu,HU Xiu-zhong,XIA Yu
(InstituteofAnimalScienceandVeterinaryMedicine,WuhanAcademyofAgriculturalSciences,Wuhan430208,China)
This study aimed to investigate mRNA transcriptions of interferon stimulated genesISG15 andOAS1 in the peripheral blood of Chinese Holstein dairy cows during early pregnancy,by which we hope to provide an insight into their applications in bovine early pregnancy diagnosis.A total of 27 heifers following spontaneous estrus(n=10) or oestrus synchronisation(n=17) were used for the study.Peripheral blood were collected at 0,14,18,21 and 28 d post artificial insemination(AI);subsets of peripheral blood leukocytes(lymphocyte,monocyte,and natural killer cell) were isolated at 0,18 and 21 d;Real-time PCR was employed to detect the relative mRNA transcriptions ofISG15 andOAS1 in the whole white blood cells(WBC) and/or the leukocyte subpopulations.The results showed that bovineISG15 andOAS1 in the peripheral blood of pregnant cows were significantly elevated versus non-pregnant cows at 18 d(P<0.05);On 18 d post AI,ISG15 was up-regulated in pregnant cows with the average fold change(FC) of 3.92,whereas it was down-regulated in non-pregnant cows with the average FC of 1.46;OAS1 was similarly up-regulated(FC=3.49) in pregnant cows and down-regulated(FC=1.28) in non-pregnant cows.The relative transcriptions ofISG15 andOAS1 in pregnant cows following spontaneous estrus were significantly higher than those in non-pregnant cows at 18 d post AI;although the tendency in cows following oestrus synchronisation was the same,the difference was not statistically significant.Further analysis in the subpopulations of leukocytes showed thatOAS1 in lymphocytes of pregnant cows was significantly elevated(+2.14),whereas depressed in non-pregnant cows (-1.80) at 18 d post AI(P<0.05).The results indicated that regulations ofISG15 in peripheral blood of pregnant cows were more obvious thanOAS1 at 18 d after AI;differential expressions ofISG15 andOAS1 between pregnant cows and non-pregnant cows were more obvious in cows following spontaneous estrus.In conclusion,ISG15 transcriptions in peripheral WBC could be a better indicator for bovine early pregnancy diagnosis(18 d post AI),especially in cows following spontaneous estrus.Gene expression analysis of bovineISG15 andOAS1 in the leukocyte subsets has provided additional insight into their roles during early maternal recognition of pregnancy.
dairy cows;ISG15;OAS1;pregnancy diagnosis;gene expression
10.11843/j.issn.0366-6964.2015.01.010
2014-07-11
武汉市农科院人才发展专项基金(CX201240);武汉市农科院青年英才计划项目(YC201201)
程 蕾(1983-),女,湖北天门人,畜牧师,硕士,主要从事动物遗传育种与繁殖研究
*通信作者:程 蕾,E-mail:chenglei_011@126.com
S823.9+1.2
A
0366-6964(2015)01-0077-08

