人参茎叶多糖对雏鸡小肠黏膜组织发育和免疫细胞的影响
闫晓刚,张芳毓,郎洪彦,金香淑,赵中利,刘 臣
(吉林省农业科学院畜牧科学分院,公主岭 136100)
人参茎叶多糖对雏鸡小肠黏膜组织发育和免疫细胞的影响
闫晓刚,张芳毓,郎洪彦,金香淑,赵中利,刘 臣*
(吉林省农业科学院畜牧科学分院,公主岭 136100)
为研究人参茎叶多糖(GSLP)对雏鸡小肠黏膜组织发育和免疫细胞的影响,选择600只体重相近(52.79±4.58 g)的7 日龄健康海兰褐雏鸡,随机分为10个处理,每个处理60 只(3个重复,每个重复20只),分为正常饲喂组和免疫抑制组,各包括5个处理,GSLP 添加量分别为0、0.2、0.4、0.8 和1.6 g·kg-1,试验期35 d。饲养期结束后,每个处理中随机选择9 只雏鸡(每个重复3只),采集空肠和回肠样品。结果显示:(1)GSLP提高了空肠绒毛宽度和表面积(P<0.01),0.8 g·kg-1GSLP 降低空肠绒毛高度和隐窝深度(P<0.05),0.8和1.6 g·kg-1GSLP降低回肠绒毛高度和隐窝深度(P<0.01),GSLP 对绒腺比无显著影响;(2)空肠绒毛高度(P<0.05)和黏膜厚度(P<0.01)以及回肠绒毛高度(P<0.05)中存在GSLP与免疫状态之间的交互作用;(3)0.4、0.8 和1.6 g·kg-1GSLP 增加空肠CD3+阳性细胞的面积(P<0.05),1.6 g·kg-1GSLP提高空肠肥大细胞的数量(P<0.05),GSLP对免疫细胞的作用存在剂量效应。结果表明,GSLP 对小肠黏膜发育具有一定的促进作用,但对养分吸收机能并无显著影响;0.4~1.6 g·kg-1GSLP 提高空肠的黏膜免疫水平;GSLP对环磷酰胺前期抑制的空肠绒毛高度和黏膜厚度的发育具有改善作用。
人参茎叶多糖;蛋雏鸡;小肠黏膜发育;免疫细胞
动物肠道既是养分消化吸收的主要场所,也是机体免疫系统的重要组成部分。完整和健康的肠道黏膜上皮结构和肠道微生物是抵御病原体入侵的结构屏障;肠道黏膜固有层内的T 淋巴细胞、B 淋巴细胞、杯状细胞、巨噬细胞和肥大细胞(mast cell,MC)等免疫细胞及其分泌的免疫介质构成了肠道的免疫屏障[1-2]。
植物活性多糖对肠道黏膜发育和机体免疫机能具有广泛的影响。有研究表明,黄芪多糖可以增加艾维茵肉仔鸡小肠绒毛高度和宽度、黏膜厚度、绒腺比和绒毛表面积[3]。淫羊藿多糖和芦荟多糖对小鼠T淋巴细胞具有有丝分裂原样作用,能促进T、B 淋巴细胞的增殖,提高机体细胞免疫功能[4-5]。人参多糖对大鼠肠道黏膜淋巴细胞功能具有调节作用,增加大鼠肠道派伊尔节淋巴细胞干扰素-γ(IFN-γ)的分泌水平[6-7]。人参茎叶是人参加工产业的副产品,水溶性多糖成分约占干重的10%以上,化学成分和药理作用与人参根须基本相同,但是目前其开发和利用并未受到足够的重视。
幼龄动物肠道健康状况对全期生产性能表现具有重要的影响。因此,本项研究以正常和环磷酰胺诱导免疫抑制海兰褐蛋雏鸡为试验动物,观察人参茎叶多糖(Ginseng stem and leaf polysaccharide,GSLP)对不同免疫水平雏鸡肠道黏膜组织发育和免疫细胞的影响,明确其对肠道黏膜发育和免疫的调节效果,从而为GSLP 在畜牧生产中的合理应用提供参考。
1 材料与方法
1.1 试验材料和试验动物
GSLP 购买于吉林省宏久生物科技股份有限公司,前期分析结果表明其多糖含量为24.4%,单糖组成为葡萄糖(48.8%)、半乳糖(15.6%)、甘露糖(12.4%)、阿拉伯糖(10.2%)、鼠李糖(7.7%)、半乳糖醛酸(3.1%)和木糖(2.2%)。
采用随机化完全区组试验设计,600只7日龄海兰褐蛋雏鸡随机分为10个处理,每个处理60只(3个重复,每个重复20只),分为正常饲喂组和免疫抑制组,各包括5个处理。参考李相玲等研究结果[8],试验期免疫抑制组雏鸡按体重灌服100 mg·kg-1环磷酰胺,正常饲喂组灌服等量生理盐水,连续7 d。正常饲喂组和免疫抑制组基础日粮中GSLP 添加量分别为0、0.2、0.4、0.8和1.6 g·kg-1。
1.2 试验日粮
根据中国鸡饲养标准(2004)生长蛋鸡0~8周龄营养需要配制试验日粮。试验日粮组成及营养水平见表1。
1.3 饲养管理
试验雏鸡每天7:00饲喂1次,自由采食和饮水,采用常规免疫程序进行免疫。
1.4 样品采集和分析
1.4.1 肠道组织 饲养期结束后,于早饲前分别从每个处理中随机选择9只雏鸡(每个重复3只)屠宰,采集空肠和回肠样品,根据待测指标的要求分别进行标记和保存。
1.4.2 小肠黏膜组织形态 试验鸡空肠和回肠的前1/3处取2 cm肠段,用生理盐水冲洗干净并及时置于4%中性甲醛溶液固定。常规制备石蜡切片,厚度为6 μm。
小肠绒毛组织形态结构采用苏木素-伊红(H.E.)染色,使用Leika 专用显微镜进行观察。利用Leika Application Suite 照相处理软件和图像分析系统测量空肠和回肠绒毛高度、隐窝深度和黏膜厚度。每个肠段取4张切片,每个切片选取3个最长肠绒毛的高度及其相应隐窝深度、绒毛宽度和肌层厚度进行测量,取其平均值作为测定结果。绒腺比
表1 试验日粮组成(风干基础)和营养水平(干物质基础)
Table 1 Ingredient composition (air-dry basis) and nutrient levels (DM basis) of trial diet
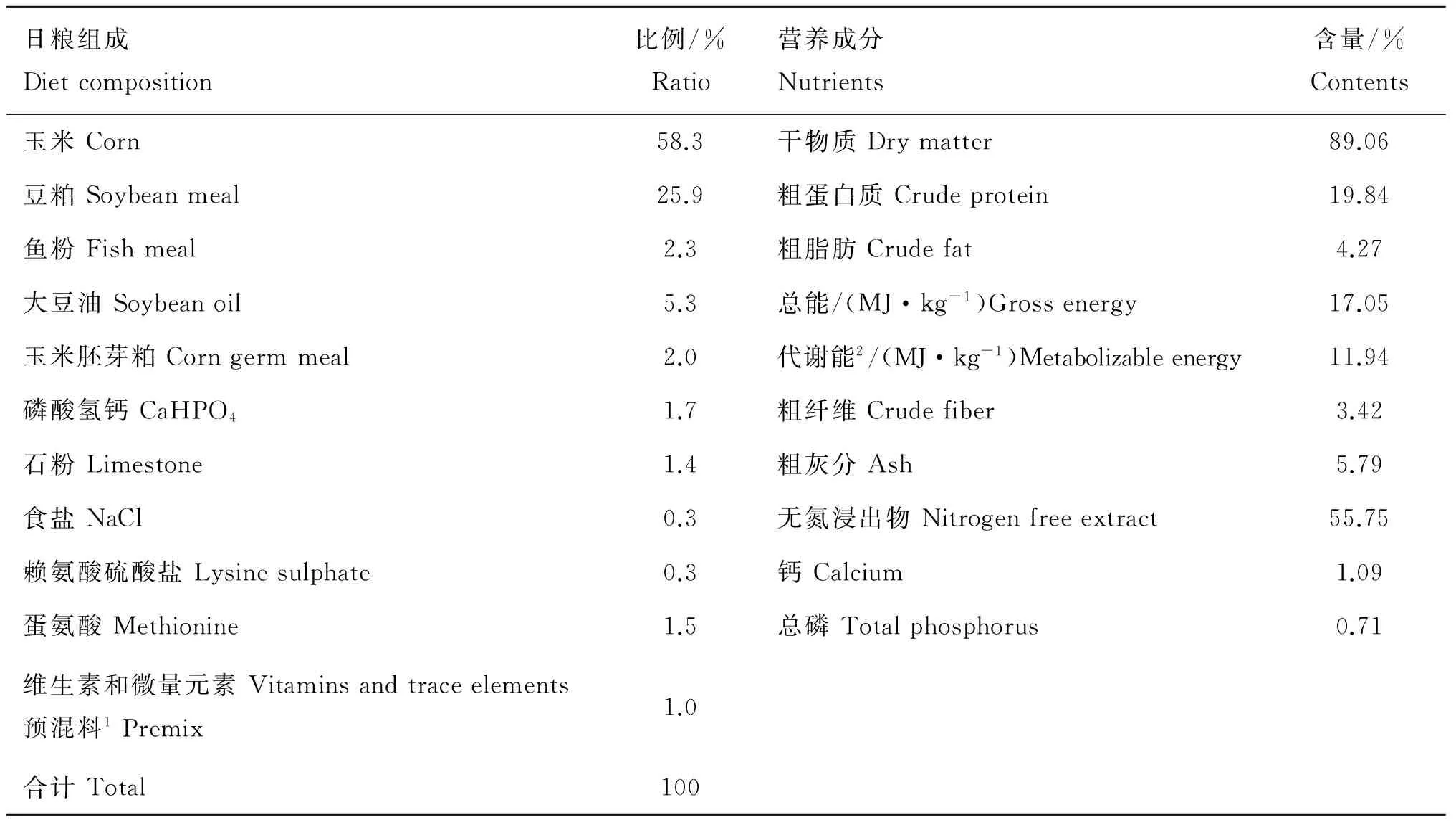
日粮组成Dietcomposition比例/%Ratio营养成分Nutrients含量/%Contents玉米Corn58.3干物质Drymatter89.06豆粕Soybeanmeal25.9粗蛋白质Crudeprotein19.84鱼粉Fishmeal2.3粗脂肪Crudefat4.27大豆油Soybeanoil5.3总能/(MJ·kg-1)Grossenergy17.05玉米胚芽粕Corngermmeal2.0代谢能2/(MJ·kg-1)Metabolizableenergy11.94磷酸氢钙CaHPO41.7粗纤维Crudefiber3.42石粉Limestone1.4粗灰分Ash5.79食盐NaCl0.3无氮浸出物Nitrogenfreeextract55.75赖氨酸硫酸盐Lysinesulphate0.3钙Calcium1.09蛋氨酸Methionine1.5总磷Totalphosphorus0.71维生素和微量元素Vitaminsandtraceelements预混料1Premix1.0合计Total100
1.每千克预混料含维生素和微量元素:VA 500 kIU、VD3100 kIU、VE 1 000 IU、VK350 mg、 VB1180 mg、VB2360 mg、VB6350 mg、VB121 mg、烟酸 3 500 mg、泛酸 1 000 mg、叶酸 55 mg、生物素 15 mg、氯化胆碱 55 g、CuSO4·5H2O 3.0 g、FeSO4·H2O 25.0 g、ZnSO4·H2O 16.5 g、MnSO4·H2O 24 g、1%碘酸钙 5.5 g、1% 亚硒酸钠 3.3 g、1% 氯化钴 0.4 g、NaHCO350 g。2.代谢能为计算值,其余为实测值和绒毛表面积计算公式如下:
1.Vitamins and microelements per kg of premix:VA 500 kIU,VD3100 kIU,VE 1 000 IU,VK350 mg,VB1180 mg,VB2360 mg,VB6350 mg,VB121 mg,Nicotinic acid 3 500 mg,Pantothenic acid 1 000 mg,Folic acid 55 mg,Biotin 15 mg,Choline chloride 55 g,CuSO4·5H2O 3.0 g,FeSO4·H2O 25.0 g,ZnSO4·H2O 16.5 g,MnSO4·H2O 24 g,1% Ca(IO3)25.5 g,1% Na2SeO33.3 g,1% CoCl20.4 g,NaHCO350 g.2.ME was a calculated value and others were measured values
绒腺比=绒毛高度/隐窝深度
绒毛表面积=2πrh,其中,r:小肠绒毛宽的1/2;h:小肠绒毛高度。1.4.3 小肠上皮内淋巴细胞(iIEL)数量 将上述用于观察小肠黏膜组织形态的空肠和回肠组织切片进行iIEL计数,方法为计数每100个上皮细胞内的淋巴细胞数量,每个样品观察5个视野,取其平均值,并按处理求平均值。
1.4.4 空肠黏膜CD3+阳性细胞面积 空肠黏膜CD3+阳性细胞面积采用免疫组织化学法(IHC)进行测定,试验过程按照鼠Streptavidin-HRP试剂盒(北京天恩泽生物技术有限公司)说明书操作。内源性过氧化物酶封闭10 min,蛋白质非特异结合位点封闭10 min,一抗(鼠抗鸡)工作液孵育60 min,二抗(羊抗鼠IgG-Biotin)工作液孵育10 min,Streptavidin-HRP工作液孵育10 min,二氨基联苯胺(DAB)显色(20×,北京天恩泽生物技术有限公司),苏木素复染,乙醇梯度脱水透明,中性树脂封片。利用Leika Application Suite 照相处理软件和图像系统分析。每个处理选取5 张切片,每张切片选取10个视野统计。
1.4.5 空肠上皮内杯状细胞数量 采取空肠卵黄蒂处左右各约1 cm长的肠段,用生理盐水冲洗干净并及时置于4%中性甲醛溶液固定24 h,常规制备石蜡切片,高碘酸-西夫(PAS)染色。利用Leika 专用显微镜对上述空肠组织切片进行杯状细胞计数,每个肠段取5根完整肠绒毛(400倍),在肠绒毛上皮层,从肠绒毛的顶部依次向下计数100个柱状细胞,同时计数其中的杯状细胞数量,取平均值,并按处理求平均值。
1.4.6 空肠上皮内MC 数量 采用甲苯胺蓝染色法观察空肠上皮内MC数量,使用Leika专用显微镜计数,计数方法为将位于2个邻近肠腺之间的肠绒毛划为1个肠绒毛单位,计算10个完整肠绒毛单位固有层中的细胞数目,并求出每个绒毛单位的平均细胞数。
1.5 统计分析
采用SAS 9.2 Mixed程序进行数据统计分析,小肠黏膜组织形态和免疫细胞方差分析模型:
其中,Yijk为自变量ijk观测值;μ为总平均效应;ρi为GSLPi水平的效应;αj为环磷酰胺j水平的效应;(ρα)k为GSLPi水平与环磷酰胺j水平组合条件下的交互作用的效应;eijk为ijk的随机误差分量。
采用SAS 9.2 PROC CCORR程序分析GSLP添加剂与小肠黏膜组织形态和免疫细胞的相关性。不同处理间的显著性检验利用Turkey-Kramer程序进行多重比较,以P<0.01 为差异极显著,P<0.05 为差异显著;以P<0.10 为相关性显著。
2 结 果
2.1 小肠黏膜组织发育
与对照组相比,GSLP显著提高了空肠绒毛宽度和绒毛表面积(P<0.01),0.2和1.6 g·kg-1GSLP显著提高回肠绒毛宽度(P<0.05);但是0.8 g·kg-1GSLP显著降低雏鸡空肠绒毛高度和隐窝深度(P<0.05),并且0.2、0.8和1.6 g·kg-1GSLP极显著降低回肠绒毛高度(P<0.01),0.8和1.6 g·kg-1GSLP极显著降低回肠隐窝深度(P<0.01)。
不同添加剂量GSLP对小肠绒毛发育表现出了不同的作用效果,0.8 g·kg-1处理组空肠绒毛高度显著低于0.4 g·kg-1处理组(P<0.05),0.2 g·kg-1处理组回肠隐窝深度极显著高于1.6 g·kg-1处理组(P<0.01),0.4 g·kg-1处理组极显著高于0.8 和1.6 g·kg-1处理组(P<0.01),0.4 g·kg-1处理组回肠黏膜厚度显著高于1.6 g·kg-1处理组(P<0.05)。
免疫抑制处理组空肠绒腺比显著高于正常饲喂组(P<0.05),而回肠绒毛高度和隐窝深度则极显著低于正常饲喂组(P<0.01)。小肠绒毛完整性各处理间未观察到显著差异。空肠绒毛高度(P<0.05)和黏膜厚度(P<0.01)以及回肠绒毛高度(P<0.05)中观察到GSLP 添加水平与雏鸡免疫状态之间存在交互作用(表2,图1~2)。
2.2 小肠黏膜免疫细胞
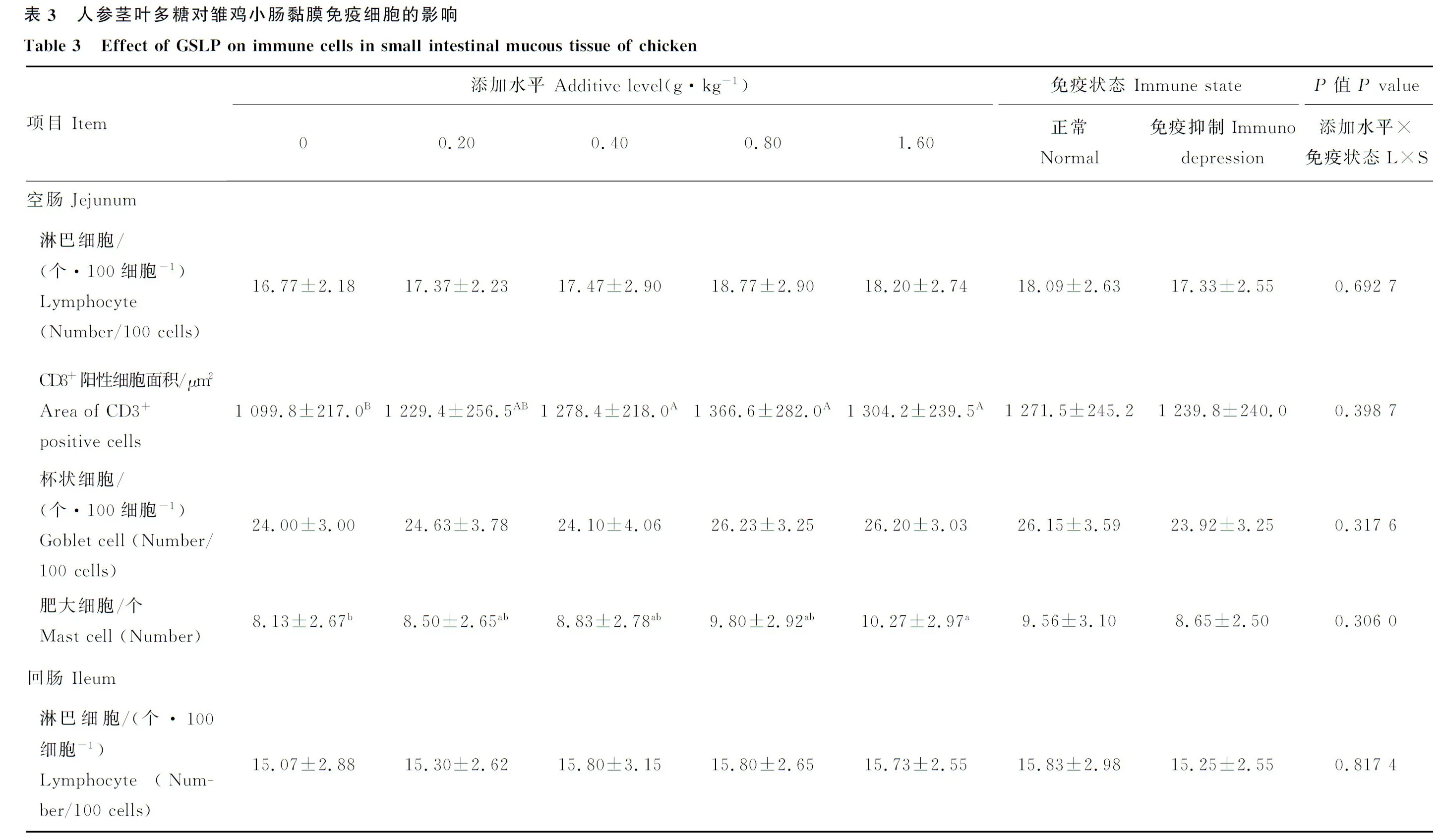
0.4、0.8和1.6 g·kg-1GSLP 处理组空肠CD3+阳性细胞面积以及1.6 g·kg-1GSLP处理组MC数量显著高于对照组(P<0.05)(表3)。空肠iIEL 数量(R2=0.905 8)、CD3+阳性细胞面积(R2=0.983 4)和MC数量(R2=0.984 5)以及回肠iIEL 数量(R2=0.887 6)随GSLP 添加水平增加均呈现出二次曲线变化趋势(表3,图3~7)。
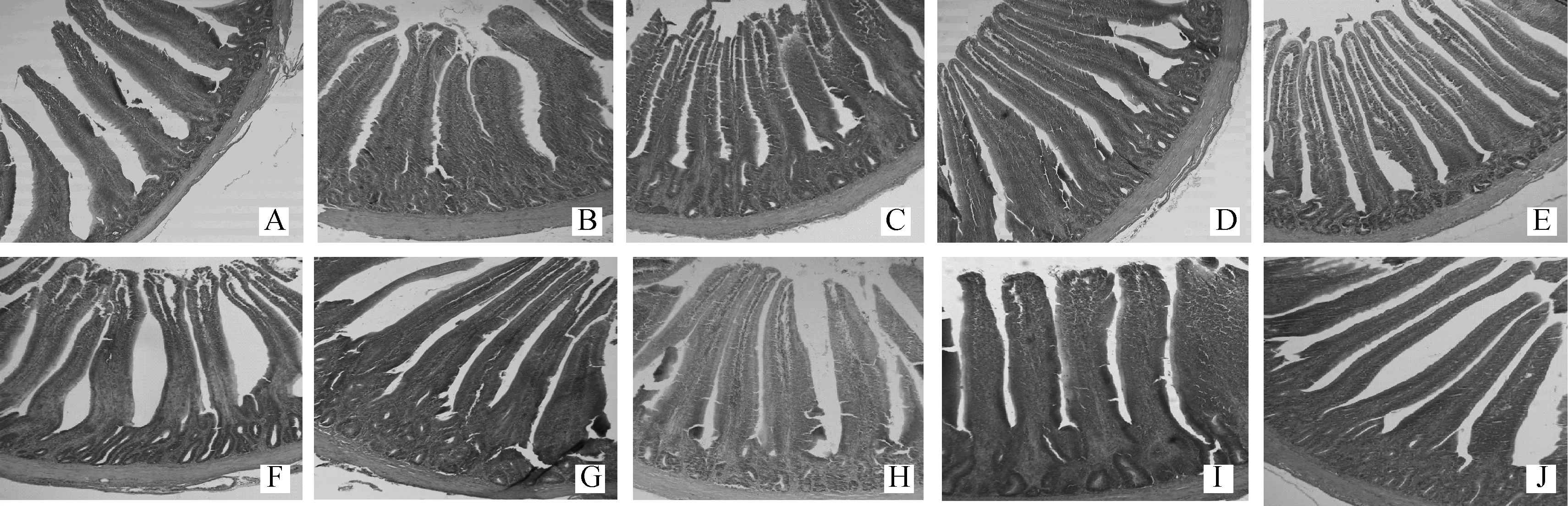
A~E.正常饲喂组,GSLP添加量依次为0、0.2、0.4、0.8、1.6 g·kg-1;F~J.免疫抑制组,GSLP 添加量依次为0、0.2、0.4、0.8、1.6 g·kg-1,下图同A-E.Normal feeding treatment,additive levels of GSLP,in sequence,are 0,0.2,0.4,0.8,1.6 g·kg-1;F-J.Immuno depression treatment,additive levels of GSLP,in sequence,are 0,0.2,0.4,0.8,1.6 g·kg-1.The same as bellow图1 GSLP 对42 日龄雏鸡空肠绒毛形态的影响(HE 染色)Fig.1 Effect of GSLP on jejunum morphology of 42 days chicken (HE staining)

正常饲喂和免疫抑制处理组之间免疫细胞数量差异并不显著,并且各项指标中未发现GSLP 添加水平与雏鸡免疫状态之间的交互作用。
2.3 相关性分析
空肠绒毛宽度(P<0.01)、黏膜厚度(P<0.05)、绒腺比(P<0.10)、绒毛表面积(P<0.01)和回肠绒毛宽度(P<0.05),空肠iIEL(P<0.05)、CD3+阳性细胞面积(P<0.01)、杯状细胞(P<0.01)和MC 数量(P<0.01)与GSLP 呈正相关关系;空肠隐窝深度(P<0.10)、回肠绒毛高度(P<0.05)和隐窝深度(P<0.01)与GSLP 呈负相关关系(表4)。
表4 GSLP 与雏鸡小肠黏膜组织发育和免疫细胞的相关性分析
Table 4 Correlation analysis between GSLP with small intestinal mucous development and immune cells of chicken

项目Item人参茎叶多糖GSLPP值 Pvalue空肠Jejunum绒毛高度/μmVillusheight0.01000.9256绒毛宽度/μmVilluswidth0.4058<0.0001隐窝深度/μmRecessdepth-0.18890.0746黏膜厚度/μmMucousthickness0.22570.0325绒腺比Villustoglandratio0.20010.0587绒毛表面积/μm2Villussurfacearea0.37980.0002回肠Ileum绒毛高度/μmVillusheight-0.23260.0274绒毛宽度/μmVilluswidth0.24350.0208隐窝深度/μmRecessdepth-0.37450.0003黏膜厚度/μmMucousthickness0.00980.9267绒腺比Villustoglandratio0.14090.1852绒毛表面积/μm2Villussurfacearea0.02840.7902空肠Jejunum淋巴细胞/(个·100细胞-1)Lymphocyte(Number/100cells)0.19800.0152CD3+阳性细胞面积/μm2AreaofCD3+positivecells0.31040.0001杯状细胞/(个·100细胞-1)Gobletcell(Number/100cells)0.22930.0048肥大细胞/个Mastcell(Number)0.29030.0003回肠Ileum淋巴细胞/(个·100细胞-1)Lymphocyte(Number/100cells)0.09900.2280

图2 GSLP 对42 日龄雏鸡回肠绒毛形态的影响(HE 染色)Fig.2 Effect of GSLP on ileum morphology of 42 days chicken (HE staining)

图3 GSLP 对42 日龄雏鸡空肠上皮淋巴细胞的影响(HE 染色,400×)Fig.3 Effect of GSLP on jejunum epithelium lymphocyte of 42 days chicken (HE staining,400×)
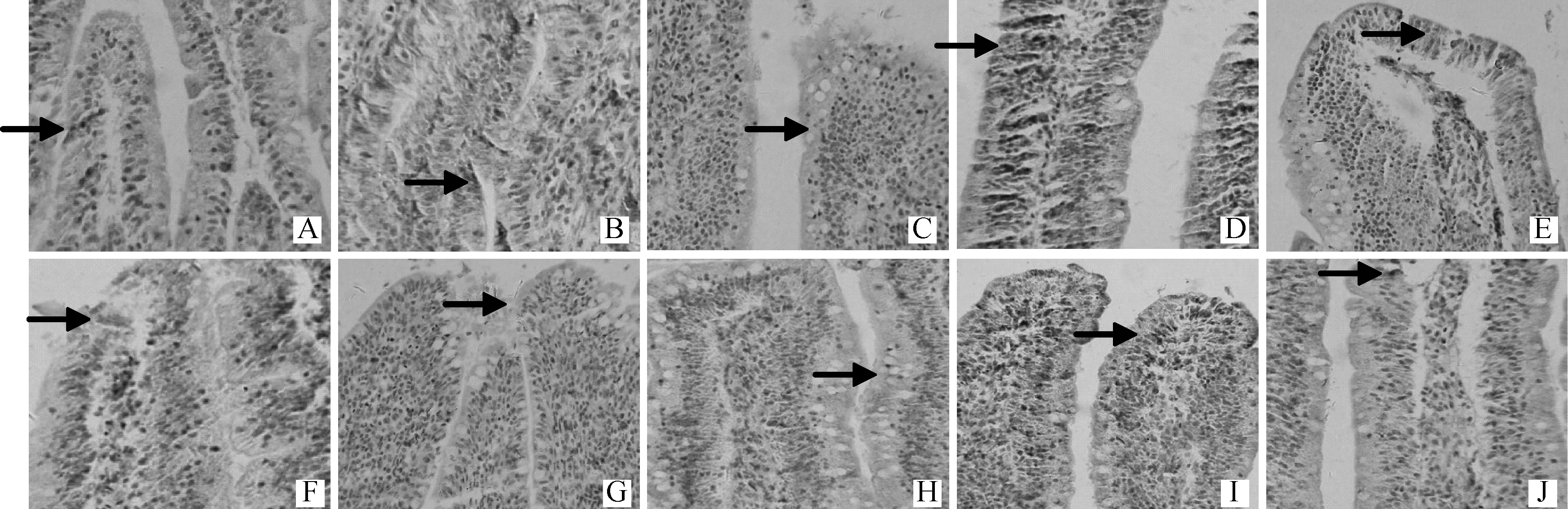
图4 GSLP 对42 日龄雏鸡空肠CD3+ 阳性细胞面积的影响(IHC,200×)Fig.4 Effect of GSLP on jejunum CD3+ positive cell area of 42 days chicken (IHC,200×)

图5 GSLP 对42 日龄雏鸡空肠上皮杯状细胞的影响(PAS 染色,400×)Fig.5 Effect of GSLP on jejunum epithelium goblet cell of 42 days chicken (PAS staining,400×)
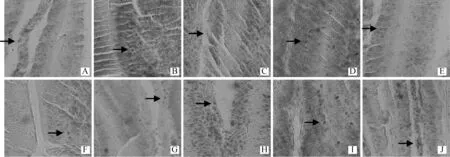
图6 GSLP 对42 日龄雏鸡空肠上皮肥大细胞的影响(甲苯胺蓝染色,400×)Fig.6 Effect of GSLP on jejunum epithelium mast cell of 42 days chicken (Toluidine blue staining,400×)
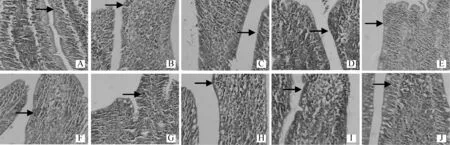
图7 GSLP 对42 日龄雏鸡回肠上皮淋巴细胞的影响(HE 染色,400×)Fig.7 Effect of GSLP on ileum epithelium lymphocyte of 42 days chicken (HE staining,400×)
3 讨 论
3.1 小肠黏膜组织发育
小肠黏膜组织形态和结构的完整性是保证饲养养分消化吸收和肠道黏膜免疫功能正常的基础[9]。小肠绒毛表面积增加会提高饲料养分的吸收率,而绒腺比则反映了小肠的机能状况,比值增加代表吸收机能的改善[10-11]。隐窝深度减小表明肠黏膜上皮细胞成熟率增加,其分泌功能相应增强[12]。本试验中,GSLP通过增加空肠绒毛宽度和绒毛表面积,具有提高空肠吸收饲料养分的能力;并且低添加量(0.2 g·kg-1)和高添加量(1.6 g·kg-1)GSLP对回肠绒毛宽度的发育也表现出了积极的促进作用。另外,不同GSLP 添加量对小肠绒毛高度和隐窝深度的作用效果并不一致。总体而言,高添加量(≥0.8 g·kg-1)GSLP在降低空肠和回肠隐窝深度,提高小肠黏膜腺体分泌机能的同时,对绒毛高度和黏膜厚度的发育具有负面作用。
空肠是饲料养分吸收的主要场所,随着肠段的后移,肠绒毛逐渐变小,吸收和分泌功能逐渐减弱。GSLP中大部分多糖在空肠被吸收,其对肠道发育的有益作用表现为增加了空肠绒毛的宽度和表面积,这一结果与黄芪多糖对肉仔鸡空肠绒毛发育的作用效果一致[3]。饲料黏度过高引起肠道渗透压升高,导致绒毛分泌细胞增加,吸收细胞减少[13]。GSLP对回肠绒毛的发育存在剂量效应,可能与GSLP促绒毛发育作用和GSLP 中可溶性非淀粉多糖黏性负面作用的动态平衡有关。0.2 g·kg-1GSLP处理组黏性相对较低,空肠未消化多糖对绒毛发育表现出良好的促进作用;而1.6 g·kg-1GSLP黏性相对较高,导致空肠未消化多糖的比例增加,从而弥补了多糖黏性对回肠绒毛发育的不利影响。
高添加量GSLP 对隐窝深度、绒毛高度和黏膜厚度的影响同样与其中可溶性非淀粉多糖(如半乳聚糖和甘露聚糖等)的黏性有关。GSLP 导致的黏性增加引起小肠渗透压升高,相应增加的分泌细胞和减少的吸收细胞则意味着隐窝深度减小,分泌机能增强以及绒毛高度和绒毛厚度的降低[10,12]。虽然不同添加量GSLP 对小肠绒毛各项发育指标具有不同的作用效果,但是各处理间绒腺比差异并不显著,表明GSLP 对雏鸡小肠整体养分吸收机能并无明显的影响。
试验前期灌服环磷酰胺对雏鸡小肠组织的发育产生了后续的影响,抑制了试验后期小肠绒毛的生长发育,但是却促进了小肠黏膜上皮细胞的成熟,提高了腺体的分泌能力和消化机能。环磷酰胺诱发的免疫抑制可以提高胰岛素水平,增加机体的合成代谢[14]。但是环磷酰胺的半衰期很短,通常为4~6 h,7 日龄连续灌服1周环磷酰胺对42日龄雏鸡小肠分泌机能的影响是否和环磷酰胺提高机体合成代谢的作用有关,目前尚缺乏直接证据。
人参多糖可以对抗环磷酰胺所致的免疫抑制,促进机体免疫功能的恢复[15]。本研究中观察到的交互作用表明GSLP对环磷酰胺所抑制的空肠绒毛高度和黏膜厚度的发育同样具有改善作用。但是对于回肠绒毛高度,只有当GSLP的添加剂量较高(1.6 g·kg-1)时才产生作用效果,这可能与不同肠段的消化吸收机能有关,空肠是养分的主要吸收场所,GSLP 中多糖大部分在空肠中被吸收,而回肠只是吸收机能的储备。
3.2 小肠黏膜免疫细胞
人参多糖可以促进淋巴细胞的增殖转化,提高 T、B淋巴细胞的免疫活性,增强非特异性免疫系统功能[16-17]。GSLP多糖组成与人参根须基本相同,但是其对小肠黏膜免疫细胞的影响目前并未见相关报道。iIEL具有抑制黏膜超敏反应、中和外源细胞毒作用及分泌淋巴因子等多种功能,并且可以产生溶细胞活性,杀死或清除感染或损伤的上皮细胞,对细菌和病毒感染具有免疫监视的作用[18-19]。CD3分子作为活化T 淋巴细胞的起始信号,在T淋巴细胞被抗原激活的早期过程起重要作用,是成熟T 淋巴细胞的特征性标志,在一定程度上代表了T 淋巴细胞总数[20-21]。因此,小肠iIEL和CD3+T淋巴细胞反映了小肠的免疫状态。本项研究中,GSLP 虽然对空肠和回肠iIEL 数量无明显影响,但是当GSLP添加量大于0.4 g·kg-1时,显著增加了CD3+阳性细胞的面积,表明GSLP具有促进空肠黏膜中T淋巴细胞活化和增殖,提高细胞免疫反应的作用效果。另外,GSLP对空肠iIEL数量、CD3+阳性细胞面积和回肠iIEL数量的作用存在着剂量效应,当添加剂量大于0.8 g·kg-1时,上述免疫细胞数量开始呈现下降趋势。
肠道黏膜上皮内杯状细胞可以分泌黏蛋白,黏蛋白连续分布于肠道黏膜表面,形成疏水的黏液层,既可以保护肠道上皮细胞免受机械损伤,又可以包载抗原物质从而利于胰腺分泌的酶进行降解[22]。黏蛋白可以协同分泌型免疫球蛋白 A(SIgA)在肠黏膜表面形成抗感染的抗体黏膜屏障,利用肠蠕动将捕获的病原微生物和毒素清除体外[23]。GSLP虽然有增加空肠杯状细胞数量的趋势,但是试验组与对照组相比,差异并不显著。
MC是天然免疫的效应细胞之一,其前体细胞位于肠黏膜固有层中,受到抗原刺激迅速分化成为成熟的MC,通过释放免疫介质使炎性细胞进入黏膜参与获得性免疫,在宿主对病原微生物的防御反应中发挥重要作用[24-25]。高添加量(1.6 g·kg-1)GSLP显著增加了空肠MC的数量,而且添加量与MC数量呈二次曲线相关关系。上述结果表明GSLP可以增强小肠黏膜免疫调节机能,提高免疫力,而且同样存在剂量效应。GSLP 的剂量效应可能与小肠T淋巴细胞有关,MC在增殖过程中普遍依赖于T淋巴细胞[26],而本研究中CD3+阳性细胞面积的变化在一定程度上反映了T淋巴细胞的变化趋势。
3.3 相关性分析
虽然本项研究中各处理之间绒腺比的差异并不显著,但是相关性分析结果表明GSLP 对小肠黏膜的发育仍然具有一定的促进作用,并且对空肠黏膜发育的作用效果优于回肠。另外,GSLP通过增加空肠iIEL数量和CD3+阳性细胞面积,提高空肠的黏膜免疫水平。
4 结 论
多糖含量为24.4%的GSLP对蛋雏鸡空肠和回肠黏膜组织的发育具有一定程度的促进作用,但是对小肠养分吸收机能并无显著的作用效果。不同添加量GSLP对免疫细胞作用存在剂量效应,综合GSLP对小肠黏膜免疫细胞的影响,0.4 ~1.6 g·kg-1GSLP可以提高空肠的黏膜免疫水平。环磷酰胺诱导的雏鸡前期免疫抑制可以促进小肠黏膜上皮细胞的成熟,提高腺体的分泌机能。GSLP 对环磷酰胺前期抑制的空肠绒毛高度和黏膜厚度的发育具有改善作用。
[1] 张玉华,李树友.断奶仔猪肠道粘膜免疫及营养 [J].中国饲料,2002(1):31-32. ZHANG Y H,LI S Y.Intestinal mucosal immunity and nutrition of weaned piglet[J].ChinaFeed,2002(1):31-32.(in Chinese)
[2] 姜厚涛,吴国华,张 强,等.动物黏膜免疫的研究进展[J].中国兽医科学,2013,43(6):655-660. JIANG H T,WU G H,ZHANG Q,et al.Advance in animal mucosal immunity[J].ChineseVeterinaryScience,2013,43(6):655-660.(in Chinese)
[3] 陶 浩,魏炳栋,陈 群.黄芪多糖对1~14 日龄肉仔鸡小肠形态结构的影响 [J].东北农业大学学报,2012,43(3):52-57. TAO H,WEI B D,CHEN Q.Effect of polysaccharide on mocosal structure in small intestine of 14-day-old broilers[J].JournalofNortheastAgriculturalUniversity,2012,43(3):52-57.(in Chinese)
[4] 蒋淑君,许兰芝.淫羊藿总黄酮的药理作用研究进展 [J].中医药学报,2004,32(4):60-62. JIANG S J,XU L Z.Study development of herba total flavonoids in pathology[J].ActaChineseMedicineandPharmacology,2004,32(4):60-62.(in Chinese)
[5] 贾 敏,周玲玲,郭胜伟,等.芦荟多糖对小鼠脾淋巴细胞增殖及产生IL-1 的影响 [J].南京中医药大学学报,2006,22(2):89-90. JIA M,ZHOU L L,GUO S W,et al.Effect of polysaccharides in herba aloes on proliferation and formation of lymphocyte of mice spleen[J].JournalofNanjingUniversityofTraditionalChineseMedicine,2006,22(2):89-90.(in Chinese)
[6] 张皖东,吕 诚,刘振丽,等.人参多糖和猪苓多糖对大鼠肠道黏膜淋巴细胞功能的影响[J].中草药,2007,38(2):221-224. ZHANG W D,LÜ C,LIU Z L,et al.Effect of ginseng polysaccharide and polyporus umbellatus polysaccharide on function of lymphoeytes in enteric macosa of rats[J].ChineseTraditionalandHerbalDrugs,2007,38(2):221-224.(in Chinese)
[7] 张皖东,吕 诚,赵宏艳,等.人参多糖和猪苓多糖对CIA 大鼠肠道黏膜免疫细胞功能的影响 [J].细胞与分子免疫学杂志,2007,23(9):867-868,871. ZHANG W D,LÜ C,ZHAO H Y,et al.Effect of ginseng polysaccharide and grifola polysaccharide on intestinal mucosal immane cell function of CIA rats[J].ChineseJournalofCellularandMolecularImmunology,2007,23(9):867-868,871.(in Chinese)
[8] 李相玲,白莎莎,周 联,等.环磷酰胺和地塞米松对小鼠肠道黏膜免疫抑制的比较 [J].中国免疫学杂志,2013,29(1):39-42,47. LI X L,BAI S S,ZHOU L,et al.Comparison of the immunosupressive functions induced by cyclophosphamide and dexamethasone in intestinal mucosa in mice[J].ChineseJournalofImmunology,2013,29(1):39-42,47.(in Chinese)
[9] HOUSHMAND M,AZHAR K,ZULKIFLI I,et al.Effects of non-antibiotic feed additives on performance,immunity and intestinal morphology of broilers fed different levels of protein [J].S.AfrJAnimSci,2012,42(1):22-32.
[10] CASPARY W F.Physiology and pathophysiology of intestinal absorption [J].AmJClinNutr,1992,55(1):299-308.
[11] 韩正康.家畜营养生理学 [M].北京:农业出版社,1993:6-17. HAN Z K.Livestock nutritional physiology[M].Beijing:Agriculture Press,1993:6-17.(in Chinese)
[12] EWTUSHIK A L,BERTOLO R F P,BALL R O.Intestinal development of early-weaned piglets receiving diets supplemented with selected amino acids or polyamines [J].CanJAnimSci,2000,80(4):653-662.
[13] LI D F,NELSSEN J L,REDDY P G,et al.Measuring suitability of soybean products for early-weaned pigs with immunological criteria [J].JAnimSci,1991,69(8):3299-3307.
[14] 董晓芳,汪仕奎,萨仁娜,等.免疫抑制剂环磷酰胺对肉仔鸡生产性能及其内分泌的影响 [J].畜牧兽医学报,2007,38(9):993-998. DONG X F,WANG S K,SA R N,et al.Effect of immunosuppressant cyclophosphamide on performance and incretion in broiler[J].ActaVeterinariaetZootechnicaSinica,2007,38(9):993-998.(in Chinese)[15] 贾玉萍,周东顺,孙 超,等.人参多糖对环磷酰胺的增效减毒作用 [J].中国实验动物学报,2013,21(6):61-64. JIA Y P,ZHOU D S,SUN C,et al.Efficiency-enhancing and toxicity effects of ginseng polysaccharide on cyclophosphamide treatment of mouse hepatoma[J].ActaLaboratoriumAnimalsScientiaSinica,2013,21(6):61-64.(in Chinese)
[16] YUN Y S,LEE Y S,JO S K,et al.Inhibition of autochthonous tumor by ethanol insoluble fraction from Panax ginseng as an immunomodulator [J].PlantaMed,1993,59(6):521-524.
[17] KWAK Y,SHIN H,SONG Y,et al.Isolation of immunomodulatory antitumor active polysaccharide(RGAP) from red ginseng by-product and its physico-chemical properties [J].JKorenSocFoodSciNutr,2003,32:752-757.
[18] 谢遵江,刘文庆,贺业春,等.小鼠肠上皮内淋巴细胞在黏膜免疫应答中的形态学研究[J].解剖学报,1997,28(3):309-313. XIE Z J,LIU W Q,HE Y C,et al.Morphological study of mice intestinal intraepithelial lymphocytes in mucosal immune response[J].ActaAnatomicaSinica,1997,28(3):309-313.(in Chinese)
[19] 范 骏.肠道黏膜免疫 [J].国际免疫学杂志,2006,29(2):111-115. FAN J.Intestinal mucosal immunity[J].InternatimalJournalofImmunology,2006,29(2):111-115.(in Chinese)
[20] 张洪涛.抗TCR/CD3单克隆抗体研究应用的现状与展望 [J].国外医学免疫学分册,1996,19(5):239-243. ZHANG H T.Research and application development and prospect of anti-TCR/CD3 monoclonal antibody[J].ForeignMedicalSciencesSectionofImmunology,1996,19(5):239-243.(in Chinese)
[21] 张小飞,杨 倩.复合黏膜免疫佐剂对鸡小肠细胞免疫的影响 [J].畜牧兽医学报,2008,39(1):85-90. ZHANG X F,YANG Q.Effects of compound mucosal immune adjuvants on cellular immune responses of small intestine in chicken[J].ActaVeterinariaetZootechnicaSinica,2008,39(1):85-90.(in Chinese)
[22] ATUMA C,STRUGALA V,ALLEN A,et al.The adherent gastrointestinal mucus gel layer:thickness and physical stateinvivo[J].AmJPhysiolGastrointestLiverPhysiol,2001,280(5):G922-G929.
[23] 罗治彬,吴嘉惠.肠道黏膜屏障结构的研究进展 [J].胃肠病学和肝病学杂志,1997,6(4):372-375. LUO Z B,WU J H.Research progress of intestinal mucosal barrier structure[J].ChineseJournalofGastroenterologyandHepatology,1997,6(4):372-375.(in Chinese)
[24] ROCHA M F,AGUIAR J E,SIDRIM J J,et al.Role of mast cells and pro-inflammatory mediators on the intestinal secretion induced by cholera toxin [J].Toxicon,2003,42(2):183-189.
[25] ROTTEM M,MEKORI Y A.Mast cells and autoimmunity [J].AutoimmunRev,2005,4(1):21-27.
[26] HERSHKO A Y,RIVERA J.Mast cell and T cell communication;amplification and control of adaptive immunity [J].ImmunolLett,2010,128(2):98-104.
(编辑 白永平)
Effects of Ginseng Stem and Leaf Polysaccharide on Small Intestinal Mucous Tissue Development and Immune Cells of Chicken
YAN Xiao-gang,ZHANG Fang-yu,LANG Hong-yan,JIN Xiang-shu,ZHAO Zhong-li,LIU Chen*
(TheBranchAcademyofAnimalScience,JilinAcademyofAgriculturalScience,Gongzhuling136100,China)
To study the effects of ginseng stem and leaf polysaccharide (GSLP) on small intestinal mucous tissue development and immune cells of chicken,600 of 7 days healthy Hy-line Variety Brown chicken (52.79±4.58 g) were freely divided into 10 treatments,60 chicken per treatment (3 replications,20 chicken per replication),5 treatments were included in normal fed group and others were in immune depressed group.The additive levels of GSLP were 0,0.2,0.4,0.8 and 1.6 g·kg-1in each group based on basal diet.After feeding stage,9 chicken of each treatment (3 per replication) were randomly selected for samples collection of jejunum and ileum.The results showed that:(1) GSLP improved villus width and surface area of jejunum (P<0.01),0.8 and 1.6 g·kg-1GSLP decreased villus height and recess depth of ileum (P<0.01),but GSLP had no significant effects on villus to gland ratio;(2) The interactions of GSLP with immune state were observed in jejunum villus height (P<0.05) and mucous thickness (P<0.01),and ileum villus height (P<0.05);(3) 0.4,0.8 and 1.6 g·kg-1GSLP increased the amounts of CD3+T lymphocyte(P<0.05),and 1.6 g·kg-1GSLP increased the amounts of mast cell (P<0.05) in jejunum,and dosage effects were existed in the influence of GSLP on immune cells.In conclusion,GSLP had somewhat improvement on small intestinal mucous tissue development,but had no significant influence on nutrients absorptive function;0.4 to 1.6 g·kg-1GSLP increased the level of jejunum mucous immunization;and GSLP could improve the development of jejunum villus height and mucous thickness depressed by cyclophosphamide in early trial stage.
ginseng stem and leaf polysaccharide;egg laying chicken;small intestinal mucous development;immune cells
10.11843/j.issn.0366-6964.2015.01.019
2014-05-01
吉林省博士后科研启动基金项目;吉林省现代家禽产业技术体系
闫晓刚(1977-),男,吉林临江人,副研究员,主要从事动物营养代谢调控研究,E-mail:yanxiaogang1977@163.com,Tel:0434-6282058
*通信作者:刘 臣,研究员,E-mail:liuchen3199@163.com
S831.5
A
0366-6964(2015)01-0144-12

