线粒体移植对水牛卵母细胞发育潜能的影响
高亚可,陆凤花,吴柱连,马 帆,刘晓华,杜姗姗,石德顺
(广西大学亚热带生物资源保护利用国家重点实验室,南宁 530005)
线粒体移植对水牛卵母细胞发育潜能的影响
高亚可,陆凤花,吴柱连,马 帆,刘晓华,杜姗姗,石德顺*
(广西大学亚热带生物资源保护利用国家重点实验室,南宁 530005)
本研究以水牛卵泡颗粒细胞作为线粒体的来源细胞,初步探讨水牛卵母细胞进行线粒体移植(MIT)后对其发育潜能的影响。试验比较了不同级别水牛卵母细胞mtDNA的拷贝数,并研究了水牛卵母细胞进行MIT后,其后续早期胚胎发育及胚胎线粒体膜电位(ΔΨm)的变化情况。结果显示:一级卵母细胞组的平均mtDNA拷贝数极显著高于二、三级卵母细胞组((202 101±74 432)vs(118 483±17 028),(39 177±7 938),P<0.01),二级卵母细胞组的平均mtDNA拷贝数极显著高于三级卵母细胞组((118 483±17 028)vs(39 177±7 938),P<0.01);孤雌激活处理后发现:一级卵母细胞组的卵裂率和囊胚率也都极显著高于二、三级卵母细胞组(P<0.01),而二级卵母细胞组激活后胚胎的卵裂率和囊胚率亦极显著高于三级卵母细胞组(P<0.01)。用Mito-Tracker探针标记的外源线粒体经移植后,会随着胚胎的发育而发生移动,分布到各个卵裂球中;且发现二级卵母细胞MIT组孤雌激活后的囊胚率显著高于对照组和空注组(27.3%vs17.4%,7.84%,P<0.05),而三级卵母细胞MIT组激活后的囊胚率与对照组和空注组差异不显著(P>0.05);对胚胎ΔΨm检测发现,水牛植入前各时期胚胎ΔΨm总体呈上升趋势,线粒体移植后胚胎各时期的ΔΨm均显著高于对照组(P<0.05)。综上表明:不同质量的水牛卵母细胞其mtDNA拷贝数存在显著差异,且mtDNA拷贝数与卵母细胞质量和发育能力成正相关;通过移植外源线粒体可以提高二级水牛卵母细胞的发育潜能。
线粒体移植;mtDNA拷贝数;线粒体膜电位;水牛;卵泡颗粒细胞
线粒体是哺乳动物细胞中含量最为丰富的细胞器,其基本功能是为细胞的一切生命活动提供能量(ATP),同时还对配子的成熟和早期胚胎发育产生重要的影响。在卵母细胞的成熟过程中,线粒体的数量、结构及分布不是固定不变的,它会随着卵母细胞成熟过程中对能量的需求变化而变化。但随着卵母细胞的成熟完成,mtDNA将不再进行自我复制,直至囊胚孵化阶段才恢复复制[1],因此,早期胚胎发育各阶段所需要的能量主要由卵母细胞自身所携带的线粒体提供。J.Van Blerkom等[2]研究发现,ATP的供应能力对于卵母细胞的受精和早期胚胎发育至关重要,ATP含量低的卵子虽然也具有一定的受精能力,但仅当ATP含量≥2 pmol时,受精卵才容易继续发育。研究表明,在胚胎发育早期需要大量的能量,尤其是4-~8-细胞期,如果能量供给不足,胚胎就会分裂减缓,染色体非整倍体率增加,继而发育阻滞[3]。C.T.Zeng等[4]进行患者自体颗粒细胞线粒体移植(MIT)后,成功获得妊娠的临床报道。2003年,中国首例MIT的双胞胎儿顺利出生并且健康状况良好[5]。在小鼠,Y.C.Yi等[6]分别对年轻和老龄小鼠进行MIT,与未移植的对照组相比,年轻小鼠组两者囊胚率差异显著,老龄小鼠组两者囊胚率差异极显著。因此,MIT可以一定程度上改善卵子的质量和胚胎的发育能力。本试验以水牛卵泡颗粒细胞作为线粒体的来源细胞,尝试对水牛卵母细胞进行线粒体移植,探讨线粒体移植对水牛卵母细胞发育潜能的影响以及其在水牛卵母细胞上应用的可行性。
1 试验材料
1.1 材料
水牛卵巢采自于南宁市屠宰场。
1.2 主要试剂
本试验所用化学试剂除特殊说明外均购自Sigma 公司。TCM-199、DMEM购自Gibco公司,质粒PMD18-T Vector、DNATaq酶、10×PCR Buffer、Taq Mastermix 和SYBR Premix Ex TaqTM 购自大连宝生物公司(TaKaRa);质粒提取试剂盒和DNA胶回收试剂盒购自天根生化科技有限公司,琼脂糖Agarose购自上海北诺生物科技有限公司;卵母细胞裂解液(1×PCR buffer,2.5% Triton X-100,100 μg·mL-1蛋白酶K)购自英国Huntingdon公司;线粒体提取试剂盒购自德国Hermo公司;Mito-Tracker Green线粒体荧光探针购自碧云天生物公司;JC-1线粒体荧光探针购自美国AAT Bioquest。
1.3 主要仪器
电泳仪和凝胶成像系统(BIO-RAD),PCR仪(Biometra),高速离心机和紫外分光光度计(Thermo),MILLIQ-BioCel 超纯水制备系统(Millipore),超净工作台(苏州佳德净化科技),生化恒温培养箱(上海博迅医疗设备),7500 Real Time PCR(Applied Biosystems),实体显微镜(Nikon),倒置显微镜及显微操作系统(Nikon),激光扫描共聚焦显微镜(LSM510 meta,Leica),CO2培养箱(Thermo),高速冷冻离心机(Sigma)。
1.4 试验方法
1.4.1 水牛卵母细胞的体外成熟培养 从屠宰场收集的水牛卵巢置于30 ℃左右高压灭菌生理盐水中2~3 h运回实验室。卵巢先用75%酒精润洗消毒后,再用预热灭菌生理盐水清洗2~3遍,用带有12号针头的10 mL注射器抽取卵巢皮质层2~5 mm直径的卵泡。抽卵前先吸取少量预热的CCM液(TCM-199+5 mmol·L-1HEPES+5 mmol·L-1NaHCO3+3% FBS),体视显微镜下拣出卵泡液中的卵丘-卵母细胞复合体(COCs)。经CCM液清洗2~3遍后,放入预热M液(TCM-199+5 mmol·L-1HEPES+26.2 mmol·L-1NaHCO3+0.1 μg·mL-1FSH+5% FBS)中过渡处理3 min,然后移入另一份M液中,每100 μL体积M液中放入10~20枚COCs。置于38.5 ℃ 5% CO2饱和湿度的恒温培养箱中成熟培养22~24 h。
1.4.2 体外成熟卵母细胞的分类 根据体外成熟后卵母细胞的形态和卵丘颗粒细胞的层数,可将卵母细胞大致分为5类[7]:A类卵母细胞形态规则,卵丘颗粒细胞致密,至少包裹有5层以上卵丘颗粒细胞;B类卵母细胞形态基本规则,卵丘颗粒细胞为2~4层,基本上包裹卵母细胞;C类卵母细胞大部分被卵丘颗粒细胞包裹,形态基本规则;D类卵母细胞外只有少量卵丘颗粒细胞存在,形态基本规则;E类卵母细胞为裸卵,形态基本规则。其中A、B类卵母细胞归为一级,C、D类卵母细胞归为二级,E类卵母细胞归为三级。
1.4.3 荧光定量标准品的制备
1.4.3.1 PCR扩增:将去除颗粒细胞后的5枚水牛卵母细胞移入10 μL裂解液进行细胞裂解,作为PCR扩增的模板。参考GenBank中牛线粒体全基因组(NC_006853)和文献[8],设计引物序列(上游:5′-CAGTGAGAATGCCCTCTAGG-3′;下游:5′-TTTACGCCGTACTCCTGT-3′)。在200 μL灭菌PCR中依次加入Taq Mastermix 10 μL、引物各0.5 μL、模板1 μL、双蒸水8 μL,PCR扩增程序:95 ℃变性3 min;95 ℃30 s,58 ℃30 s,72 ℃30 s,30循环;72 ℃10 min。扩增后产物点样电泳(110 V 30 min),凝胶成像分析系统拍照观察。
1.4.3.2 目的片段的克隆、鉴定:切下目标条带,回收并纯化PCR产物(天根生化科技有限公司)。利用pMD18-T 载体进行连接,于16 ℃水浴过夜,次日进行转化。转化前先预热复苏液和培养基,取5 μL连接产物加入感受态细菌中冰浴30 min,将混合物放入42 ℃水浴锅,水浴60 s,冰上放置2 min,加入1 mL复苏液于混合物中,摇床中混匀45 min后离心。弃去上层800 μL 液体,将剩余液体混匀涂于加入抗生素的LB 固体培养基上,37 ℃培养12 h 后挑菌、摇菌。提取质粒前,先进行菌液cracking鉴定,挑选阳性菌液提取重组质粒(天根生化科技公司)。对重组质粒进行双酶切鉴定,若重组质粒构建成功,则测定其浓度,并对其梯度稀释保存。1.4.3.3 荧光定量PCR:将上述梯度稀释好的质粒作为模板,进行荧光定量PCR扩增,制备标准曲线,作为实时荧光定量标准品。反应体系:SYBR II 10 μL、ROX染料0.4 μL、引物各0.3 μL、双蒸水8 μL、模板1 μL,共20 μL;反应条件:95 ℃5 min,95 ℃ 30 s,60 ℃ 1 min,45个循环。
1.4.4 mtDNA拷贝数测定 按上述分类标准分别收集不同级别的卵母细胞,5枚一组放入10 μL细胞裂解液内,55 ℃水浴锅内放置20~30 min,100 ℃沸水中放置5 min,再以1 000 r·min-1离心2 min,取10 μL上清液稀释20倍后作为 PCR 模板。荧光定量 PCR 反应体系同1.4.3.3,以双蒸水和裂解液作为阴性对照组。
1.4.5 孤雌激活处理 分别对各级别卵母细胞进行孤雌激活处理。先用5 μmol·L-1的离子霉素激活处理 5 min,用培养液清洗3遍,然后移入含 2 mmol·L-1的二甲氨基嘌呤(6-DMAP)的培养液中激活处理3 h。激活后用培养液清洗3遍,移入水牛颗粒细胞单层的培养微滴内,置于38.5 ℃、5%CO2、饱和湿度的恒温培养箱中进行培养,每48 h换液1次。24 h后统计各组胚胎卵裂率,7 d后统计各组胚胎囊胚率。
1.4.6 水牛卵泡颗粒细胞的分离与体外培养 具体方法参照文献[9]。
1.4.7 线粒体的提取及活性检测 水牛颗粒细胞培养汇合至70%~80% 时,用胰酶消化、收集细胞,单次提取的细胞数量约5×107。依据线粒体提取试剂盒(Thermo公司)操作要求,将收集的颗粒细胞洗涤后加入预冷的2 mL玻璃匀浆器中,加入800 μL分离液A,冰上研磨30~40 s使细胞破裂(可取少量研磨液镜下观察细胞破裂程度),加入500 μL分离液C并一起转移到灭菌EP管内,1 500 r·min-1离心5 min,取上清12 000 r·min-1离心 20 min,弃上清,加入500 μL分离液C重悬洗涤,1 500 r·min-1离心5 min,取上清12 000 r·min-1离心10 min,弃上清,线粒体沉淀在管底,加入5 μL保存液混匀悬浮备用。活性线粒体经Mito-Tracker Green染色后可以发出绿色荧光,活性较低或失去活性的线粒体则荧光强度较弱或没有荧光。检测时,将Mito-Tracker荧光探针工作液200 μL与提取的线粒体混匀,培养箱内孵育30 min,洗涤2~3次后12 000 r·min-1离心10 min回收线粒体,荧光显微镜下检测线粒体的荧光强度。
1.4.8 线粒体移植 将事先提取好的线粒体放入CO2培养箱中温育30 min。在操作盘中分别做5 μL线粒体悬液滴、30 μL胰酶溶液滴各1个,30 μL培养液(CM)液滴(放置卵母细胞)若干滴,覆盖石蜡油,将操作盘置于CO2培养箱中温育5~10 min。借助显微操作系统,使用内径6~7 μm 的显微注射针,先吸取一定量(相当于1~1.5个卵母细胞直径长度)的线粒体悬液,再缓缓注入单个卵母细胞胞质内。线粒体移植后用CM液清洗卵母细胞2~3次,置于CO2培养箱内恢复处理1 h后进行孤雌激活处理。1.4.9 胚胎线粒体膜电位(ΔΨm)测定 按照线粒体膜电位检测试剂盒说明书配制JC-1工作液,染色前先将工作液在CO2培养箱中温育30 min,使用时与CM培养液1∶1混匀。收集各时期(2-细胞、4-细胞、8-细胞、桑椹胚和囊胚)胚胎,置于JC-1工作液中避光染色30 min。由于JC-1探针的水溶性较差,会有轻微絮状不容物附在胚胎表面,染色结束后需用CM液多次洗涤,可轻微吹打。荧光显微镜下分别于绿色和红色荧光模块下观察,获取荧光图像,使用Image-Pro Plus 6.0软件测量同一胚胎的红、绿荧光值,最后计算同一胚胎的红、绿荧光比值即为胚胎的线粒体膜电位值(ΔΨm)。
1.5 试验设计
1.5.1 卵母细胞mtDNA拷贝数与卵母细胞质量及胚胎发育潜能的关系 收集经体外成熟培养后不同级别的水牛卵母细胞,采用实时荧光定量PCR检测卵母细胞mtDNA 的拷贝数,并分别对各级别卵母细胞进行孤雌激活处理,观察统计其胚胎发育情况,初步分析mtDNA拷贝数与卵母细胞质量及胚胎发育潜能的关系。
1.5.2 线粒体的活性检测及移植后的追踪观察 以水牛卵泡颗粒细胞作为线粒体提取的供源细胞,将提取出的线粒体用Mito-Tracker荧光探针标记后,荧光显微镜下观测线粒体的活性值;同时借助显微操作系统,将一定量的标记后的线粒体植入体外成熟培养24 h后的卵母细胞胞质内,然后进行孤雌激活处理。荧光显微镜下观察外源线粒体在胚胎发育过程中的分布及存活情况。
1.5.3 线粒体移植对水牛胚胎发育的影响 试验以二、三级水牛卵母细胞为研究对象,初步探讨MIT对二、三级水牛卵母细胞发育潜能的影响。将提取的活性线粒体移植到二、三级卵母细胞胞质后进行孤雌激活处理,设置空注组(注入等量的线粒体悬浮液)和对照组(不移植),观察并统计各组胚胎发育情况。
1.5.4 线粒体移植对水牛植入前胚胎线粒体膜电位的影响 本试验旨在探索MIT对水牛植入前胚胎线粒体膜电位的影响。收集体外成熟培养24 h后的水牛二级卵母细胞,随机分为两组,一组进行线粒体移植,另一组为对照组,然后分别进行孤雌激活处理并进行胚胎培养。收集两组各阶段胚胎,通过JC-1荧光探针染色来检测不同时期胚胎的ΔΨm值,荧光显微镜下分别于绿色和红色荧光模块下观察,获取荧光图像,使用Image-Pro Plus 6.0软件测量同一胚胎的红、绿荧光值,最后计算同一胚胎的红、绿荧光比值即为胚胎的线粒体膜电位值(ΔΨm)。
2 结 果
2.1 标准品的制备
PCR产物经1% 凝胶电泳检测,扩增出225 bp大小目的片段(图1 A),扩增条带清晰明亮,没有拖带现象。重组质粒经双酶切鉴定(图1B):重组质粒大小约3 000 bp,条带清晰明亮,双酶切检测切下片段约为300 bp左右,与预期结果一致,说明质粒构建成功。
将梯度稀释的质粒经real-time PCR反应后,得到的标准曲线如图2所示。标准曲线的斜率为-3.396,截距为36.492,R2值为0.997,其线性范围可达6个数量级,其重组质粒浓度与相应的Ct值线性关系良好,可用于量化样品中mtDNA的拷贝数。
2.2 不同级别水牛卵母细胞mtDNA拷贝数
采用qRT-PCR检测不同级别水牛卵母细胞mtDNA 拷贝数的分析结果:一级卵母细胞组的平均mtDNA拷贝数极显著高于二、三级卵母细胞组((202 101±74 432)vs(118 483±17 028),(39 177±7 938),P<0.01);二级卵母细胞组的平均mtDNA拷贝数亦极显著高于三级卵母细胞组((118 483±17 028)vs(39 177±7 938),P<0.01)。表明不同质量的水牛卵母细胞的mtDNA拷贝数存在显著差异。

M1.Marker Ⅰ;M2.Super marker;M3.Marker Ⅲ图1 PCR扩增目的基因片段(A)和重组质粒的双酶切鉴定(B)Fig.1 The target gene fragment of PCR amplification(A)and double digestion of the recombinant plasmid(B)
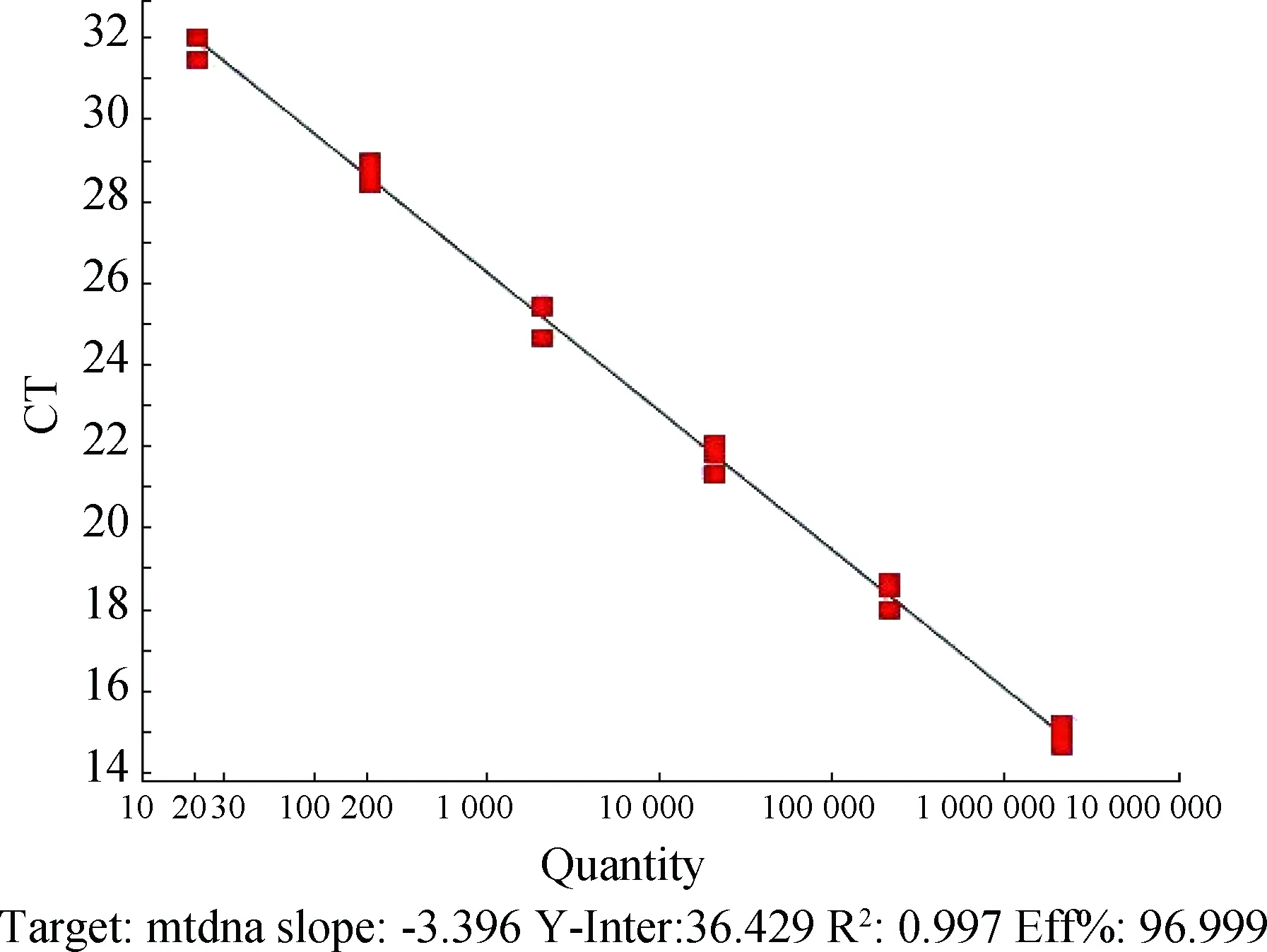
图2 mtDNA 拷贝数定量PCR标准曲线Fig.2 The standard curve of mtDNA copy number
2.3 不同级别水牛卵母细胞孤雌激活胚胎的发育
不同级别水牛卵母细胞孤雌激活处理后胚胎发育情况见表1,一级卵母细胞经孤雌激活处理后的胚胎卵裂率和囊胚率都极显著高于二、三级卵母细胞组(P<0.01);而二级卵母细胞激活后胚胎的卵裂率和囊胚率亦极显著高于三级卵母细胞组(P<0.01)。表明水牛卵母细胞的mtDNA拷贝数与胚胎发育的能力成正相关(图3)。

同组不同大写字母标注表示差异极显著(P<0.01)Data with different capital letters indicate highly significant difference (P<0.01)图3 卵母细胞mtDNA 拷贝数与胚胎发育能力的关系Fig.3 The relationship between oocyte mtDNA copy number and embryo development
表1 不同级别水牛卵母细胞孤雌激活胚胎的发育情况
Table 1 The development of parthenogenetic embryos from different quality of buffalo oocytes

组别Groups卵母细胞数No.ofoocytes分裂率/%Cleavagerate囊胚率/%Blastocystrate一级卵母细胞Thefirstlevelofoocytes11771.83±2.60A42.85±2.86A二级卵母细胞Thesecondlevelofoocytes14341.61±5.52B25.06±2.04B三级卵母细胞Thethirdlevelofoocytes12915.26±1.41C2.25±0.79C
同列标注不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下同
Data with different small letters in the same column mean significant difference (P<0.05),different capital letters indicate highly significant difference (P<0.01).The same as below
2.4 线粒体的活性检测及移植后的追踪观察
从水牛颗粒细胞中提取线粒体,活性线粒体经Mito-Tracker Green荧光探针标记后呈绿色荧光,如图4A和4B所示,荧光探针标记染色结果显示从水牛颗粒细胞提取的线粒体活性良好。线粒体移植后,在荧光显微镜下观察外源线粒体在胚胎发育过程中的分布及存活情况,结果发现:外源线粒体移植后随着胚胎发育而发生移动,并分配到每个卵裂球中。说明颗粒细胞线粒体移植后,在一定时间内,持续具有活性并参与了早期胚胎发育的过程(图4C和4D)。

A.常光下线粒体悬液图,B.绿色荧光下线粒体悬液图;C.线粒体移植2 h后荧光下胚胎图;D.线粒体移植24 h后荧光下胚胎图A.Suspension droplet of mitochondria under bright-field;B.Suspension droplet of mitochondria under fluorescence;C.The embryos after MIT for 2 h under fluorescence;D.The embryos after MIT for 24 h under fluorescence图4 线粒体移植前线粒体悬液及注射后胚胎荧光观察400×Fig.4 The fluorescence observing of suspension droplet of mitochondria before MIT and embryos in different stage after MIT 400×
2.5 线粒体移植对水牛卵母细胞后续胚胎发育的影响
线粒体移植对二、三级水牛卵母细胞孤雌激活胚胎发育的影响(表2)。结果发现:二级卵母细胞线粒体移植后的孤雌激活胚胎的囊胚发育率显著高于对照组和空注组(27.3%vs17.4%,7.84%,P<0.05);而三级卵母细胞线粒体移植后孤雌激活胚胎的囊胚率与对照组和空注组无显著差异(4.73%vs3.43%,1.36%,P>0.05)。说明水牛颗粒细胞线粒体移植可以改善二级卵母细胞后续胚胎的发育潜能,但对三级卵母细胞无明显作用。
表2 MIT对水牛二、三级卵母细胞孤雌激活胚胎发育的影响
Table 2 The effect of MIT on parthenogenetic embryonic development of the second and the third level of buffalo oocytes %

组别Groups二级卵母细胞Thesecondlevelofoocytes三级卵母细胞Thethirdlevelofoocytes细胞数No.ofoocytes卵裂率Cleavagerate8-细胞胚胎率8-cellembryorate囊胚率Blastocystrate细胞数No.ofoocytes卵裂率Cleavagerate8-细胞胚胎率8-cellembryorate囊胚率Blastocystrate注射组Injectiongroup143(84)58.7a(70)48.9a(39)27.3a169(31)18.3a(20)11.8a(8)4.73对照组Control115(71)61.8a(45)39.1b(20)17.4b175(34)19.4a(19)10.9a(6)3.43空注组Nothinginjection102(42)41.2b(19)18.6c(8)7.84c147(13)8.84b(7)4.76b(2)1.36
2.6 线粒体移植对水牛胚胎线粒体膜电位的影响
线粒体膜电位ΔΨm是在线粒体内膜两侧离子泵的作用下形成的,是保证线粒体电子传递链和氧化磷酸化形成的前提,从而保证了ATP的正常供应。本试验主要通过JC-1荧光探针染色(图5)来检测不同时期胚胎的ΔΨm值,其结果见表3,从2-细胞~囊胚的ΔΨm 总体呈上升趋势,MIT组2-细胞、4-细胞的ΔΨm极显著高于对照组(P<0.01),8-细胞期、桑椹胚和囊胚ΔΨm显著高于对照组(P<0.05)。可见,线粒体移植可以明显提高水牛孤雌激活胚胎各时期的ΔΨm,但不改变在胚胎发育过程中ΔΨm的总体变化趋势(图6)。
表3 MIT对水牛胚胎线粒体膜电位的影响
Table 3 The effect of MIT on mitochondrial membrane potential of buffalo embryo

组别Groups线粒体膜电位值ΔΨm2-细胞2-cell4-细胞4-cell8-细胞8-cell桑椹胚Morula囊胚Blastocyst移植组Transplantation0.3428±0.0742A0.3371±0.0556A0.3079±0.0814a0.4552±0.0427a0.5518±0.0538a对照组Control0.2306±0.0433B0.2318±0.0471B0.2460±0.0533b0.3915±0.0411b0.5165±0.0494b

A1~A3、B1~B3、C1~C3、D1~D3和E1~E3.2-细胞期胚胎、4-细胞期胚胎、桑椹胚、囊胚和孵化囊胚A1-A3,B1-B3,C1-C3,D1-D3,E1-E3.Respectively 2- cell stage embryos,4- cell stage embryos,8- cell stage embryos,morula,blastocyst and hatched blastocyst from top to bottom图5 各时期胚胎JC-1探针染色后可见光、绿色荧光、红色荧光图 400×Fig.5 Images in each row are embryos stained by JC-1 under a visible light,green fluorescence and red fluorescence 400×

图6 水牛孤雌激活胚胎各时期ΔΨmFig.6 The ΔΨm of buffalo parthenogenetic embryos in different stage
3 讨 论
mtDNA拷贝数是影响哺乳动物卵母细胞成熟质量和早期胚胎发育能力的重要因素。在卵母细胞成熟过程中,细胞内的mtDNA不断进行复制,线粒体的数量和分布也会随着卵母细胞成熟过程中对能量需求的变化而变化。细胞成熟后mtDNA停止复制,直到囊胚孵化阶段才逐渐恢复复制。T A.Santos等[10]通过对不同受精结局的卵母细胞mtDNA拷贝数检测发现,正常受精组高于受精失败组和退化组。J.Hansen等[11]认为,高龄妇女卵母细胞发育潜能低可能是由于卵母细胞中完整的mtDNA 拷贝数下降,或者mtDNA转录水平下降所至。此外,卵母细胞mtDNA拷贝数还与卵母细胞凋亡[12]以及胚胎发育阻滞等密切相关[13]。因此,线粒体mtDNA拷贝数可以一定程度上作为评估水牛卵母细胞成熟质量和随后胚胎发育能力的指标。试验中发现三级水牛卵母细胞的mtDNA拷贝数极显著低于一、二级卵母细胞组,且孤雌激活胚胎的发育能力显著低于一、二级卵母细胞组,说明三级水牛卵母细胞(裸卵)在体外成熟过程中未能正常进行mtDNA复制,细胞成熟不完全,同时也表明了水牛卵母细胞的mtDNA拷贝数与卵母细胞质量和胚胎发育的能力成正相关。试验发现二级卵母细胞经线粒体移植后可以显著提高其孤雌激活胚胎的发育能力,这一结果与王晓磊等的试验结果相似[14];试验还发现,虽然MIT组与对照组相比卵裂率无显著差异,但都显著高于空注组(P<0.01),说明了显微操作会对细胞造成一定的机械损伤,同时也说明线粒体移植对胚胎的发育有明显的改善作用。另外试验结果显示,MIT对三级卵母细胞的胚胎发育率并无明显改善作用,这可能是由于三级水牛卵母细胞的mtDNA拷贝数过低,卵母细胞胞质成熟不完全,显著降低了其胚胎的发育能力。同时依据J.Van Blekrom等[2]的研究结果,卵母细胞内ATP的含量要达到一定的阈值胚胎才能正常受精和发育,而对三级水牛卵母细胞注入有限的外源线粒体可能无法提高其ATP的含量达到这个阈值,因而对胚胎的发育无明显改善作用。
在对卵胞质移植和体细胞核移植的研究发现,虽然供体细胞的mtDNA进入受体卵母细胞后会随着胚胎的发育发生遗传漂变或降解而逐渐减少,甚至全部消失,但也有少量的mtDNA可以被同化并参与受体胚胎的发育,且可以遗传给后代[15]。这说明在受体卵母细胞内没有生物学机制上可以彻底破坏外源线粒体的酶类存在,受体卵母细胞胞质对外源线粒体具有一定程度的可兼容性。本试验将颗粒细胞线粒体移植到水牛卵母细胞中并进行孤雌激活处理,发现被标记的外源线粒体会随着胚胎的发育发生移动,并被分配到卵裂球中,说明外源线粒体移植后在一定时间内可持续具有活性,并参与了胚胎的早期发育。但多数细胞荧光强度会随着胚胎发育越来越弱,这可能是由于移植的线粒体数量相对有限,且随着胚胎发育部分外源线粒体被逐步降解,同时线粒体活性荧光探针也会随着观察次数的增多而发生荧光淬灭。线粒体膜电位(ΔΨm)是通过线粒体内膜两侧“质子泵”的作用形成,是保证电子传递以及氧化磷酸化反应正常进行,促使细胞能量物质 ATP 形成的前提[16],此外,ΔΨm与卵母细胞成熟、受精和卵裂过程中线粒体的空间稳定,细胞信号转导,维护钙稳态和细胞凋亡等过程也直接相关[17-19]。因此,ΔΨm被认为是影响卵母细胞和胚胎发育潜能的重要因素之一。本试验在对早期胚胎ΔΨm测定时发现,正常水牛孤雌激活胚胎从2-细胞~囊胚,其ΔΨm总体呈上升趋势,这与刘延荷等对小鼠的研究结果一致[20]。这可能是由于随着胚胎的发育进行,胚胎的耗能越来越多,会不断激活一些原来可能处于“休眠”状态的线粒体参与供能,从而提高了胚胎的ΔΨm值。同时,MIT组的卵母细胞孤雌激活后各个时期胚胎的ΔΨm均明显高于对照组。这可能是由于被移植的外源线粒体具有较高的活性,并有部分外源线粒体参与了胚胎的发育过程,从而增加了胚胎整体的ΔΨm值。本试验结果显示,外源线粒体移植虽然改变了水牛各时期胚胎的ΔΨm,但未改变胚胎发育过程中ΔΨm的总体变化趋势。综上所述,卵母细胞线粒体移植可以一定程度上提高水牛卵母细胞的发育潜能。
[1] VAN BLERKOM J,DAVIS P,ALEXANDER S.Differential mitochondrial distribution in human pronuclear embryos leads to disproportionate inheritance between blastomeres:relationship to microtubular organization,ATP content and competence[J].HumReprod,2000,15(12):2621-2633.
[2] VAN BLERKOM J,SINCLAIR J,DAVIS P,et al..Mitochondrial transfer between oocytes:potential applications of mitochondrial donation and the issue of heteroplasmy[J].HumReprod,1998,13(10):2857-2868.
[3] BRENNER C A,WOLNY Y M,BARRITT J A,et al.Mitochondrial DNA deletion in human oocytes and embryos[J].MolHumReprod,1998,4(9):887-892.
[4] ZENG C T,HSIEH R,CHANG S,et al.Pregnancy derived from mitochondria transfer (MIT) into oocyte from patient’s own cumulus granulosa cells (cGCs)[J].FertilSteril,2001,76(3):180.
[5] 孔令红,刘 忠,李 红,等.首例经自体颗粒细胞线粒体移植的双胞胎儿出生[J].第一军医大学学报,2003,(09):990-991. KONG L H,LIU Z,LI H,et al.First twins born in Mainland China by autologous granular cell mitochondria transfer[J].JournalofFirstMalitaryMedicalUniversity, 2003,(9):990-991.(in Chinese)
[6] YI Y C,CHEN M J,HO J Y,et al.Mitochondria transfer can enhance the murine embryo development[J].JAssistReprodGenet,2007,24(10):445-449.
[7] 王晓丽,杨 娟,陈 玉,等.水牛卵丘颗粒细胞凋亡与卵母细胞体外发育潜能的研究[J].畜牧兽医学报,2009,40(9):1400-1404. WANG X L,YANG J,CHEN Y,et al.Study on the relationship between cumulus granulose cells apoptosis and oocyte development in buffalo[J].ActaVeterinariaetZootechnicaSinica,2009,40(9):1400-1404.(in Chinese)
[8] 华 松.体细胞核移植及线粒体命运的研究[D].杨凌:西北农林科技大学,2007:1400-1404. HUA S.Studies of somatic cell nuclear transfer and mitochondrial fate[D].Yangling:Northwest Agriculture and Forestry University,2007:1400-1404.(in Chinese)
[9] 高亚可,陆凤花,马 帆,等.水牛卵巢颗粒细胞的分离培养及凋亡测定[J].中国畜牧兽医,2012,39(10):140-144. GAO Y K,LU F H,MA F,et al.Isolation,culture and apoptosis determination of buffalo ovarian granulosa cells[J].ChinaAnimalHusbandry&VeterinaryMedicine,2012,39(10):140-144.(in Chinese)
[10] SANTOS T A,SHOURBAGY S E,JOHN J C.Mitochondrial content reflects oocyte variability and fertilization outcome[J].FertilSteril,2006,85(3):584-591.[11] HANSEN J,CORYDON T J,PALMFELDT J,et al.Decreased expression of the mitochondrial matrix proteases Lon and ClpP in cells from a patient with hereditary spastic paraplegia (SPG13)[J].Neuroscience,2008,153(2):474-482.
[12] KRAKAUER D C,MIRA A.Mitochondria and the death of oocytes[J].Nature,2000,403(6769):501.
[13] THOUAS G A,TROUNSON A O,WOLVETANG E J,et al.Mitochondrial dysfunction in mouse oocytes results in preimplantation embryo arrestinvitro[J].BiolReprod,2004,71(6):1936-1942.
[14] 王晓磊,雷安民,窦忠英.异体颗粒细胞线粒体移植对牛孤雌激活胚胎发育的影响[J].西北农林科技大学学报,2007,(03):25-28. WANG X L,LEI A M,DOU Z Y.Effect of allogranular cells’ mitochondria transfer on bovine parthenogenetic embryos, developmental potencial[J].JournalofNorthwestA&FUniversity,2007,(03):25-28.(in Chinese)
[15] TAKEDA K,TAKAHASHI S.Dominant distribution of mitochondrial DNA from recipient oocytes in bovine embryos and offspring after nuclear transfer[J].JReprodFertil,2000,116(2):253-259.
[16] HUANG S H,RATLIFF K S,MATOUSCHEK A,et al.Protein unfolding by the mitochondrial membrane potential.[J].NatStructBiol,2002,9(4):301-307.
[17] BLERKOM J V,DAVIS P.High-polarized (ΔΨm HIGH ) mitochondria are spatially polarized in human oocytes and early embryos in stable subplasmalemmal domains:developmental significance and the concept of vanguard mitochondria [J].ReprodBiomedOnline,2006,13(2):246-254.
[18] BLERKOM J V.Mitochondria as regulatory forces in oocytes,preimplantation embryos and stem cells [J].ReprodBiomedOnline,2008,16(4):553-569.
[19] YOON S Y,CHA S K,YANG N J,et al.Alteration of high-polarized mitochondria distribution by vitrification of mouse immature oocyte may affect embryonic development[J].FertilSteril,2012,98(3):S128-S129.[20] 刘延荷,刘 凯,连 方,等.卵母细胞线粒体移植对年老小鼠植入前胚胎线粒体膜电位的影响[J].山东大学学报(医学版),2009,(01):6-9. LIU Y H,LIU K,LIAN F,et al.Effect of mitochondrial transfer on the mitochondrial membrane potential of aging mouse pre-implantation embryos[J].JournalofShandongUniversity(HealthSciences),2009,(01):6-9.(in Chinese)
(编辑 程金华)
Effects of Mitochondrial Transplant on the Developmental Potential of Buffalo Oocytes
GAO Ya-ke,LU Feng-hua,WU Zhu-lian,MA Fan,LIU Xiao-hua,DU Shan-shan,SHI De-shun*
(StateKeyLaboratoryforConservationandUtilizationofSubtropicalAgro-bioresources,GuangxiUniversity,Nanning530005,China)
The aim of present study was to investigate the effects of mitochondrial transplant (MIT) on the developmental potential of buffalo oocytes.The mitochondrial DNA (mtDNA) copy number in the oocyte,and the developmental competence,exogenous mitochondria distribution,as well as mitochondrial membrane potential (ΔΨm) in the preimplantation embryos after the MIT were examined.The result showed that the average mtDNA copy number of buffalo oocytes in the first level of oocytes was evidently higher than the second and the third level of oocytes ((202 101±74 432)vs(118 483±17 028),(39 177±7 938),P<0.01),and the average mtDNA copy number in the second level of oocytes was significantly higher than that of the third level of oocytes ((118 483±17 028)vs(39 177±7 938),P<0.01).Furthermore,the cleavage rates and blastocyst rates of the first level of oocytes were significantly higher than those of the second and the third level of oocytes after parthenogenetic activation (P<0.01),and the cleavage rates and blastocyst rates of the second level of oocytes were remarkably higher than those of the third level of oocytes (P<0.01).The exogenetic mitochondria labeled with Mito-Tracker fluorescent probe distributed into each of blastomeres with the embryonic development after MIT.Moreover,more the second level of oocytes that received MIT developed to the blastocyst stage after parthenogenetic activation in comparison with oocytes that did not received MIT or were injected with solution (27.3%vs17.4%,7.84%,P<0.05),however,there were no significant difference in the blastocyst rates of the third level of oocytes than the control group and the nothing injection group after MIT.The ΔΨm of buffalo preimplantation embryo presented an increased trend during embryonic development,and the ΔΨm of embryo derived from MIT group was significantly higher than that of the control group (P<0.05).These results showed that the mtDNA copy numbers in different quality buffalo oocytes have significant differences,and the mtDNA copy numbers of buffalo oocytes are positively related with the quality of oocytes and their developmental potential,and the developmental ability of the second level of oocytes can be improve by MIT.
mitochondrial transplantation;mtDNA copy number;mitochondrial membrane potential;buffalo;follicular granulosa cell
10.11843/j.issn.0366-6964.2015.04.011
2014-10-30
国家“863”项目(2011AA100607);教育部高等学校博士学科点博导基金项目(20114501110001);教育部回国基金项目(AC150070);广西科学基金项目(2012GXNSFFA060004);广西研究生教育创新计划资助项目(T3340098603)
高亚可(1987-),男,河南许昌人,硕士生,主要从事动物胚胎工程研究,E-mail:gaoyake_2008@163.com
*通信作者:石德顺,博导,研究员,主要从事动物胚胎工程与转基因动物研究,E-mail:ardsshi@gxu.edu.cn
S823.8+3;S814
A
0366-6964(2015)04-0583-09

