草菇谷胱甘肽还原酶基因受低温影响的表达研究
赵 妍, 马丹丹, 2, 姜 威, 颜素雅, 陈明杰
(1. 国家食用菌工程技术研究中心 农业部南方食用菌资源利用重点实验室 上海市农业遗传育种重点开放实验室 上海市农业科学院 食用菌研究所, 上海 201403; 2. 上海市农业科学院食用菌研究所 《食用菌学报》, 上海 201403)
草菇谷胱甘肽还原酶基因受低温影响的表达研究
赵 妍1, 马丹丹1, 2, 姜 威1, 颜素雅1, 陈明杰1
(1. 国家食用菌工程技术研究中心 农业部南方食用菌资源利用重点实验室 上海市农业遗传育种重点开放实验室 上海市农业科学院 食用菌研究所, 上海 201403; 2. 上海市农业科学院食用菌研究所 《食用菌学报》, 上海 201403)
谷胱甘肽还原酶(glutathione reductase, GR)在真菌抵御逆境胁迫中起到重要作用,通过比对在草菇全基因组中获得编码gr的核苷酸序列。以对低温耐受性不同的草菇菌株V23(低温敏感型)和VH3(耐低温型)为试验材料,研究了低温胁迫对草菇菌丝gr的影响,并比较了该基因在V23和VH3中的表达差异。实时荧光定量PCR结果显示:在低温处理的最初2 h,低温敏感型菌株V23的gr相对表达量出现降低,到低温处理4~8 h时,其相对表达量分别上升至V23 0 h对照的1.78倍、1.05倍和1.36倍;耐低温型菌株VH3的gr相对表达量,在低温胁迫的最初2 h时也呈现下降趋势,到低温处理4~6 h时,其相对表达量分别上升至VH3 0 h对照的1.47倍和1.41倍,但在低温处理8 h时,其相对表达量又降低至VH3 0 h对照的0.72倍。在正常生长和低温处理条件下,V23的gr相对表达量始终高于VH3,初步推测本试验中gr的高表达可能与草菇的耐低温能力无关。
草菇;低温;谷胱甘肽还原酶基因;实时荧光定量PCR
草菇[Volvariellavolvacea(Bull.) Singer]又名稻草菇、中国菇,起源于中国热带与亚热带地区。它肉质细嫩,味道鲜美,不仅能烹制成各种美味佳肴,更具有较高的营养价值与保健功效[1]。目前草菇主产区遍布东南亚各国,中国是其最主要的生产国与出口国[2]。由于草菇属高温菇种,其菌丝生长与子实体分化发育的最适温度均在32℃左右,因此草菇不耐低温贮藏。在常规低温贮藏条件下,草菇菌丝体会发生自溶死亡,子实体亦会液化、产生异味,从而失去商业价值[3]。草菇这种不耐低温贮运的特性,严重制约了产业的快速发展,因此对其低温应答机制的研究成为亟待解决的科学问题。
低温胁迫会诱导生物体产生过多的活性氧(ROS)物质,如O2·-、OH·、1O2、H2O2等。ROS具有较高的毒性,能够引起蛋白质、脂质发生氧化[4],对糖类、DNA及细胞结构造成损伤,从而影响细胞功能,最终导致细胞死亡。因此为了维持体内ROS的动态平衡,生物体常借助酶促清除系统和非酶促清除系统去除多余的ROS。酶促清除系统主要由抗氧化酶组成,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、脱氢抗坏血酸还原酶(DHAR)等;非酶促清除系统主要由抗氧化剂组成,如抗坏血酸(ASA)、还原型谷胱甘肽(GSH)和类胡萝卜素等[5-6]。GSH是由谷氨酸、半胱氨酸和甘氨酸组成的三肽小分子,能与过氧化物和自由基结合,从而维持含巯基蛋白质的生物活性[7]。GR作为催化氧化型谷胱甘肽(GSSG)生成GSH的重要酶类,在实现ASA再生,保障APX清除H2O2的过程中起到重要的作用[8]。研究表明,在南极衣藻(Chlamydomonassp. ICE-L)适应低温的过程中,GSH含量及GR活性与低温适应之间具有正相关性[9];此外,韩春然等[10]研究了GSH对酵母抗冻能力的影响,结果表明添加GSH的冷冻面团中的酵母菌落数、产气能力均显著高于未添加的冷冻面团,而冷冻面团的重量损失则低于未添加组。目前催化GSH生成的gr在草菇应答低温胁迫中的表达及作用尚不清楚。我们在实验室已有的草菇基因组数据基础上,拟采用实时荧光定量PCR技术,对低温处理不同时间下草菇V23和VH3菌丝体的gr表达变化进行研究,探讨gr与草菇耐低温能力间的相关性,为草菇低温自溶的遗传改造奠定基础。
1 材料与方法
1.1 供试菌株与试剂
草菇菌株V23和VH3由上海市农业科学院食用菌研究所菌种保藏中心提供。VH3是由V23经紫外线、60Co-γ射线、硫酸二乙酯对其原生质体进行复合诱变而来,相对V23较耐低温[11-12]。
Redzol试剂盒购自北京赛百盛基因技术有限公司;TaqDNA Polymerase in Storage Buffer B、pGEM®-T Easy Vector System I购自Promega公司;PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR®PremixExTaqTMⅡ购自TaKaRa公司;AxyPrepTMDNA Gel Extraction Kit购自爱思进生物技术有限公司;TOP10感受态细胞购自上海天根生化科技有限公司;质粒小量制备试剂盒购自上海捷瑞生物工程有限公司;马铃薯葡萄糖肉汤培养基购自碧迪医疗器械有限公司;其它试剂均为市售分析纯。
1.2 草菇菌丝总RNA的提取与cDNA的合成
将培养好的草菇菌丝置于0℃分别处理0、2、4、6和8 h,收集备用。总RNA的提取参照Redzol试剂盒说明书,并用50 μL经DEPC预处理的水溶解,然后用琼脂糖凝胶电泳进行检测。测定RNA的浓度后,依据PrimeScriptTMRT reagent Kit with gDNA Eraser说明书,去除基因组DNA,反转录成cDNA,-20℃保存备用。
1.3gr编码基因的获得
根据草菇基因组中同源物种的gr登录号,在NCBI中获得同源物种该基因的氨基酸序列,然后与草菇全基因组序列信息进行比对,并使用NCBI中的blastx程序,按照GT-AG原则去除可能的内含子,得到草菇gr的核苷酸编码区序列。
1.4 引物的设计与合成
以微管蛋白(Tubulin, TUB)基因作为内参基因,依据已得到的草菇gr的编码区序列,利用Primer5.0软件设计荧光定量引物(表1),并由上海捷瑞生物工程有限公司合成。
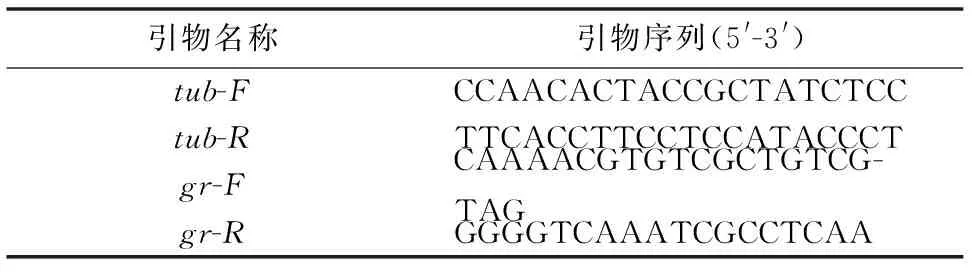
表1 实时荧光定量PCR的引物
1.5 目的片段的扩增与标准品质粒的制备
以草菇cDNA为模板,扩增获得tub和gr基因的片段,并用1%琼脂糖凝胶电泳检验。将PCR的纯化产物与pGEM®-T Easy Vector System I载体连接,制备标准品质粒后构建real-time PCR标准曲线[13]。
1.6gr的实时荧光定量测定
使用质粒小量制备试剂盒提取质粒,将获得的质粒进行梯度稀释,在StepOne Plus荧光定量PCR仪上进行扩增,构建质粒标准品稀释曲线。根据扩增效率和扩增趋势线的斜率,确定采用ΔΔCT法对gr进行相对定量[14]。Real-time PCR反应体系为20 μL:2×SYBR®PremixExTaqTMⅡ10 μL;10 μmol/L正反向引物各0.4 μL;50×Rox Reference Dye 0.4 μL;cDNA 模板2 μL,加ddH2O至20 μL。反应条件为:95℃预变性20 s;95℃ 5 s,60℃ 15 s,72℃ 15 s,共40个循环。以无菌双蒸水代替模板作为阴性对照,每组样品设置3个平行样品孔。
2 结果与分析
2.1 RNA提取效果与目的片段的扩增
琼脂糖凝胶电泳检测结果显示,提取RNA的28S、18S、5S条带清晰,且A260/A280>1.9,表明RNA完整性较好(图1)。扩增得到的目的片段条带单一,大小均在100 bp左右,测序结果与原始设计序列的长度及碱基顺序完全相同(图2)。

图1 草菇V23和VH3菌丝总RNA的电泳图
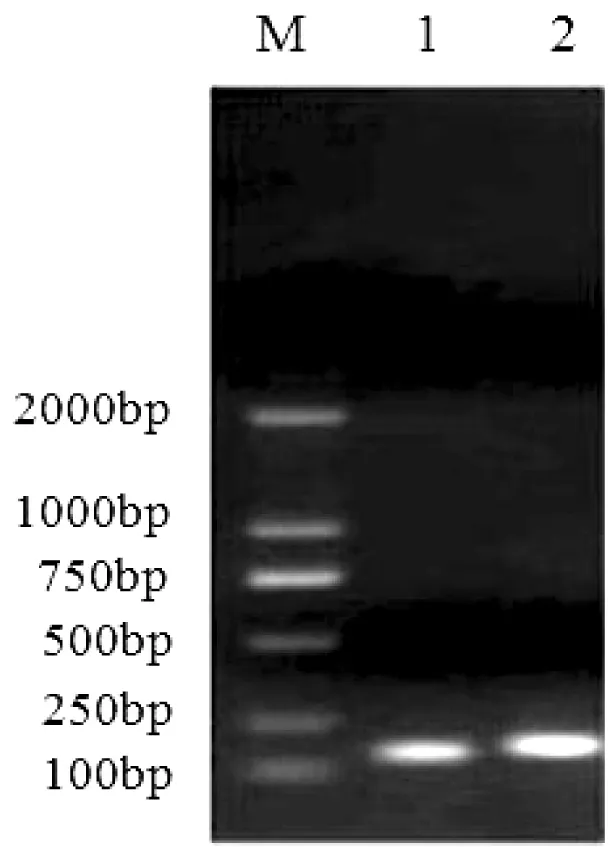
图 2 目的基因与内参基因扩增片段
M—DL2000 Marker; 1—tub; 2—gr
其中微管蛋白基因的目的片段长度为114 bp(CCAACACTACCGCTATCTCCTCGGCTTGGAGTCGCCTTGATCACAAGTTCGACCTCCTCTATTCGAAGCGTGCTTTCGTGCATTGGTACGTTGGTGAGGGTATGGAGGAAGGTG)
谷胱甘肽还原酶基因的目的片段长度为125 bp(CAAAACGTGTCGCTGTCGTAGGTGCTGGGTACATTGCAGTCGAACTGGCTGGCATTTTCAATGCCCTGGGCAGTGAAACTCACTTGATCATTCGTTATGATCGTGTTTTGAGGCGATTTGACCCC)
2.2 标准曲线与溶解曲线的构建
含有gr的质粒标准曲线如图3所示,标准曲线的斜率为-3.345,R2为1,基因扩增效率为99.05%,与内参基因的扩增效率相近,并且接近于1。对相同稀释点作差得到△CT(对应稀释倍数的CTgr-CTtub),并以cDNA稀释点作为横坐标,获得线性方程的斜率为0.0038,表明gr可以使用△△CT法进行定量。图4是gr经real-time PCR扩增后的熔解曲线,熔解曲线在84℃时出现单一峰,表明gr呈特异性扩增。
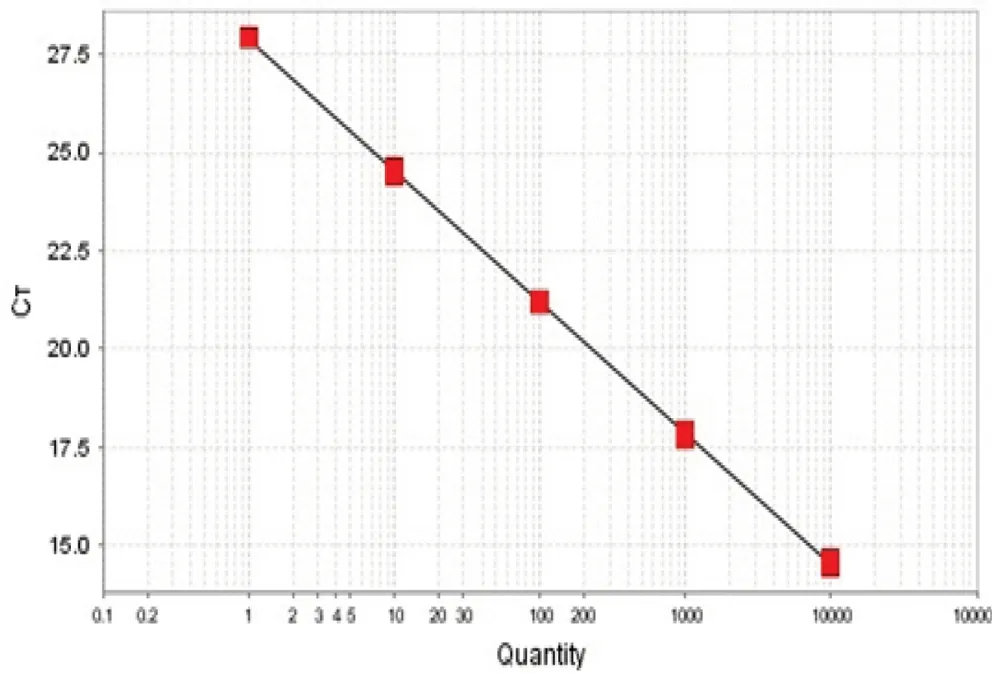
图3 草菇谷胱甘肽还原酶基因的标准曲线

图4 草菇谷胱甘肽还原酶基因的扩增熔解曲线
2.3 低温胁迫下草菇谷胱甘肽还原酶基因的表达变化
低温处理后草菇两菌株的gr和tub经荧光定量扩增后得到CT值,计算获得gr的相对含量。
2-△△CT[注:△△CT=(CTgr-CTtub)处理组-(CTgr-CTtub)对照组]
在正常生长条件下即0 h对照组,草菇菌株V23菌丝内的gr相对表达量要高于VH3;经低温处理后,两菌株的gr相对表达量变化趋势基本一致,同一菌株内低温处理组的gr相对表达量均高于各自0 h对照组(低温处理2 h和VH3中低温处理8 h除外,图5)。其中V23在低温处理的最初2 h,gr的相对表达量呈下降趋势,在低温处理4 h时,其相对表达量上升至V23 0 h的1.78倍;随着低温处理时间的延长,虽然在6 h、8 h时出现下降的趋势,但是其含量始终高于对照组,分别达到对照组的1.05倍和1.36倍。VH3的gr相对表达量,在低温胁迫的最初2 h时也呈现下降的趋势,到低温处理4 h时,其相对表达量上升至VH3 0 h的1.47倍;之后随着低温处理时间的延长,gr的相对表达量呈逐渐下降的趋势。草菇两菌株在相同的低温处理时间下,V23的gr相对表达量要明显高于VH3。

图 5 低温处理不同时间下V23和VH3菌丝中谷胱甘肽
3 讨论
低温胁迫诱导产生过多的ROS物质是加速草菇衰老的重要原因,ROS能使膜极性脂质发生改变,从而影响细胞膜的选择渗透功能。GSH是一种非常重要的非酶促抗氧化剂[15-16],它通过GR催化还原GSSG而得到。在GSH结构中半胱氨酸侧链基团上连有一个活泼巯基,它是GSH许多重要生理功能的结构基础,在逆境下能保护体内重要酶蛋白的巯基不被氧化、灭活,有助于酶活性的发挥[17]。在正常的生理条件下,GSH的浓度是GSSG浓度的10~100倍[18],较高含量的GSH与细胞的氧化还原状态关系密切。
为了深入了解催化GSH生成的gr在草菇低温应答过程中的表达变化与作用,本试验以低温敏感型菌株V23和耐低温型菌株VH3为研究对象,利用实时荧光定量PCR技术,检测低温胁迫对gr表达的影响,并找出该基因在草菇2个菌株中的表现差异。定量结果显示,除低温处理8 h外,草菇菌株V23和VH3的gr相对表达量在低温处理期间的变化趋势一致。两菌株的gr相对表达量均在低温处理2 h时出现降低,表明在低温胁迫初期,V23和VH3的gr基因转录受到抑制,表达量出现下降。之后随着低温处理时间的延长,同一菌株内低温处理组的gr相对表达量均高于各自的0 h对照组(VH3低温处理8 h除外),表明两菌株的gr转录水平得到提高,可能将更多的GSSG还原为GSH以应对低温胁迫。但无论在正常生长条件下,还是在整个低温处理期间,V23菌株的gr相对表达量始终高于VH3,推测可能VH3中的GR活性更高,或者VH3借助其它抗氧化剂、抗氧化酶来清除过多的ROS物质,使其比V23更耐低温,这些还需要进一步试验验证。本试验通过对低温胁迫下谷胱甘肽还原酶基因表达变化的研究,为深入探索草菇低温自溶机制奠定了基础。
[1]郭 倩, 陈明杰, 凌霞芬. 草菇周年栽培技术研究[J]. 食用菌学报, 2002, 9(4): 29-32.
[2]邓优锦, 朱 坚, 谢宝贵. 图说草菇栽培关键技术[M]. 北京: 中国农业出版社, 2011.
[3]刘世强, 杨丽卿, 郭丽琼, 等. 草菇ras启动子区域的克隆及其序列分析[J]. 食用菌学报, 2004, 11(1): 1-6.
[4]Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930.
[5]张 锐, 兰文升, 贺秀媛, 等. 贝类毒素大田软海绵酸OA对小鼠肝脏还原型谷胱甘肽GSH、过氧化氢CAT、超氧化物歧化酶SOD的影响[J]. 生物学杂志, 2014, 31(1): 11-14.
[6]Belozerskaya T A, Gessler N N. Reactive oxygen species and the strategy of antioxidant defense in fungi: a review[J]. Applied Biochemistry and Microbiology, 2007, 43(5): 506-515.
[7]袁平戈, 张大志. 还原型谷胱甘肽的作用机制及临床应用[J]. 药品评价, 2006, 3(5): 385-390.
[8]Grant C M, Collinson L P, Roe J H, et al. Yeast glutathione reductase is required for protection against oxidative stress and is a target gene for yAP-1 transcriptional regulation[J]. Molecular Microbiology, 1996, 21(1): 171-179.
[9]丁 燏, 缪锦来, 王全富, 等. 温度对南极衣藻ICE-L(Chlamydomonassp. ICE-L)谷胱甘肽含量及其相关酶活性的影响[J]. 海洋与湖沼, 2006, 37(2): 154-161.
[10]韩春然, 马永强, 苏蕾蕾. 谷胱甘肽对酵母抗冻能力的影响[J]. 食品添加剂, 2010, 31(5): 311-312.
[11]姜 威, 赵 妍, 汪 虹, 等. 低温胁迫下草菇甘油-3-磷酸酰基转移酶基因表达变化的研究[J]. 菌物学报, 2014, 33(2): 334-340.
[12]韩业君, 曹 晖, 陈明杰, 等. 草菇耐低温菌株的诱变选育与鉴定[J]. 菌物学报, 2004, 23(3): 417-422.
[13]汪 虹, 陈明杰. 草菇冷诱导Cor3基因实时荧光定量PCR标准品质粒和标准曲线的构建[J]. 食用菌学报, 2007, 14(3): 16-19.
[14]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25(4): 402-408.
[15]Penninckx M. A short review on the role of glutathione in the response of yeasts to nutritional, environmental, and oxidative stresses[J]. Enzyme and Microbial Technology, 2000, 26(9/10): 737-742.
[16]Grant C M. Role of the glutathione/glutaredoxin and thioredoxin systems in yeast growth and response to stress conditions[J]. Molecular Microbiology, 2001, 39(3): 533-541.
[17]贾 贞, 王 丹, 游 松. 谷胱甘肽的研究进展[J]. 沈阳药科大学学报, 2009, 26(3): 238-242.
[18]Moan N L, Clement G, Maout S L, et al. TheSaccharomycescerevisiaeproteome of oxidized protein thiols contrasted functions for the thioredoxin and glutathione pathways[J]. The Journal of Biological Chemistry, 2006, 281(15): 10420-10430.
The relative expression of glutathione reductase gene inVolvariellavolvaceaduring low temperature stress
ZHAO Yan1, MA Dan-dan1, 2, JIANG Wei1, YAN Su-ya1, CHEN Ming-jie1
(1. National Engineering Research Center of Edible Fungi; Key Laboratory of Edible Fungi Resources and Utilization (South), Ministry of Agriculture; Shanghai Key Laboratory of Agricultural Genetics and Breeding;Institute of Edible Fungi, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China;2. Editorial Department of ACTA EDULIS FUNGI, Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences, Shanghai 201403, China)
Glutathione reductase (GR) plays an important role in response to abiotic stress in fungi. The nucleotide sequence ofgrgene was obtained by BLAST search in whole-genome database ofVolvariellavolvacea. The study was performed to examine differential transcriptional responses ofgrgene to low temperature stress in mycelia of twoVolvariellavolvaceastrains, V23 (cold-sensitive) and VH3 (cold-tolerant). The relative expression levels ofgrgene in the two strains were measured by real-time PCR. Results showed that the relative expression ofgrgene in V23 decreased at 2 h. Compared to V23 at 0 h, it increased from 4 h to 8 h, with the fold of 1.78, 1.05 and 1.36, respectively. The relative expression ofgrgene in VH3 also decreased at 2 h. Compared to VH3 at 0 h, it increased from 4 h to 6 h, with the fold of 1.47 and 1.41, respectively. However, it decreased again at 8 h with 0.72 fold of VH3 at 0 h. The relative expression ofgrgene in V23 was higher under both normal condition and low temperature stress than that in VH3, which indicated that the higher expression ofgrgene in this study may not be associated with the better adaptation ofVolvariellavolvaceato low temperature stress.
Volvariellavolvacea; low temperature; glutathione reductase gene; real-time quantitative PCR
2014-07-10;
2014-08-11
国家自然科学基金项目(31301828);上海市科技兴农重点攻关项目(2011第1-2号)
赵 妍,博士,助理研究员,主要从事食用菌生理生化与功能基因研究,E-mail:jiandan289@126.com;
陈明杰,博士,研究员,主要从事食用菌遗传育种与功能基因研究,E-mail:mjchen@saas.sh.cn。
S646.1+3
A
2095-1736(2015)01-0044-04
doi∶10.3969/j.issn.2095-1736.2015.01.044

