CODEHOP法设计引物克隆中华绒螯蟹5-ht1和5-ht2受体基因片段及序列分析
徐泽文, 杨筱珍, 黄 坚, 李 彤, 杨志刚, 王 春, 成永旭
(上海海洋大学 水产种质资源发掘与利用教育部重点试验室,上海 201306)
CODEHOP法设计引物克隆中华绒螯蟹5-ht1和5-ht2受体基因片段及序列分析
徐泽文, 杨筱珍, 黄 坚, 李 彤, 杨志刚, 王 春, 成永旭
(上海海洋大学 水产种质资源发掘与利用教育部重点试验室,上海 201306)
根据已报道的中华绒螯蟹近缘物种的5-ht1r和5-ht2r氨基酸序列保守区,利用CODEHOP设计了两对简并引物,采用RT-PCR法扩增得到了中华绒螯蟹5-ht1r和5-ht2r部分片段并克隆到pMD-19T载体。测序结果表明扩增到的中华绒螯蟹5-ht1r和5-ht2r片段长分别为366 bp和177 bp,编码121和58个氨基酸。经BLASTp分析显示,中华绒螯蟹5-ht1r与罗氏沼虾(Macrobrachiumrosenbergii)和克氏原螯虾(Procambarusclarkii)的5-ht1r同源性高达98%,而中华绒螯蟹5-HT2R与断沟龙虾(Panulirusinterruptus)和克氏原螯虾(Procambarusclarkii)5-ht2r同源性高达95%。
CODEHOP;中华绒螯蟹;5-ht1r;5-ht2r;克隆
在十足目甲壳类动物中,所有机体器官系统受到神经系统和内分泌系统的综合调控。神经内分泌系统控制着机体蜕皮、生长和性成熟等多种生理过程,而神经激素的合成与释放受到生物胺的调节[1-2]。5-羟色胺(5-Hydroxytryptamine, 5-HT)作为一种单胺类神经递质,其普遍存在于脊椎动物和无脊椎动物当中,通过影响神经内分泌系统中神经激素的合成与释放能够间接对多种生理作用和行为进行调控[3-5]。有研究报道5-HT能够刺激副交感神经进而诱导未孕家兔(Oryctolaguscuniculus)的子宫收缩[6];对欧洲黑蜂(Apismelliferamellifera)的研究发现5-HT可以抑制其进食,刺激肠道肌肉收缩对其消化产生影响[7];将罗氏沼虾(Macrobrachiumrosenbergii)幼体浸泡于一定浓度的5-HT后,促进了其生长以及体色的形成[8]。这些调控均是通过5-HT与其多种不同受体结合而实现的。
在哺乳动物当中,根据保守结构和信号机制的不同将5-HT受体分为7类,其中6类是G-蛋白偶联受体(5-HT1, 5-HT2, 5-HT4,5-HT5, 5-HT6, 5-HT7),另外一类(5-HT3)是配体门控离子通道[9]。现已发现5-HT1和5-HT2受体,参与了5-HT调节少数鱼和虾类争胜行为[10]、神经细胞再生与凋亡[11-12]和色素扩散[13]的生理过程,但目前有关水产动物中5-HT受体的报道较少。
中华绒螯蟹(Eriocheirsinensis)俗称河蟹或大闸蟹,属于甲壳纲(Crustacea)、十足目(Decapoda)、绒螯蟹属(Eriocheir),由于其具有很高的营养价值且风味独特,是中国一种重要的淡水经济品种。目前有关中华绒螯蟹5-HT功能的研究较少,梁攀等[14]研究发现将中华绒螯蟹仔蟹浸泡于5-HT一段时间后可能会促进其生长;孙金生等[15]利用全细胞膜片钳技术,检测到5-HT能够调控中华绒螯蟹神经节髓端X器官的内分泌细胞兴奋性及分泌活动,诱导CHH和MIH的释放;杨丽丽等[16]的研究表明注射低剂量5-HT能够减少中华绒螯蟹的蜕壳时间,而高剂量的5-HT会增加蜕壳时间。这些报道说明5-HT对中华绒螯蟹的生长和发育有一定影响,但均未涉及到5-HT受体类型以及5-HT与哪些受体结合发挥其生理作用。本研究利用CODEHOP法设计了两对简并引物,首次克隆得到了中华绒螯蟹5-ht1r和5-ht2r的部分cDNA片段,为后续进一步研究5-HT在中华绒螯蟹生长、繁殖以及行为等方面所起的作用提供支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验所用中华绒螯蟹成蟹取自上海海洋大学崇明基地。取其肠道组织,迅速放入液氮中速冻后,置于-80℃冰箱中冻存备用。
1.1.2 主要试剂
RNAisoTMPlus(总RNA提取)试剂盒、Reverse Transcriptase反转录试剂盒、dNTPs、rTaq聚合酶、pMD-19T 载体、Agarose琼脂糖、DL2000 Marker均购自大连宝生物工程有限公司(Takara);琼脂糖凝胶DNA回收试剂盒、TOP10感受态细胞、氨苄青霉素、X-Gal、IPTG购自天根生化科技有限公司;LB培养基购自上海生工生物工程有限公司;其它试剂均为国产分析纯。
1.2 方法
1.2.1 总RNA的提取与反转录
从冰箱中取出冻存的中华绒螯蟹组织,利用RNAisoTMPlus试剂盒提取总RNA。操作步骤参照说明书上的方法进行,并用Recombinant DNase I (Takara)去除所抽提总RNA样品中残留的微量DNA。以1%的琼脂糖凝胶电泳检测RNA的完整度,使用微量紫外分光光度计(Q5000)检测RNA的纯度。确认RNA无降解后,按照反转录试剂盒说明书的步骤,以1 μg中华绒螯蟹肠道总RNA为反转录模板合成第一链cDNA,其余置于-80℃冰箱中保存。
1.2.2 简并引物设计
首先查找中华绒螯蟹的近缘物种的氨基酸序列,本研究选取了一些节肢动物门的氨基酸序列。
1)5-ht1r氨基酸序列:罗氏沼虾Macrobrachiumrosenbergii(GeneBank登录号:ACB38667.1)、克氏原螯虾Procambarusclarkii(GeneBank登录号:ABX10973.1)、斑节对虾Penaeusmonodon(GeneBank登录号:AAV48573.1)和断沟龙虾Panulirusinterruptus(GeneBank登录号:AAS18607.1)。
2)5-ht2r氨基酸序列:罗氏沼虾Macrobrachiumrosenbergii(GeneBank登录号:ABM01873.1)、克氏原螯虾Procambarusclarkii(GeneBank登录号:ABX10972.1)、断沟龙虾Panulirusinterruptus(GeneBank登录号:AAS57919.1)、果蝇Drosophilamelanogaster(GeneBank登录号:AGP51353.1)、意大利蜂Apismellifera(GeneBank登录号:CBX90121.1)、家蚕Bombyxmori(GeneBank登录号:XP_004923092.1)和印度跳蚁Harpegnathos saltator (GeneBank登录号:EFN80760.1)。
使用CODEHOP在线程序(http://blocks. fhcrc.org/blocks/)设计上下游简并引物(表1)。设计的基本流程如下:查找相应基因在NCBI的蛋白数据库—下载近缘物种该基因所编码的氨基酸序列(格式应一致如FASTA格式)—递交备选序列—Block Maker—Block result — CODEHOP—设置相应参数—搜索简并引物—筛选合适的上下游引物。对搜索主要参数的设定为:Maximum core degeneracy: 128, Target clamp temperature: 60℃, codon usage table:Litopenaeusvannamei。进行引物的筛选时应尽可能遵循简并度较小、Tm值较高、上下游引物间距离尽可能大的原则。引物的合成由上海生工生物工程有限公司完成。

表1 5-ht1r和5-ht2r克隆所用简并引物
简并度(Degeneracy)—简并引物的种类数,等于该简并引物内所有简并碱基的简并个数之积,即共有多少种不同的引物[17]。
1.2.3 PCR扩增
PCR采用Eppendorf PCR扩增仪(Mastercycler pro S),以中华绒螯蟹肠道cDNA为模版,使用所设计的简并引物进行5-ht1r和5-ht2r片段的扩增。
PCR反应体系为25 μL: cDNA模板1 μL,dNTP Mixture (2.5 mmol/L)4 μL, 10×PCR buffer 2 μL, rTaq(5 U/μL) 0.25 μL,上下游引物(10 μmol/L)各0.5 μL,加ddH2O补足至25 μL。5-ht1r的PCR反应程序为:94℃ 预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸30 s,30个循环;最后72℃延伸10 min。5-ht2r的PCR反应程序为:94℃ 预变性5 min;94℃变性30 s,从58℃下降至54℃退火30 s,每2个循环降低2℃,72℃延伸30 s,共6个循环。接着按94℃变性30 s,52℃退火30 s,72℃延伸30 s,共进行25个循环;最后在72℃延伸10 min。
1.2.4 PCR产物的检测与克隆
在1%的琼脂糖凝胶电泳中检测PCR产物,将目的片段产物按照回收试剂盒(Tiangen)进行回收纯化。取3 μL回收产物与pMD-19T载体16℃连接过夜,将连接产物转化至TOP10感受态细胞中,而后在37℃恒温培养箱中培养进行蓝白斑筛选。通过菌液PCR对目的基因片段的插入情况进行鉴定,挑选结果为阳性克隆的菌液送至上海生工生物工程有限公司测序。
1.2.5 序列分析
将测序产物首先用NCBI的VecScreen去除载体序列,使用序列处理在线工具包SMS(http://www.bio-soft.net/sms/index.html)将获得的目的基因核酸序列翻译为氨基酸序列,然后进行BLASTp同源性比较,使用Clustal Omega (http://www.ebi.ac.uk/Tools/msa /clustalo/)、MEGA 6进行序列分析并构建系统进化树。
2 结果与分析
2.1 cDNA片段的扩增与序列测定
利用设计的2对简并引物进行5-ht1r和5-ht2r部分cDNA片段的RT-PCR,结果两对引物均扩增出特异性的条带,且片段大小与预测的结果相一致(图1)。通过电泳图可以看到,两对引物的特异性较好,没有扩增出非特异性条带。将扩增到的5-ht1r和5-ht2r的部分cDNA片段分别割胶回收并克隆进入pMD-19T载体,通过对阳性克隆测序并经BLAST比对分析两条分别为5-ht1r和5-ht2r的部分片段,获得的片段长度分别为366 bp和177 bp。

图1 5-ht1r和5-ht2r RT-PCR电泳图
1—5-ht1rRT-PCR (5-ht1rF+5-ht1rR)扩增产物琼脂糖凝胶电泳图; M1—DL500分子量标准; 2—5-ht2rRT-PCR (5-ht2rF+5-ht2rR)扩增产物琼脂糖凝胶电泳图; M2—DL2000分子量标准。
2.2 序列及同源性分析
将5-ht1r和5-ht2r两个基因片段测序获得其核酸序列后,经推导其蛋白序列长度分别为121个氨基酸和58个氨基酸(见图2和图4)。而后将它们的氨基酸序列进行BLASTp比对分析,结果显示中华绒螯蟹5-ht1r氨基酸序列与GenBank数据库中的多个物种的5-ht1r具有很高的同源性,其中与罗氏沼虾(Macrobrachiumrosenbergii)和克氏原螯虾(Procambarusclarkii)的同源性高达98%,与断沟龙虾(Panulirusinterruptus)和斑节对虾的(Penaeusmonodon)同源性也分别达到了97%和94%。而5-ht2r的氨基酸序列与断沟龙虾和克氏原螯虾5-ht2r同源性最高,达95%,与罗氏沼虾同源性为93%。使用序列在线工具包对5-ht1r和5-ht2r氨基酸序列进行比对分析,结果见图3和图5。序列分析结果表明这两种受体的基因在十足目甲壳类中具有很高的保守性。

图2中华绒螯蟹5-ht1r片段核苷酸序列及编码的氨基酸序列

图3不同物种5-ht1r氨基酸序列的相似性比较
Drosophilamelanogaster(AAY84887.1):果蝇;Antheraeapernyi(ABY85410.1):柞蚕;Gryllusbimaculatus(BAJ83479.1):双斑蟋;Periplanetaamericana(CAX65666.1):美洲大蠊;Penaeusmonodon(AAV48573.1):斑节对虾;Panulirusinterruptus(AAS18607.1):断沟龙虾;Procambarusclarkii(ABX10973.1):克氏原螯虾;Macrobrachiumrosenbergii(ACB38667.1):罗氏沼虾。

图4中华绒螯蟹5-ht2r片段核苷酸序列及编码的氨基酸序列

图5不同物种5-ht2r氨基酸序列的相似性比较
2.3 5-HT1R和5-HT2R的进化关系分析
根据5-HT1R和5-HT2R氨基酸序列的比对结果,利用MEGA 6软件中的Bootstrap和Neighbor-Joining法构建5-HT1R和5-HT2R基因系统进化树。由图6可以看出中华绒螯蟹5-HT1R与罗氏沼虾、断沟龙虾5-HT1R聚为一枝,与克氏原螯虾5-HT1R再聚为一枝,之后再与斑节对虾的5-HT1R聚为一枝,这些物种均是节肢动物门甲壳纲的种类,符合物种的亲缘关系。而在5-HT2R系统进化树中(图7),进化树首先分为两大枝,一枝由节肢动物门各物种组成,另一枝则由哺乳动物和爬行动物组成。节肢动物又分为甲壳纲与昆虫纲的二枝,中华绒螯蟹与同属于十足目的其它虾类共处于甲壳纲这一枝下,与哺乳动物和爬行动物的亲缘关系较远,符合传统分类上物种亲缘远近关系。
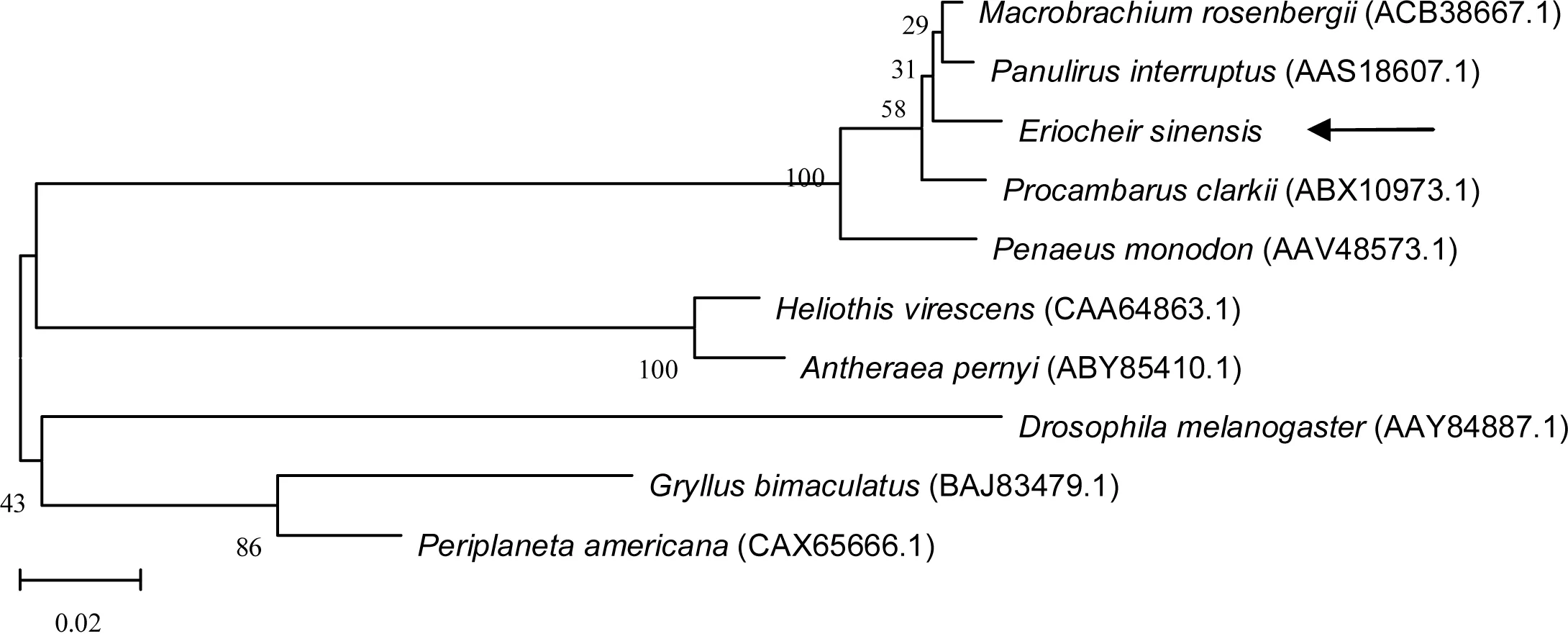
图6 采用N-J法构建的5-HT1R氨基酸序列系统进化树
箭头所指为中华绒螯蟹,自展值为1000。

图7 采用N-J法构建的5-HT2R氨基酸序列系统进化树
箭头所指为中华绒螯蟹,自展值为1000。
3 讨论
利用氨基酸序列的保守性设计简并引物是克隆未知序列的常规方法,但是使用传统设计简并引物的方法往往由于简并度过高,引物的特异性不好,致使引物的有效利用率过低。有时为了降低引物的简并度不得不减少引物的长度,但这又使得引物的Tm值较低,容易产生假阳性。笔者曾经使用传统方法设计简并引物对中华绒螯蟹的5-ht1r和5-ht2r进行扩增,但均未克隆到相关的基因片段。与通常设计的简并引物不同,利用CODEHOP法设计的简并引物由5′端非简并性夹板结构和3′核心简并区组成。5′端非简并性夹板结构最大程度地保持了与预测保守氨基酸的编码序列;3′核心简并区则是根据约4~5个保守氨基酸设计的简并引物。CODEHOP法设计引物的优点在于既减少了引物的简并度,又提高了引物的退火温度,保障了PCR产物的特异性,使得在PCR聚合反应的晚期,引物与产物的非特异性结合减少。本研究改用CODEHOP法设计了数对引物,扩增出了所需要的特异片段。在使用CODEHOP设计简并引物时需要注意的两点:1)参考所研究物种相近物种的核酸序列以及本物种的密码子偏好性,对通过CODEHOP在线设计得到多对简并引物作出适当的修改,以降低其简并度,然后再进行基因克隆;2)利用CODEHOP设计并修改好简并引物后,结合采用降落(touchdown ,TD)PCR[18]的方法不但能提高PCR的特异性,而且对于某些在常规PCR时不能扩增出来的基因,也能有较好的扩增效果。本研究中在使用扩增出5-ht2r片段的简并引物时,初始并未采用降落PCR的方法,而是使用常规PCR进行扩增,电泳结果未发现特异性的片段条带。后来在使用同样模板的情况下,利用该对简并引物结合降落PCR的方法成功扩增出了 5-ht2r的片段。实验结果表明,利用CODEHOP法设计简并引物扩增未知序列是一种高效且简便的方法。
5-羟色胺(5-Hydroxytryptamine, 5-HT) 作为体内重要血管活性物质和神经系统的重要递质,广泛参与机体各种机能活动的调节和某些病理生理过程。5-HT对心血管以及消化系统具有十分重要的作用,可因其作用部位、用药剂量以及实验条件的不同而产生极其复杂的结果。早在20世纪50年代就发现5-HT的复杂作用是通过作用于体内特异性的5-羟色胺受体(5-Hydroxytryptamine receptor, 5-HTR)而实现的[19]。5-HT及其受体对于神经系统的调控具有十分重要的作用,本实验利用中华绒螯蟹近缘物种的氨基酸序列,运用CODEHOP法设计简并引物,经RT-PCR获得了中华绒螯蟹5-ht1r和5-ht2r的部分片段,为获得这两种基因的全序列以进一步研究它们与5-HT对中华绒螯蟹的生理调节作用奠定基础。
[1]Cooke I M, Sullivan R E. Hormones and neurosecretion [J]. The Biology of Crustacea, 1982, 3: 205-290.
[2]Fingerman M, Nagabhushanam R, Sarojini R, et al. Biogenic amines in crustaceans: identification, localization, and roles [J]. Journal of Crustacean Biology, 1994, 14(3): 413-437.
[3]Zifa E, Fillion G. 5-Hydroxytryptamine receptors [J]. Pharmacological Reviews, 1992, 44(3): 401-458.
[4]Fingerman M. Crustacean endocrinology: a retrospective, prospective, and introspective analysis [J]. Physiological Zoology, 1997, 70(3): 257-269.
[5]Fingerman M. Roles of neurotransmitters in regulating reproductive hormone release and gonadal maturation in decapod crustaceans [J]. Invertebrate Reproduction & Development, 1997, 31(1-3): 47-54.
[6]Lychkova A E, De Pasquale V, Avallone L, et al. Serotonin regulates contractile activity of the uterus in non-pregnant rabbits[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2014, 165: 53-59.
[7]French A S, Simcock K L, Rolke D, et al. The role of serotonin in feeding and gut contractions in the honeybee [J]. Journal of Insect Physiology, 2014, 61: 8-15.
[8]Tangvuthipong P, Damrongphol P. 5-Hydroxytryptamine enhances larval development of the giant freshwater prawn,Macrobrachiumrosenbergii[J]. Aquaculture, 2006, 251(2): 567-572.
[9]Kroeze W K, Kristiansen K, Roth B L. Molecular biology of serotonin receptors-structure and function at the molecular level [J]. Current Topics in Medicinal Chemistry, 2002, 2(6): 507-528.
[10]Clotfelter E D, O′Hare E P, McNitt M M, et al. Serotonin decreases aggression via 5-HT1Areceptors in the fighting fishBettasplendens[J]. Pharmacology Biochemistry and Behavior, 2007, 87(2): 222-231.
[11]Zhang Y, Benton J L, Beltz B S. 5-HT receptors mediate lineage-dependent effects of serotonin on adult neurogenesis inProcambarusclarkii[J]. Neural Development, 2011, 6(1): 1-22.
[12]Hu X, Li Y, Hu Z, et al. The alteration of 5-HT2Aand 5-HT2Creceptors is involved in neuronal apoptosis of goldfish cerebellum following traumatic experience [J]. Neurochemistry International, 2012, 61(2): 207-218.
[13]Salim S, Ali A S, Ali S A. 5-HT receptor subtypes as key targets in mediating pigment dispersion within melanophores of teleost,Oreochromismossambicus[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2013, 164(2): 117-123.
[14]梁 攀, 杨筱珍, 王 春, 等. 水体中5-HT对仔蟹生长以及内源5-HT水平的影响[J].复旦学报: 自然科学版, 2011, 50(5): 640-644.
[15]孙金生, 赵景霞, 相建海. 5-羟色胺对中华绒螯蟹眼柄MTXO细胞兴奋和分泌活动的影响[J]. 水产学报, 2006, 30(4): 450-453.
[16]杨丽丽. 5-HT 对日本新糠虾 (Neomysisjaponica) 和中华绒螯蟹 (Eriocheirsinensis) 生长和发育影响的研究[D]. 上海:上海海洋大学, 2011.
[17]Linhart C, Shamir R. Degenerate primer design: theoretical analysis and the HYDEN program [J]. Methods Mol Biol,2007, 402:221-244.
[18]黄留玉. PCR最新技术原理、方法及应用[M]. 北京: 化学工业出版社, 2003: 254-257.
[19]Gaddum J H, Picarelli Z P. Two kinds of tryptamine receptor [J]. British Journal of Pharmacology, 1957, 12: 323-328.
CODEHOP PCR primers for cloning 5-ht1and 5-ht2receptor fragments inEriocheirsinensis
XU Ze-wen, YANG Xiao-zhen, HUANG Jian, LI Tong,YANG Zhi-gang, WANG Chun, CHENG Yong-xu
(Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education, Shanghai Ocean University, Shanghai 201306, China )
According to the conserved amino acid sequences of known 5-Hydroxytryptamine receptors, CODEHOP (Consensus Degenerate Hybrid Oligonucleotide Primers)software was used to design degenerate primers to obtain partial cDNA fragments of 5-HT1and 5-HT2receptors (5-ht1rand 5-ht2r) in Chinese mitten crab (Eriocheirsinensis). The fragments of 5-ht1rand 5-ht2rwere amplified by reverse transcription polymerase chain reaction (RT-PCR) and then cloned into pMD-19T vector. The sequencing results revealed that 5-ht1rand 5-ht2rfragments contain 366 and 177 base pairs, which encode 121 and 58 amino acids respectively. BLAST analysis indicated that the amino acid homology of 5-ht1rwas 98% similar toMacrobrachiumrosenbergiiandProcambarusclarkia, and the 5-ht2rwas most similar toPanulirusinterruptusandProcambarusclarkia(95%).
CODEHOP;Eriocheirsinensis; 5-ht1r; 5-ht2r; cloning
2014-08-13;
2014-09-01
国家自然科学基金(31272677);国家农业科技成果转化项目(2012GB2C000147);上海市科委科技合作专项(13231203504);上海市学术带头人计划(12XD1402700)
徐泽文,硕士研究生,主要从事中华绒螯蟹消化道功能方面的研究,E-mail:seb_341225@126.com;
成永旭,博士,教授,研究方向为甲壳动物营养繁殖,E-mail: yxcheng@shou.edu.cn。
Q78;S917.4
A
2095-1736(2015)01-0001-05
doi∶10.3969/j.issn.2095-1736.2015.01.001

