基于方证相关探讨茵陈蒿汤调控库普弗细胞功能及MAPK通路抗肝纤维化的作用机制
曹红燕 边艳琴 武 超 李建缘 刘 平,3 孙明瑜,3
(1 上海中医药大学曙光医院,上海中医药大学肝病研究所,上海,201203; 2 上海中医药大学肝肾疾病病证教育部重点实验室,上海,201203; 3 上海高校中医内科学E-研究院,上海,201203)
基于方证相关探讨茵陈蒿汤调控库普弗细胞功能及MAPK通路抗肝纤维化的作用机制
曹红燕1,2边艳琴1武 超1,2李建缘1,2刘 平1,2,3孙明瑜1,2,3
(1 上海中医药大学曙光医院,上海中医药大学肝病研究所,上海,201203; 2 上海中医药大学肝肾疾病病证教育部重点实验室,上海,201203; 3 上海高校中医内科学E-研究院,上海,201203)
目的:基于前期茵陈蒿汤类方抗肝硬化的方证病理基础结果,围绕“方-证相关”的学术内涵,提出了“方证相关时,方剂对机体基因的调控遵循‘无差错修复’原则”的假说;并探讨茵陈蒿汤对DMN诱导大鼠肝纤维化形成阶段肝组织库普弗细胞(Kupffer Cells,KCs)相关基因表达及对丝裂原活化蛋白激酶(MAPK)通路的影响。方法:采用wistar大鼠,于每周前3天连续腹腔注射0.5%二甲基亚硝胺(Dimethylnitrosamine,DMN)制备大鼠肝纤维化模型,2周末取模型组6只做动态观察。第3周初开始,在持续造模的同时给予茵陈蒿汤干预治疗到4周末,正常组与模型对照组给予等量生理盐水。4周末在3%戊巴比妥钠腹腔注射麻醉情况下,杀鼠取材,检测肝功能、肝组织病理、肝组织羟脯氨酸含量、胶原半定量,并采用基因芯片检测分析茵陈蒿汤对模型大鼠肝组织基因表达谱的影响。结果:与正常组比较,造模4周大鼠血清肝功能水平明显升高(P<0.01);病理观察肝组织炎细胞显著浸润,胶原显著沉积(P<0.01),肝组织白介素1(IL-1b)、Cd68、肿瘤坏死因子受体超家族成员14(Tnfrsf14)、肿瘤坏死因子受体超家族成员9(Tnfrsf9)、TNF受体超家族成员6(Fas)、Cd14、结缔组织生长因子(Ctgf)、Ⅰ型胶原α2(Col1a2)、胰岛素样生长因子结合蛋白(Igfals)、胰岛素样生长因子1(Igf1)、胰岛素样生长因子结合蛋白1(Igfbp1)、基质金属蛋白酶12(Mmp12)、基质金属蛋白酶2(Mmp2)、基质金属蛋白酶23(Mmp23)、趋化因子配体21(Ccl21)、蛋白激酶Cβ(Prkcb)基因表达明显上调,MAPK通路被激活。经2周治疗后茵陈蒿汤能显著降低DMN诱导的大鼠血清肝功能水平,抑制组织炎细胞的浸润与坏死,胶原沉积,并下调了肝组织IL-1b、Cd68、Tnfrsf14、Tnfrsf9、Fas、Cd14、Ctgf、Col1a2、Igfals、Igf1、Igfbp1、Mmp12、Mmp2、Mmp23、Ccl21、Prkcb基因的表达,抑制了MAPK通路的活化。通过全基因芯片的分析,在茵陈蒿汤干预治疗后基因表达得到了不同程度的修复。结论:验证了“方证相关时,方剂对机体基因的调控遵循‘无差错修复’原则”的假说;茵陈蒿汤显著抑制DMN诱导肝纤维化形成,其机制可能是调控了KCs,抑制相关炎症因子的释放,同时可能参与调控MAPK通路,从而达到抗肝纤维化的作用。
中医方证相关;茵陈蒿汤;肝纤维化;无差错修复原则;基因分析
“方证相关”是指一个方剂内的药味及其配伍关系与其针对的病证病机或病理环节之间具有高度相关性或反应性。“方证相关”强调了方药与其作用对象——病证之间的相互作用,即方剂的功用是特定方药与其作用对象特定病证之间相互作用的结果[1]。方证相关与“系统生物学”注重研究组分之间的相互作用的理念不谋而合,即强调方药与其作用对象——病证之间的相互作用,也就是说方剂的功效是方药作用于特定病证而显示出的,表现为方剂功效对证具有依赖性或选择性,只有方证相关时,才能显现出应有的疗效,而一旦离开其所相对应的病证,可能就收效甚微甚至失去治疗作用。
茵陈蒿汤由茵陈蒿、栀子和大黄组成,首载于《伤寒论》,为临床上治疗湿热内蕴型肝胆疾病的首选方剂。《伤寒论》中从主治病证、制方思想等方面考察各方,分析其与茵陈蒿汤之间的相似性,确定入选茵陈蒿汤类方的方剂:茵陈蒿汤、栀子柏皮汤、茵陈五苓散。栀子柏皮汤由栀子、黄柏和甘草组成,也具有清热利湿的功效,是治疗黄疸之热重于湿证的代表方剂。茵陈五苓散由茵陈蒿和五苓散(具有利水渗湿,温阳化气的功效)组成,具有利湿清热的作用,是治疗黄疸之湿重于热证的代表方剂。课题组前期在中医药理论指导下,采用茵陈蒿汤及其类方(栀子柏皮汤、茵陈五苓散、甘露消毒丹等),以温阳利湿的茵陈四逆汤作为对照,以二甲基亚硝胺(DMN)、四氯化碳(CCl4)和胆管结扎等大、小鼠慢性肝损伤、肝纤维化模型,采用分子生物学、中药化学、药理学和计算生物学等多学科交叉综合手段,分别从不同层次、不同水平研究茵陈蒿汤类方的(经)方-证(候)-效(应)关系;研究结果表明茵陈蒿、栀子柏皮汤和茵陈蒿五苓散可以显著抑制DMN诱导的大鼠肝纤维化、肝硬化模型[2-7],而且茵陈蒿汤显著修复了DMN模型的DNA损伤,而对CCl4诱导的肝硬化模型,却不显效,甚至出负向调节,加重损伤[6]。
如果假定动物疾病模型存在中医“证”的内涵,根据“方证相关”理论,这种相关性的高低是根据方剂所体现出的治疗效果所判定的,即治疗效果越好,那么方与证的相关程度越高,反之则相关程度越低。DMN诱导的大鼠肝纤维化模型存在湿(瘀)热内蕴证,且湿(瘀)热皆重,与茵陈蒿汤方证相关度最高,所以茵陈蒿汤有效[2-6]。偏于清热或者偏于利湿的栀子柏皮汤和茵陈五苓散仅能改善个别指标,都很难获全效[5]。而茵陈四逆汤不但不能改善任何指标,而且还加重了DMN诱导的大鼠肝脏的炎症和肝纤维化[7]。
基于前期“茵陈蒿汤类方抗肝硬化的方证病理基础研究”结果,我们围绕“方-证相关”的学术内涵,提出了“方证相关时,方剂对机体基因的调控遵循‘无差错修复’原则”的假说。
肝纤维化是指肝脏内弥漫性细胞外基质(特别是胶原物质)过度沉积,是机体对各种病因引起的慢性肝损伤后的一种损伤修复反应[8],是肝硬化的早期可逆阶段。持续性损伤因子的过度刺激,使肝脏中瘢痕组织大量沉积,影响正常肝组织的超微结构并最终导致肝硬化。纤维形成过程包括致病因素、效应细胞、信号及进行信号调节的分子,最终导致细胞外基质(ECM)大量沉积。肝细胞死亡或受损是肝纤维化链式反应的开始,它可由细胞毒素、病毒感染直接引起,或肝细胞代谢障碍所至,也可由激活的免疫系统间接引起。KCs是肝脏内重要的非实质细胞,虽仅占肝脏体积的2%,却承担着机体单核吞噬细胞系统功能的80%~90%,在维持机体内环境恒定上起重要作用[9]。KCs不但分泌致炎因子,而且能够直接分泌胶原,在肝纤维化的发生发展中发挥重要作用,而且在肝纤维化的逆转过程中,也发挥了重要的作用[10]。
本实验通过DMN诱导的肝纤维化大鼠模型,采用具有清热利湿作用的茵陈蒿汤干预治疗,通过观察动物的整体状况、肝功能、病理组织学、肝组织羟脯氨酸含量,综合判断茵陈蒿汤的治疗效果。通过对模型组及用药组的全基因芯片的分析,验证方证相关时,方剂对机体基因的调控遵循‘无差错修复’原则的假说;寻找KCs分泌相关的差异基因,并通过通路查找KCs分泌的相关因子与MAPK通路的相互关系,构建相关网络图,旨在进一步探讨KCs活化后与MAPK通路的关系及其肝纤维化进程中的作用。
1 材料与方法
1.1 材料
1.1.1 动物 Wistar雄性大鼠,体重(150±10)g,清洁级,购自中国科学院上海实验动物中心,动物合格证编号:2007000537089,生产许可证号:SCXK(沪)2007-0005。上海中医药大学实验动物中心清洁区动物房饲养、造模和观察,自由饮食,动物房使用许可证号:SYXK(沪)2009-0069。
1.1.2 药物 所用药物均按《中华人民共和国药典》2000年版中的规定,采用道地药材,生药学专家鉴定,保存样品备查。统一由上海中医药大学附属曙光医院国家中医药管理局中药制剂中心(国家中医药管理局三级实验室)一次制备后冷冻保存。方中药物剂量均为65 kg体重成人的1 d用量。茵陈蒿汤方由茵陈蒿18 g、栀子10 g、大黄6 g组成。将栀子(1 kg)与大黄(0.6 kg)制成粗粉末,与茵陈蒿(1.8 kg)一起水煎两次,药汁浓缩成浸膏,真空干燥后冷藏保存。生药总重量为3.4 kg,真空干燥后重量为0.565 kg,每克含生药6.018 g。
1.1.3 试剂 DMN,购自日本东京化成株式会社(批号:MAL05),TRIS,北京鼎国昌盛生物科技有限责任公司,批号:1BQ100150;氯化钠注射液,上海长征富民金山制药有限公司,批号:12050603;羟脯氨酸(Hydroxyproline,HYP)标准品,日本ナカティテスク株式会社,批号:MIR8282;高氯酸,分析纯,上海金鹿化工有限公司,批号:F20110809。Alpha-Actin(Smooth Muscel),Rabbit Monoclonal Antibody,购买自Epitomics公司,货号:5264-1;苏木素伊红(HE)染色试剂盒,上海威奥生物科技有限公司,产品编号:WH1144。盐酸,分析纯,批号:20100426;柠檬酸三钠,分析纯,批号:F20101021;一水合柠檬酸,分析纯,批号:F20101102;无水乙酸钠,分析纯,批号:F20090908;无水乙醇,分析纯,批号:20120410;乙醇(95%),分析纯,批号:20101019;二甲苯,分析纯,批号:20120208;30%过氧化氢,分析纯,批号:20120105;异丙醇,分析纯,批号:20120528;4-(二甲氨基)苯甲醛(P-Dimethylaminobenzal),批号:F20110929;氯氨-T(Chloramines-T),批号:T20101116;羟甲基纤维素钠,批号:F20080523;吐温80,批号:F20110726;均购自国药集团化学试剂有限公司。血清丙氨酸氨基转移酶(Alanine Aminot Ransfer Ase,ALT)测定试剂盒,货号C009-2;血清天冬氨酸氨基转移酶(Aspartate Aminot Ransfer Ase,AST)测定试剂盒,货号C0010-2;血清白蛋白(Albumin,ALB)测定试剂盒,货号A028-1;血清总胆红素(Total Bilirubin,TBil)测定试剂盒,货号C018,均购自南京建成生物工程研究所。T RIzo l、杂交试剂盒、体外转录的标记试剂盒、单循环cDNA合成试剂盒、生物素化抗体、链霉素和藻红蛋白等试剂及基因芯片扫描仪3000、基因芯片洗涤工作站(Affymetrix Fluidics Station 450)、Affymet rix基因芯片杂交炉640、GeneChipó操作软件1.2等仪器、软件均由上海生物芯片公司提供。
1.2 方法
1.2.1 模型制备 参照Ala-Kokko方法造模[11]。模型组大鼠以2 mL/kg剂量于每周前3d连续腹腔注射0.5%的DMN溶液(以0.9%氯化钠溶液稀释),共4周。正常对照组大鼠腹腔注射等量的0.9%氯化钠溶液。
1.2.2 分组给药 大鼠按体质量分层随机的方法分为正常组(10只)、模型组(12只)、茵陈蒿汤组(10只)。模型组与各给药组均予以DMN造模。从造模第3周开始,各中药干预组于继续造模的同时按成人(70 kg)体质量日用量的8倍,即每天茵陈蒿汤0.967 g/kg(相当于生药3.886 g/kg),临用前用蒸馏水稀释,以10 mL/kg大鼠体质量的剂量灌胃给药,每日1次,共2周;正常组与模型组以同体积0.9%氯化钠溶液灌胃。
1.2.3 样品的采集与处理 在实验4周末,大鼠用3%戊巴比妥钠以2 mL/kg体质量剂量腹腔注射麻醉后,仰卧位固定,打开腹腔,观察肝脾的色、质、形态等情况。经下腔静脉采血,摘取肝脾,称重后,从肝脏最厚一叶切取1.0 cm×1.0 cm大小肝组织2块,10%中性福尔马林固定,其余肝组织装管于-70 ℃保存备用。选取一套标本脱水、包埋、切片,HE及天狼猩红染色,观察组织病理学变化。所采血液4 ℃静置3 h后,3 000 r/min离心15 min,分离血清,-70 ℃保存备用。
1.2.4 观察项目与方法
1.2.4.1 一般情况 包括大鼠的体重、肝重、脾重、腹水及死亡情况,并计算肝体比、脾体比等。
1.2.4.2 肝组织病理 肝组织苏木精-伊红染色(HE)及天狼猩红染色观察肝脏组织学变化。胶原纤维增生程度分期标准如下。0期:正常肝脏,无明显胶原纤维增生;Ⅰ期:胶原纤维增生,中央静脉和门脉区有少量星状胶原纤维束放散,但无间隔形成;Ⅱ期:胶原纤维增生,中央静脉和门脉区结缔组织变厚,由此向四周伸出纤维索,形成不完全间隔;Ⅲ期:胶原纤维大量增生,有个别菲薄的完全间隔形成,或较厚的不完全间隔即将形成假小叶;Ⅳ期:胶原纤维大量增生,完全纤维间隔较厚,假小叶大量形成。
1.2.4.3 肝功能检测 谷草转氨酶(AST)、谷丙转氨酶(ALT)、白蛋白(Alb)和总胆红素(Tbil)含量均按照南京建成生物工程研究所试剂盒说明书测定。
1.2.4.4 肝组织Hyp含量测定 参照Jamall方法[12]测定肝组织Hyp含量。
1.2.4.5 肝组织基因芯片杂交实验 提取各组肝脏总核糖核酸(RNA),纯化,合成互补脱氧核糖核酸(cDNA),纯化,生物素标记互补核糖核酸(cRNA),片断化cRNA,杂交,洗脱、染色、扫描芯片。基因芯片:Afymetrix Rat 2302.0基因表达谱芯片,共载基因探针31099个。RNA的抽提采用T RIzol试剂盒。用纯化的RNA合成双链cDNA,生物素标记的cRNA的合成参考BioArrayTM HighYieldTM RNA转录标记试剂盒方法。将cRNA片段杂交于Afymetrix Rat 2302.0芯片。基因芯片的数据处理:首先将信号进行标准化和基于模型的表达指数(Mode-l Based Expression Index,MBEI)分析,得出校正后的数值,用于差异基因分析。特征性基因表达谱分析采用聚类分析法。特征性基因的筛选采用Fold change法,两个芯片的每个基因之间倍数通过表达指数比值得出,以识别特征性基因,并用MBEI的标准误差来计算倍数的可信区间,本研究在组间进行比较时,以倍数的可信下限作为基因表达上调或下调的评判标准。
1.2.4.6 统计学方法 采用SPSS 15.0统计软件。计量资料以ANOVA程序进行单因素方差分析、q检验,并用LSD进行两两比较,等级资料采用Ridit分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 各组大鼠体重、肝重、脾重、肝体比、脾体比及腹水发生率情况见图1。各组均无大鼠死亡。与正常组比较,模型组肝体比值显著降低(P<0.01),提示大鼠肝脏在纤维化形成过程中明显缩小;与模型组比较,茵陈蒿汤组肝体比值明显升高(P<0.01)。模型组大鼠腹水出现率为83.3%,茵陈蒿组汤组腹水发生率为30.0%。

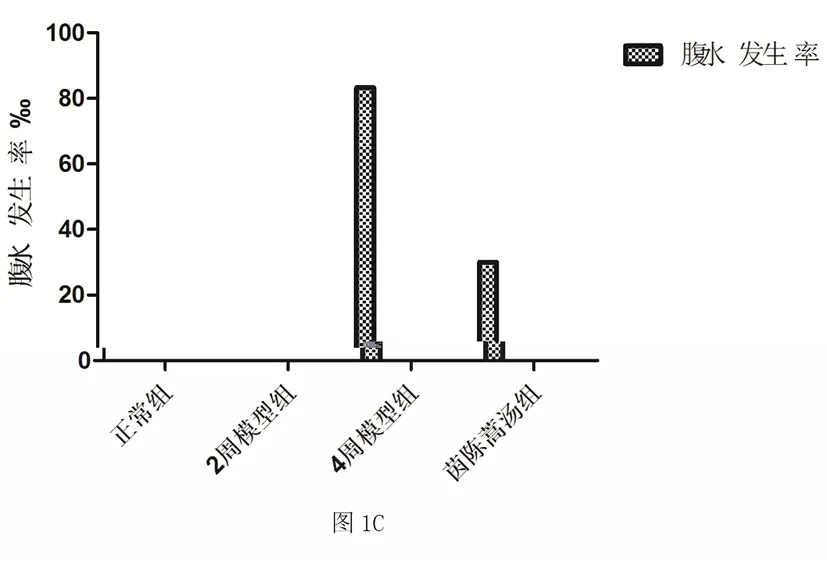
图1 各组大鼠体重、肝重、脾重、肝体比、 脾体比及腹水发生率情况
注:A:大鼠体重、肝重、脾重重量,B:大鼠肝体比、脾体比比率,C:模型组及茵陈蒿汤组腹水率,与正常组比较,*P<0.05,**P<0.01;与4周模型组比较,#P<0.05,##P<0.01。
2.2 肝功能 与正常组比较,随着模型的加重,模型组大鼠ALT、AST、Tbil逐渐升高,4周时达到高峰,且显著高于正常组(P<0.01或P<0.05)。血清Alb含量逐渐降低,4周时显著低于正常(P<0.01)。与12周模型对照组比较,茵陈蒿汤组AST、ALT、Alb、Tbil显著改善(P<0.05或P<0.01)(图2)。
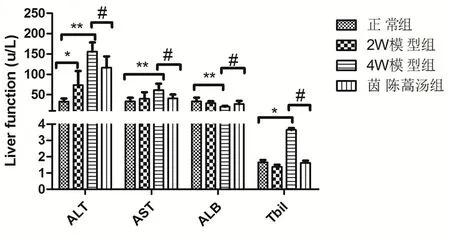
图2 茵陈蒿汤对DMN大鼠肝纤维化模型肝功能的影响
注:与正常组比较,*P<0.05,**P<0.01,与模型组比较,#P<0.05,##P<0.01。
2.3 肝组织病理 HE染色,正常组大鼠肝细胞结构清晰,排列紧密,肝细胞索由中央静脉向四周呈放射状排列,其间有不规则的肝窦,中央静脉及汇管区结构正常。与正常组比较,模型组大鼠肝组织出现较广泛的肝细胞肿胀,小叶中心性出血及灶状坏死,伴随大量的炎细胞浸润,纤维组织大量增生,肝小叶结构紊乱。与模型组比较,茵陈蒿汤组肝细胞索较为规则,肝细胞变性坏死及炎细胞浸润明显减轻(图3A)。
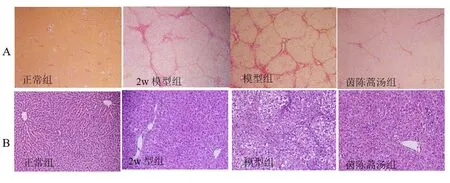
图3 茵陈蒿汤对DMN诱导的肝纤维化大鼠肝组织病理 及胶原增生的影响
注:A、HE染色,×200;B、天狼星红染色,×100。
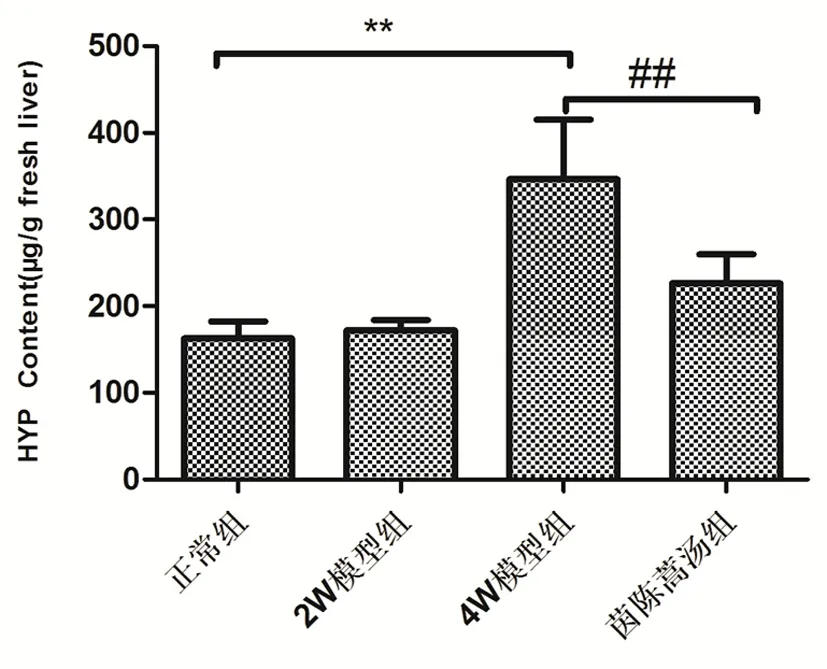
图4 茵陈蒿汤对DMN大鼠肝纤维化模型肝组织 羟脯氨酸含量的影响
注:与正常组比较,*P<0.05,**P<0.01,与模型组比较,#P<0.05,##P<0.01。
天狼猩红染色,正常组仅血管壁见少量纤维沉积。与正常组比较,模型组弥漫分布大量增生的胶原纤维,分割肝小叶形成假小叶,胶原纤维粗大形成间隔并向肝窦内蔓延。与模型组比较,茵陈蒿汤组胶原纤维增生明显减轻,纤维间隔变窄且疏松(图3B)。
2.4 肝组织Hyp含量变化及胶原增生情况 DMN诱导大鼠肝硬化后,随着造模时间延长,模型大鼠肝组织纤维化分级及Hyp含量逐渐升高,4周时达到高峰,见表1、图4。与正常组比较,模型组大鼠肝组织Hyp含量显著增加(P<0.01),与模型组比较,茵陈蒿汤组组Hyp含量显著降低(P<0.01)。
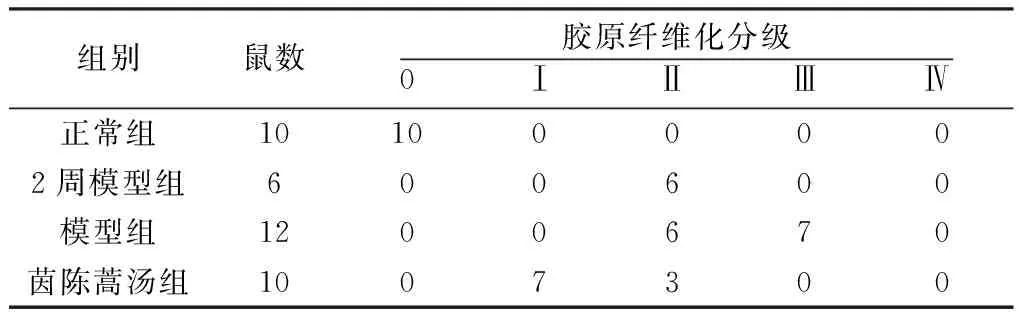
表1 肝组织胶原增生程度分期
注:与正常组比较,*P<0.05,**P<0.01,与模型组比较,#P<0.05,##P<0.01。
2.5 DMN肝纤维化大鼠组、茵陈蒿汤组肝组织差异基因分析
2.5.1 差异基因的GO富集分析 通过对模型组、茵陈蒿汤组肝组织基因原始数据进行统计,并对统计数据进行并集,以差异倍数1.5倍,P<0.05,多重假设检验错误误判率低的标准来筛选差异基因。与4周模型组相比,在大鼠肝脏中有501个差异表达基因(P<0.05),其中216个基因上调,285个基因下调。差异基因的GO富集分析表明有70个差异基因富集GO项。基因转录的变化在多种生物学过程中都变化显著,包括抗原加工提呈的抗原处理和表达,免疫应答,炎症反应,T细胞增殖调控,MAPK级联反应,以及脂肪酸代谢和器官生长的负调控等。
2.5.2 通路分析 通过KEGG进行通路分析是找出差异表达基因的重要途径。对501个差异表达的基因数据进行分析,得到47个类别的基因通路。其中14个通路在茵陈蒿汤干预治疗后的大鼠肝脏中显著富集。包括:移植物抗宿主病,Ⅰ型糖尿病,MAPK信号通路,NF-kappa B信号通路等(图5A)。所有参与这些通路的基因:IL-1b、Cd68、Tnfrsf14、Tnfrsf9、Fas、Cd14、Ctgf、Col1a2、Igfals、Igf1、Igfbp1、Mmp12、Mmp2、Mmp23、Ccl21、Prkcb参与炎症反应,且大多为Kcs分泌的相关因子。在DMN造模后2周Cd14、Igfals、Igfbp1下调,其余均上调。在茵陈蒿汤干预治疗后基因表达得到了不同程度的修复(图5B)。在KEGG分析中我们发现参与MAPK通路的基因较多,并在通路的上游发挥调控作用(图5C)。根据基因间的上下游关系及他们的相互作用,构建了Gene-net-work,清楚的表达了基因间的调控关系(图6)。

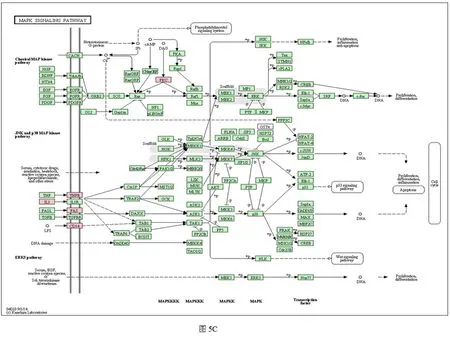
图5 DMN肝纤维化大鼠组、茵陈蒿汤组肝组织差异基因分析
(A)对茵陈蒿汤组的差异基因通过Kegg进行通路分析,P<0.05。(B)热图表示选定的与Kcs相关基因及参与MAPK通路的基因,Normal表示正常组,2W表示DMN造模2周组。4W表示DMN造模4周组,YCHT表示茵陈蒿汤治疗组,基因的表达水平不同,则颜色程度不同(-3到3),红色表示基因高表达,绿色表示基因低表达。(C)KEGGmap04010,MAPK通路。全基因芯片检测得到的基因(P<0.05),经Kegg pathway分析后发现KCs分泌的相关因子在MAPK通路的表达,粉色框表示与Kcs相关的基因,在MAPK通路中的位点。
3 讨论
本文基于前期“茵陈蒿汤类方抗肝硬化的方证病理基础研究”结果,围绕“方证相关时,方剂对机体基因的调控遵循‘无差错修复’原则”的假说,开展茵陈蒿汤调控DMN诱导的纤维化模型的基因网络及其可能的作用机制研究。
3.1 茵陈蒿汤调控库普弗细胞炎性因子的分泌 KCs是肝脏内特化的巨噬细胞,一般认为,各种因素引起肝脏损伤,继之发生炎性反应。KCs活化有两条激活途径:经典途径和旁路途径[13-14]。经典途径KCs活化并释放多种炎性因子,这些细胞因子进一步激活静息状态的HSC,使之表型转化为肌成纤维细胞,后者过度增殖并大量合成和分泌ECM成分,沉积在窦周间隙导致纤维化。旁路途径能抑制HSD的激活,减少胶原的生物合成,从而达到抑制纤维化作用的效果。
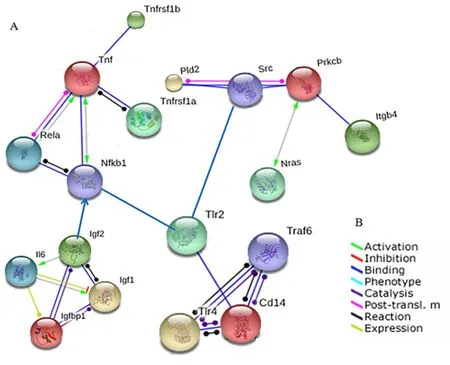
图6 构建网络图
注:Gene-net-work,根据全基因芯片检测后得到的KCs分泌的细胞因子的上下游关系及相互间的作用构建网络图。不同的箭头颜色代表不同的作用关系。A图表示各个基因间的上下游关系及相互间的作用,B图表示相互间作用关系(箭头颜色的注释)。
本研究显示,随着模型的进展,肝组织炎性细胞侵润逐渐增加,ALT、AST数值逐渐增高。全基因芯片的检测结果分析得到TNF受体及其超家族成员:Tnfrsf14、Tnfrsf9、Fas上调,结缔组织、胶原酶Ctgf、Col1a2上调,胰岛素样生长因子结合蛋白:Igfals、Igf1、Igfbp1下调,基质蛋白金属酶:Mmp12、Mmp2、Mmp23上调,蛋白酶:Prkcb上调,炎症、趋化因子:Il-1b、CD68、CD14、Ccl21,等基因表达均上调,为KCs分泌的细胞因子,参与了KCs的经典途径。
此结果表明炎症是肝纤维化发生、发展的主要因素。KCs产生的细胞因子IL-1、TNF、Igf直接或间接作用于肝星状细胞、肝细胞,促进有丝分裂、细胞转化、调节细胞增殖,使SEC、HSC的分泌增加,导致炎症反应的发生,使过氧化物、氧化物的产量增加,从而进一步释放炎症趋化因子,促进KCs的激活。CD68的过表达,促进了肝纤维化的进程[15]。
肝纤维化时,肝内过量集聚的ECM,除了HSC的激活大量产生外,还存在降解的异常。ECM的降解酶主要是基质金属蛋白酶(MMP),是KCs分泌的生物活性因子,一般在肝纤维化的早、中期活性增高,在肝纤维化中的作用重大[16-17]。MMP-2是目前公认的肝窦内皮损伤因子,近年在临床中已和角蛋白18新表位M30(CK-18 M30)作为检测肝纤维化的标记物。MMP-2酶原通过与HSCs表面的MT1-MMP结合而活化,在肝纤维化早期参与了基底膜胶原的降解,使基底膜内的生长因子释放。在肝损伤期间基质金属蛋白酶(MMP)-2促进HSC的增殖,氧化应激通过活化MMP-2来调节HSC的的生长和侵袭[18]。MMP-23属Ⅱ型跨膜基质金属蛋白酶,能够被单一的蛋白水解酶所裂解,使其具有活性和分泌作用。
在此研究中,使用茵陈蒿汤干预治疗后ALT、AST水平显著下降,IL-1β,CD68、Tnfrsf14、Tnfrsf9、COL1α2、MMP2、MMP23、Prkcb基因表达下调,CD14、Igf1基因表达上调。说明茵陈蒿汤能改善肝功能状况,通过抑制调控KCs的经典激活途径,抑制肝脏炎症反应、肝星状细胞活化及肝窦内皮细胞、肝实质损伤,从而达到抗肝纤维化的作用。
3.2 茵陈蒿汤调控MAPK信号通路 MAPK是一组可被多种信号激活,分布于胞浆中具有丝氨酸和酪氨酸双重磷酸化能力的蛋白激酶,是真核细胞介导细胞外信号到细胞内反应的重要信号传导系统,其通过连接细胞表面受体和细胞内关键调控因子参与基因的表达,经双重磷酸化激活后,参与细胞的多种生理过程,对损伤修复、细胞增殖都具有重要的意义[19-21]。
MAPK信号通路不仅参与了细胞的生长发育及细胞周期调控等,并与炎症及细胞间功能同样密切相关。脂多糖是介导全身炎症反应的重要物质,LPS可引起KCs活化,进一步激活HSC。其通过与血液循环中脂多糖结合蛋白(LBP)的复合物结合到KCs膜的CD14受体上[22],介导MAPK活化而使效应细胞表达、合成和释放IL-1和TNF-α等多种炎性细胞因子及花生四烯酸产物,参与炎性反应过程。MAPK通路在细胞凋亡中起着重要作用。
转化生长因子-β(TGF-β)是肝纤维化形成中最主要的促纤维化细胞因子。它既可促进细胞外基质的合成,又可抑制其降解,在HSC活化过程中起着重要作用。TGF-β也可以诱导MAPK信号传导通路的活化。TGF-β可以通过抑制MMPs和促进TIMPs,减少异常合成的ECM降解,改变肝纤维化的进程。
在此研究中,模型组IL-1,TNF、FAS、Prkcb等相关基因表达上调,CD14表达下调,从而调控了MAPK通路,在经过茵陈蒿干预后基因表达均得到不同程度的恢复,从而在通路上游开始阻断了MAPK通路。
综上所述,通过全基因芯片的分析,在DMN模型中,茵陈蒿汤干预治疗后基因表达得到了不同程度的修复。前期研究表明在DMN模型中,茵陈蒿汤有效调控了肝细胞凋亡基因[6],而在CCl4模型中,茵陈蒿汤却没有明显疗效,而且基因分析显示茵陈蒿汤不仅没有对模型中变化的上下调基因进行有效调控,反而促进了酪氨酸激酶受体(在肿瘤血管生成中发挥关键作用)等肿瘤相关基因的上调[6]。验证了“方证相关时,方剂对机体基因的调控遵循‘无差错修复’原则”的假说。茵陈蒿汤抑制DMN诱导大鼠肝纤维化形成的作用机制是非常复杂的,从目前的研究结果分析看,这种机制的形成可通调控KCs活化来抑制肝脏炎症反应、肝星状细胞活化、肝细胞凋亡、肝窦内皮损伤,同时可能参与调控MAPK通路来抑制肝细胞凋亡,从而达到抗肝纤维化的作用。
当然,中医复方的成分及作用机制非常复杂,其具体调控机制、反馈调节如何进行及与其他信号通路是否有联系等问题,尚待进一步探讨。
[1]孙明瑜,谢鸣.试论证候与复方的研究思路[J].中国医药学报,2002,17(4):196-198.
[2]Cheng Liu,Mingyu Sun,Xiaofeng Yan,et al.Inhibition of hepatic stellate cells activation following the administration of Yin-chen-hao decoction to dimenthylnitrosamine treated rats[J].Hepatology Research,2008,38:919-929.
[3]Cheng Liu,Mingyu Sun,Lei Wang,et al.Effects of Yinchenhao Tang and related decoctions on DMN-induced cirrhosis/fibrosis in rats[J].Chin Med,2008,3:1-9.
[4]边艳琴,曹红燕,董姝,等.茵陈蒿汤与甘露消毒丹对DMN诱导肝纤维化大鼠模型的方证比较研究[J].中华中医药杂志,2013,28(5):1396-1401.
[5]边艳琴,宁冰冰,曹红燕,等.经典退黄三方抗二甲基亚硝胺诱导大鼠肝纤维化的方证比较研究[J].中西医结合学报,2012(12):1405-1412.
[6]孙明瑜,王磊,慕永平,等.茵陈蒿汤对DMN与CCl4诱导的肝硬化大鼠模型凋亡基因影响的比较研究[J].中西医结合学报,2011,9(4):423-434.
[7]边艳琴,刘平,章李军,等.茵陈蒿汤和茵陈四逆汤抗二甲基亚硝胺诱导的大鼠肝纤维化的方证比较研究[J].辽宁中医药大学学报,2011,13(8):68-71.
[8]Pinzani M,Rosselli M,Zuckermann M.Liver cirrhosis[J].Best Pract Res Clin Gastroenterol,2011,25(2):281-290.
[9]Kolios G,Valatas V,Kouroumalis E.Role of Kupffer cells in the pathogenesis of liver disease[J].World Gastroenterol,2006,12:7413-7420.
[10]Cheng Liu,Qing Tao,Mingyu Sun,et al.Kupffer cells are associated with apoptosis,inflammation and fibrotic effects in hepatic fibrosis in rats[J].Lab Invest,2010,90(12):1805-1816.
[11]Ala-Kokko L,Pihlajaniemi T,Myers J C,et al.Gene expression of type Ⅰ,Ⅲ and Ⅳ collagens in hepatic fibrosis induced by dimethylnitrosamine in the rat[J].Biochem J,1987,244(1):75-79.
[12]Jamall Ⅰ S,Finelli Ⅴ N,Que Hee S S.A simple method to determinenanogram levels of 4-hydroxyproline in biological tissues[J].Anal Biochem,1981,112(1):70-75.
[13]Goerdt S,Polotz O,Schledzewski K,et al.Alternative versus classical activeation of macrophages[J].Pathbilolgy,1999,67(5-6):222.[14]Erwei Song,Nengtai Ouyang,Markus Horbelt,et al.Influence activeities of human fibroblasts[J].Cellular Immunology,2000,204:19.
[15]Stanculet N,Grigoras A,Avadanei R,et al.Relationship beteween Kuppfer cells,inflammation,and fibrosis in chronic hepatitis B and C[J].Rev Med Chir Soc Med Nat Iasi,2013,117(4):880-889.
[16]BenyonB e RC,Iredale JP.Is l iver f ibros is reversible[J].Gut,2000,46(4):B443-446.
[17]Benyon RC,A rthur M JP.M echan ism s of hepat ic fib rosis[J].J Pediatr Gastroen terolNu tr,1998,27(1)B75-85.
[18]Galli A,Svegliati-Baroni G,Ceni E,et al.Oxidative stress stimulates proliferation and invasiveness of hepatic stellate cells via a MMP2-mediated mechanism[J].Hepatology,2005,41(5):1074-1084.
[19]Johnson GL,Lapadat R.Mitogen-activated protein kinase pathways mediated by ERK,JNK,and p38 protein kinases[J].Science,2002,298:1911-1912.
[20]Sharma GD,He J,Bazan HE.p38 and ERK1/2 coordinate cellular migration and proliferation in epithelial wound healing:evidence of cross-talk activation between MAP kinase cascades[J].J Biol Chem ,2003,278:21989-21997.
[21]Tsubaki M,Matsuoka H,Yamamoto C,et al.The protein kinase C inhibitor,H7,inhibits tumor cell invasion and metastasis in mouse melanoma via suppression of ERK1/2[J].Clin Exp Metastasis,2007,24:431-438.
[22]Enomoto N,Yamashina S,Schemmer P,et al.Estriol sensitizes rat Kupffer cells via gut-derived endotoxin[J].Am J Physiol,1999,277(3ptl):G671-677.
(2014-12-26收稿 责任编辑:洪志强)
Antifibrotic mechanism of action based on the corresponding on Traditional Chinese Medicine formula-syndrome to explore Yin-Chen-Hao Decoction regulation of Kupffer cell function and MAPK pathways
Cao Hongyan1,2,Bian Yanqin1,Wu Chao1,2,Li Jianyuan1,2,Liu Ping1,2,3,Sun Mingyu1,2,3
(1ShuguangHospital,ShanghaiUniversityofTraditionalChineseMedicine;InstituteofLiverDisease,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 2KeyLaboratoryofLiverandKidneyDiseases(MinistryofEducation),ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China;3E-instituteofShanghaiMunicipalEducationCommission,Shanghai201203,China)
Objective: Our previous study showed significantly efficacy of series formula of Yin-chen-hao Decoction (YCHD) on fibrosis models in rats induced dimethynitrosamine (DMN).From the perspective of formula-efficacy-syndrome, we proposed a hypothesis ‘corresponding permit on formula-syndrome, gene regulation of formula on suffering body follow ‘error free repair’ principle’ and explore the mechanism of action of YCHD. Methods: Liver fibrosis was induced in rats with DMN. YCHD was administrated intragastrically for 2 weeks for rats. At the end of the fourth week, all of the animals were sacrificed and their liver samples were collected for histology and gene chip analyses. Results: Compared with the normal group, the blood serum ALT level of the rats was remarkably increased (P<0.01) four weeks after modeling; the inflammatory cells of hepatic tissue was remarkably infiltrated according to pathological observance, the deposition of collagen was remarkable (P<0.01). There were remarkable up-regulation of the expression of the genes including Interleukin 1 beta (IL-1b), Cd68, Tumor necrosis factor receptor superfamily, member 14 (Tnfrsf14), Tumor necrosis factor receptor superfamily, member 9 (Tnfrsf9), Fas, Cd14,Connective tissue growth factor (Ctgf), Collagen, type I, alpha 2(Col1a2), Insulin-like growth factor binding protein, acid labile subunit( Igfals), Insulin-like growth factor 1( Igf1),Insulin-like growth factor binding protein 1(Igfbp1), Matrix metallopeptidase 12(Mmp12), Matrix metallopeptidase 2(Mmp2), Matrix metallopeptidase 23(Mmp23), Chemokine ligand 21(Ccl21) and Protein kinase C, beta (Prkcb) in hepatic tissue, and mitogen-activated protein kinase (MAPK) pathway was activated. Yin-Chen-Hao Decoction significantly reduced the level of blood serum ALT inducted by DMN, restrained the infiltration and necrosis of the inflammatory cells of hepatic tissue, inhibited collagen deposit, decreased the expression of the genes including IL-1b, Cd68, Tnfrsf14, Tnfrsf9, Fas, Cd14, Ctgf, Col1a2, Igfals, Igf1, Igfbp1, Mmp12, Mmp2, Mmp23, Ccl21 and Prkcb, and restrained the activation of MAPK pathway. Conclusion: The hypothesis ‘corresponding permit on formula-syndrome, gene regulation of formula on suffering body follow ‘error free repair’ principle’ was verified. The MOA of anti-fibrotic of Yin-Chen-Hao Decoction was regulation of the KCs action and MAPK pathway.
Corresponding on Traditional Chinese medicine formula-syndrome; Hepatic fibrosis; Yin-Chen-hao Decoction; ‘Error free repair’ principle; Gene analysis
国家自然科学基金项目(编号:81273729,30701070);上海中医药大学首届杏林学者、上海市重点科技攻关项目(编号:11DZ1971702);上海高校创新团队建设项目、国家中医药管理局中医肝胆病重点学科、慢性肝病虚损重点研究室和上海市中医临床重点实验室资助
R285.5
A
10.3969/j.issn.1673-7202.2015.02.004

