三叶青两个肌动蛋白基因片段的克隆及其分析
黄连香,宋亚玲,向太和,孙 扬,武 盼,王 博
(杭州师范大学生命与环境科学学院,浙江 杭州310036)
肌动蛋白(Actin)普遍存在于真核生物细胞中,是细胞骨架微丝的组成成分,参与细胞内很多重要的生理活动,如细胞形状的维持、细胞运动、细胞内物质运输、细胞分裂等[1-2].单体肌动蛋白为球蛋白,一般由375~377个氨基酸残基组成[3].阎隆飞等1963年首次报道高等植物中存在肌动蛋白[4].在植物基因表达调控研究中,肌动蛋白基因作为一种管家基因常被广泛用作分子内标[5].相关研究表明,高等植物肌动蛋白由多基因编码,目前,百合[6]、茶树[7]、刺五加[8]、马铃薯[9]等植物的肌动蛋白基因已被克隆和分析,但有关珍稀药用植物三叶青(TetrastigmahemsleyanumDielsetGilg)肌动蛋白基因的研究尚未见报道.
本研究克隆了三叶青2个肌动蛋白基因片段,并检验该基因在不同组织中的表达情况,研究结果报道如下.
1 材料与方法
1.1 材料
三叶青采自丽水市庆元县山区野生种,种植于杭州师范大学塑料大棚中.
1.2 方法
1.2.1 RNA 的提取
利用上海Sangon公司的RNA 抽提试剂盒提取三叶青块根中的RNA,按照操作说明进行.所得的RNA 溶液保存于-80 ℃用于后续实验.
1.2.2 cDNA 第1链的合成
利用北京全式金生物技术有限公司的TransScript First-Strand cDNA Synthesis Super Mix 试剂盒进行三叶青cDNA 的合成,即:在Eppendorf管中依次加入总RNA(约200 ng/μL)2μL,Oligo(d T)18(0.5μg/μL)1μL,2×TS Reaction Mix 10μL,逆转录酶1μL,dd H2O(RNase-free)6μL,轻轻混匀,42 ℃孵育30 min后于85 ℃加热5 min失活TransScript RT 酶.
1.2.3 PCR 扩增
根据GenBank 中拟南芥、烟草、大豆和水稻的肌动蛋白基因序列(GenBank 登陆号:AP002063.2、U60489.1、U60497.1、X16280.1和X15865.1等),通过Clustal W 软件分析确定保守序列区域,再根据保守序列用Primer3 软件设计1 组引物Act-P1:5′-GGAGAAGATCTGGCATCACA-3′和Act-P2:5′-CC TCCAATCCAGACACTGTA-3′,引物由上海Sangon公司合成.以上述逆转录产物cDNA 为模板进行PCR 扩增,每35μL扩增体系包括:TaqDNA 聚合酶(2.5 U/μL)1μL,d NTP(10 mmol/L)2μL,引物(约10 pmol/μL)各2μL,cDNA 模板(50~100 ng/μL)1μL,dd H2O 23.5μL.扩增程序为:94℃预变性5 min后,按照94 ℃变性45 s、55 ℃退火45 s、72 ℃延伸90 s进行30个循环,最后72 ℃延伸10 min,4 ℃保存备用.PCR 产物在1%的琼脂糖凝胶电泳约1 h(90 V)、溴化乙锭(EB)染色后,用美国Bio/Rad凝胶成像系统进行观察分析和拍照.
1.2.4 目的片段的克隆和测序
利用上海Sangon公司试剂盒回收纯化目的DNA 片段,连接到p MD19-T 克隆载体(Takara公司产品),转化大肠杆菌DH5α感受态细胞并进行蓝白斑筛选,重组质粒采用酶切法进行鉴定,最后对阳性克隆进行测序.
1.2.5 扩展蛋白基因序列的生物信息学分析
使用NCBI在线分析软件对测定的序列进行Blastn分析,对序列编码的氨基酸进行Blastp同源性比较分析,同时利用Clustal W 软件对氨基酸序列与其它物种的肌动蛋白氨基酸序列进行多重比较.
1.2.6 肌动蛋白基因的表达分析
对三叶青的叶、茎、普通根和块根分别提取RNA,利用紫外分光光度法对提取的RNA 进行定量后,不同器官以等量的RNA进行逆转录获得cDNA,最后以Act-P1和Act-P2为引物进行RT-PCR分析,方法同前.
2 结果与分析
2.1 三叶青肌动蛋白基因的RT-PCR扩增
以三叶青RNA 逆转录得到的cDNA 为模板,利用引物Act-P1、Act-P2进行PCR 扩增,电泳后出现两条较清晰的条带,大小约为800 bp和1 000 bp(分别命名为Th Act1和Th Act2)(图1).

图1 三叶青肌动蛋白基因的RT-PCR扩增结果Fig.1 PCR reaction of actin gene from Tetrastigma hemsleyanum Diels et Gilg

图2 重组质粒被Bam HⅠ+SalⅠ酶切结果Fig.2 Results of recombinant plasmid digested with enzyme of Bam HⅠ+SalⅠ
2.2 Th Act1 和Th Act2 基因的克隆和鉴定
PCR 产物经回收纯化后连接到克隆载体p MD19-T,转化感受态大肠杆菌DH5α,挑选白色单菌落,提取其质粒DNA,使用BamHⅠ+SalⅠ对p MD19-Th Act1和p MD19-Th Act2重组载体进行双酶切鉴定,酶切获得的插入片段大小分别为800 bp和1 000 bp左右,与预期片段大小相符,结果表明获得了阳性克隆(图2).
2.3 Th Act1 和Th Act2 基因序列分析
测序结果显示,Th Act1(短片段)为867 bp(图3),Th Act2(长片段)为1 079 bp(图4),两端引物序列位置在图3和4中分别用方框标出.对两个DNA 片段进行Blastn分析,并结合Blastp和ORFinder软件分析,两个基因均属于NBD_sugar-kinase_HSP70_actin superfamily家族,Th Act1(短片段)编码252个氨基酸,Th Act2(长片段)编码152个氨基酸.其中,Th Act1核苷酸序列与葡萄(GenBank登录号AM465189.1)、黄褐棉(GenBank登录号JF722026.1)和陆地棉(GenBank登录号JF722036.1)等的相似性分别为92%、85%和85%,其编码的蛋白质与刺儿菜(GenBank 登录号AEY77415.1)、月季(GenBank 登录号BAF36000.1)和覆盆子(GenBank登录号AED89635.1)等的相似性均为87%.而Th Act2核苷酸序列与葡萄(GenBank登录号XM_002265440.1)、海岛棉(GenBank登录号JF722033.1)和毛白杨(GenBank登录号JX986590.1)等的相似性分别为91%、85%和85%,其编码的蛋白质与毛茛(GenBank 登录号BAP28463.1)、鱼腥草(GenBank登录号ADN37687.1)和欧细辛(GenBank登录号ADN37689.1)等的相似性分别为90%、93%和93%.进一步说明克隆到的两个DNA 片段为肌动蛋白基因序列.

图3 ThAct1 基因片段的核苷酸序列及编码的氨基酸序列Fig.3 The nucleotide sequences and the amino acid sequences of the Th Act1 gene

图4 ThAct2 基因片段的核苷酸序列及编码的氨基酸序列Fig.4 The nucleotide sequences and the amino acid sequences of the Th Act2 gene
分别将推测的三叶青的两个基因片段编码的氨基酸序列与GenBank中登陆的其它物种Actin基因的氨基酸序列进行CluatlW 软件的多重比较,发现ThAct1基因编码的氨基酸中,有218个是保守的,6个是非保守氨基酸,而且与其它物种相比多出连续的28个氨基酸(图3中用下划线标出);在Th Act2基因编码的152个氨基酸中,仅有12个是非保守的氨基酸(图4中用下划线标出),这说明我们克隆到的Th Act1和
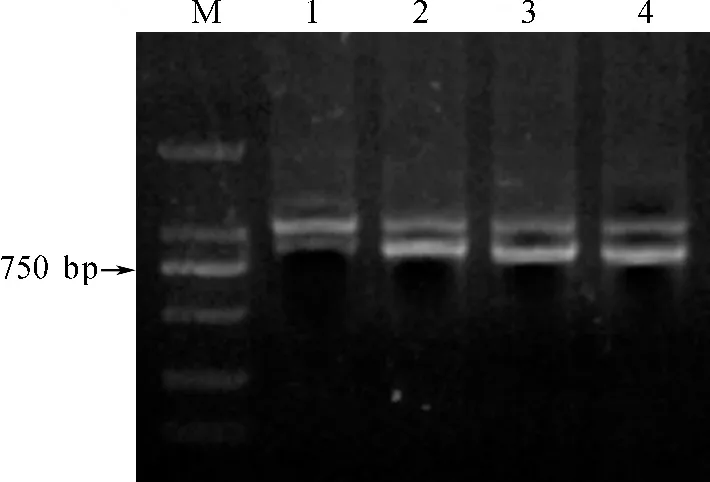
图5 ThAct1 和Th Act2 在不同器官中的表达分析Fig.5 Expression analysis of ThAct1 and ThAct2 gene in different organs
不同物种中肌动蛋白的数目变化很大,除少数单细胞原生动物、藻类和酵母类外,所有的多细胞真核生物的肌动蛋白都由多基因家族编码[10],如黄瓜上至少有3条Actin基因[11],棉花上至少含15个Actin基因[12],这些不同的基因编码不同类型的肌动蛋白异形体,与不同类型的肌动蛋白结合蛋白作用,Th Act2基因片段为Actin基因的高度保守区域.
2.4 ThAct1 和ThAct2 基因组织特异性表达分析
RT-PCR 半定量结果初步显示:在茎、普通根和块根中的Th Act1、Th Act2基因表达未见差异;但与叶相比,Th Act1的表达稍强,而Th Act2的表达稍弱.另外,在茎、普通根和块根中,Th Act1表达比Th Act2强;但在叶中正好相反,Th Act1表达比Th Act2弱(图5).
3 讨论
从而参与不同的生理活动和生命过程[13-14].本研究通过1次PCR 扩增即获得了2个三叶青的肌动蛋白基因,这可能与肌动蛋白基因是基因家族有关,在黄瓜中也有类似报道[11].克隆到的2条肌动蛋白基因片段核苷酸序列和氨基酸序列与GenBank中收录的其它生物的肌动蛋白有高度同源.相关研究表明,不同生物肌动蛋白具有高度保守性,其核苷酸残基变化1%约需100万年,暗示着肌动蛋白基因在进化过程中承受着较大的选择压力,在生物体内执行着重要的生物学功能[10].本文中也证明了肌动蛋白作为看家基因的高度保守性,这与肌动蛋白作为细胞骨架的重要作用是息息相关的[13-14].
另一方面,在基因的功能研究中,需要选用内标基因作为参考,一个理想的内标基因应该在各种不同的细胞类型、不同发育阶段采用不同处理方法时都能稳定表达,稳定的内标是确定目标基因相对表达的基础[15].本文克隆获得的2条肌动蛋白基因片段经PCR 扩增在三叶青叶、茎、普通根和块状根中均得到正常表达,说明Th Act1和Th Act2基因可以作为三叶青的内参基因来研究其它功能基因的表达.
[1]贺淹才.肌动蛋白和肌动蛋白基因的研究进展[J].生命的化学,2002,22(3):248-250.
[2]陈颖,王刚,赵俊霞.高等植物体内的肌动蛋白[J].生物学通报,2003,38(1):13-15.
[3]胡松年,阎隆飞.肌动蛋白与真核生物的进化[J].动物学报,1999,45(4):440-447.
[4]阎隆飞,石德权.高等植物中的收缩蛋白[J].生物化学与生物物理学报,1963,3(4):490-496.
[5]Thellin O,Zorzi W,Lakaye B,etal.Housekeeping genes as internal standards:use and limits[J].J Biotechnol,1999,75(2):291-295.
[6]梁云,袁素霞,冯慧颖,等.百合肌动蛋白基因lily Actin的克隆与表达分析[J].园艺学报,2013,40(7):1318-1326.
[7]杨亚军,王新超,马春雷.茶树肌动蛋白基因(CsActin1)全长cDNA 克隆与生物信息学分析[J].植物研究,2012,32(1):69-76.
[8]邢朝斌,龙月红,修乐山,等.刺五加肌动蛋白基因的克隆和表达稳定性分析[J].中草药,2013,43(13):1819-1822.
[9]蒋丽花,傅明辉,彭进平.水葫芦肌动蛋白基因片段的克隆及序列分析[J].广东农业科学,2014(9):143-146.
[10]孟玉平,张洁,张春芬,等.枣树肌动蛋白基因cDNA 片段的克隆及其表达分析[J].生物技术通报,2009(11):98-107.
[11]徐纪明,向太和.全雌性黄瓜中3个肌动蛋白基因片段的克隆和表达分析[J].细胞生物学杂志,2008,30(1):125-130.
[12]Li X B,Fan X P,Wang X L,etal.The cotton ACTIN1 gene is functionally expressed in fibers and participates in fiber elongation[J].Plant Cell,2005,17(3):859-875.
[13]McCurdy D W,Kovar D R,Staiger C J.Actin and actin-binding proteins in higher plants[J].Protoplasma,2001,215(1):89-104.
[14]Kandasamy M K,Deal R B,Mc Kinney E C,etal.Plant actin-related proteins[J].Trends Plant Sci,2004,9(4):196-202.
[15]Suzuki T,Higgins P J,Crawford D R.Control selection for RNA quantitation[J].Biotechniques,2000,29(2):332-337.

