ALT 正常的慢性HBV 感染者临床特征与肝组织学相关性研究
常海宁 徐葵花 赵守松
安徽省蚌埠医学院第一附属医院感染科(安徽 蚌埠,233000)
我国属于乙型肝炎病毒(HBV)感染高感染区域,据估测我国现有约9 300 万慢性HBV 感染者,其中大部分为慢性HBV 携带者和非活动性HBV 携带者,无临床症状,且ALT 正常。近年来研究表明,部分慢性HBV 感染者尽管ALT 正常但肝组织学病理变化显著,根据我国《2010年慢性乙型肝炎防治指南》对这部分患者需积极地抗病毒治疗[1~3]。目前在我们国家很多基层医院还不能开展肝组织学检查,因此探讨ALT 正常的HBV 感染者临床特征与肝组织学相关性具有重要的意义。我们对105例肝功能正常的慢性HBV 感染者进行肝脏组织学检查的同时结合其临床特征进行分析,探讨两者的相关性,为此类患者进行合理的抗病毒治疗提供理论基础。
1 资料与方法
1.1 一般资料 105例患者为2010年6月至2014年4月我院收住的慢性HBV 感染者,诊断符合我国2010年修订的《慢性乙型肝炎防治指南》标准[2],均为HBsAg 阳性、无慢性肝病症状体征、肝功能正常(ALT≤40 U/L)、B 超肝脾无明显异常。其中男64例,女41例;年龄17~63岁,平均(37.24 ±11.31)岁;病程0.5~40年,平均(8.32 ±7.33)年。
1.2 排除标准 排除合并丙型肝炎病毒、丁型肝炎病毒、人类免疫缺陷病毒等其他病毒感染、酒精性肝病、自身免疫性肝病、胆汁淤积性肝病、遗传代谢性肝病、失代偿期肝硬化、风湿病、系统性红斑狼疮、慢性阻塞性肺病、肾功能衰竭、糖尿病、肿瘤等,及既往进行过抗病毒治疗的患者。
1.3 研究方法 患者临床血液和生化指标均在行肝组织活检当天或前一天采集和记录。肝功能测定采用全自动生化分析仪,ALT 正常值上限(ULN)为40U/L(按ALT 水平高低将患者分为两组,A 组(25例):ALT<0.5× ULN;B 组(80例):0.5× ULN<ALT≤1×ULN);血清HBV 标志物采用ELISA 检测;血清HBV DNA 定量采用荧光定量PCR 检测法,正常参考值<500copies/ml。征得患者知情同意,术前常规行血常规、凝血酶原时间等检查。肝组织标本:对无肝活检禁忌症患者采用B 超引导下16G 肝穿刺针1 秒快速肝穿刺活检术,取肝组织1 条,组织长度1.5~2.0cm(至少包括6个以上汇管区)。肝穿刺活检标本置于4%甲醛溶液固定,常规石蜡包埋、4μm 连续切片、苏木精-伊红染色及网状纤维染色,由指定本院高年资病理医师在光学显微镜下进行阅片,病理学诊断按炎症活动度分级(G0~G4)、纤维化程度分期(S0~S4),具体参照2000年修订的《病毒性肝炎防治方案》的诊断标准。
1.4 统计学方法 用SPSS 11.5 医学统计软件进行统计学分析。计数资料采用χ2检验分析;计量资料采用均数±标准差表示;均数比较采用非参数检验;相关性分析采用Spearman 等级相关分析。采用双侧检验,P<0.05 为差异有显著性意义。
2 结果
2.1 一般情况 纳入的105例患者中,肝组织炎症分级(G)与纤维化分期(S)相关系数(rs)=0.05,P>0.05,相关性无统计学意义。不同性别的肝脏炎症分级差异无显著性意义(P>0.05),纤维化分期差异亦无显著性差异(P>0.05)。年龄与肝组织炎症分级无相关性(rs=-0.02,P>0.05),但与肝纤维化程度成正相关(rs=0.21,P<0.05),见表1。
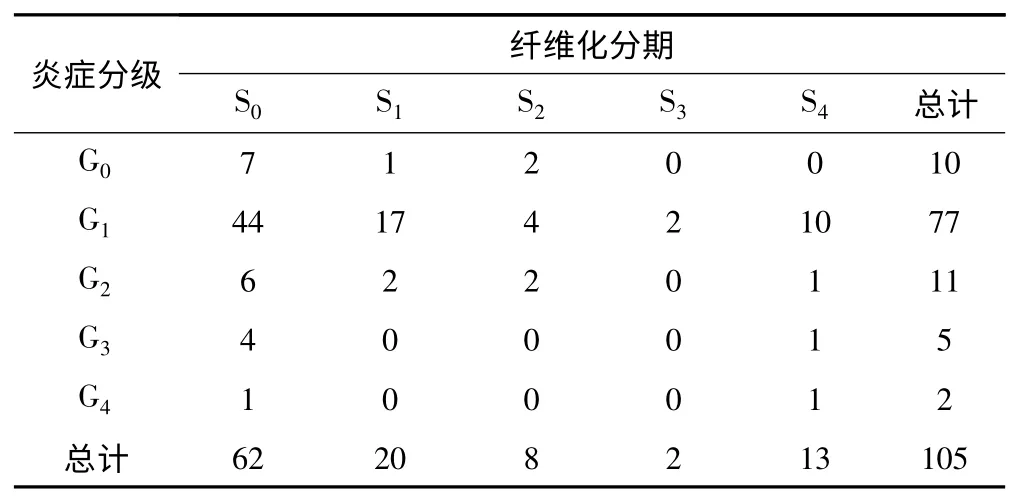
表1 105例患者肝穿刺炎症分级和纤维化分期结果
2.2 不同ALT 水平人群特征 见表2。
2.3 ALT 水平与肝脏病理的关系 见图1。
2.4 HBV DNA 复制水平与肝脏病理的关系 见表3。
2.5 HBeAg 状态与肝脏病理的关系 105例患者中HBeAg 阳性59例,炎症活动度为(1.10 ±0.71)级,纤维化程度为(1.54 ±1.18)期;HBeAg 阴性46例,炎症活动度为(1.24±0.77)级,纤维化程度为(0.35 ±1.47)期。炎症活动度与HBeAg 表达无显著相关性(P>0.05),但HBeAg 阳性患者纤维化分期高于HBeAg阴性者,差异有统计学意义(P<0.05)。

表2 不同ALT 水平人群特征

图1 不同ALT 水平的慢性HBV 感染者肝组织炎症活动度(图1A)和纤维化程度(图1B)的分布
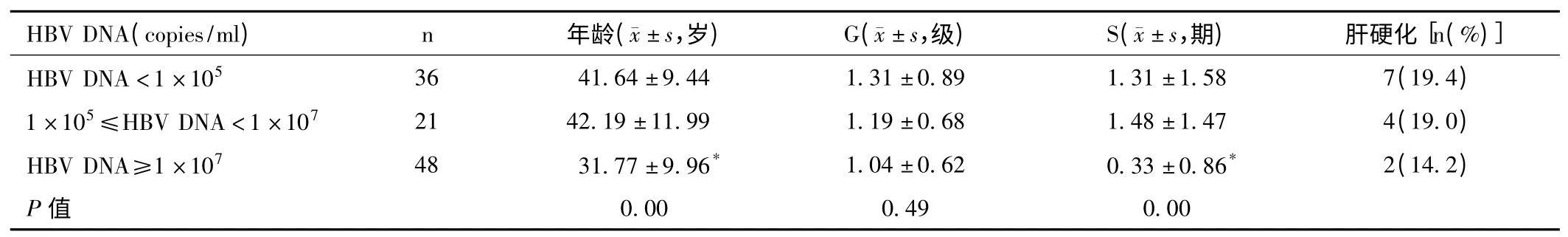
表3 不同HBV DNA 载量水平肝组织学分布特征
3 讨论
慢性HBV 感染是一种严重威胁人类健康的疾病,每年有大量患者死于HBV 感染所致的肝衰竭、肝硬化及原发性肝癌,故早期诊断与防治至关重要[1]。免疫清除期是抗病毒治疗的最佳时机,但对于血清转氨酶正常的患者,无法准确判断其病情进展,可能会导致肝脏炎症、纤维化的进展。这类患者被认为抗病毒应答效果不佳而不主张列为治疗对象,只给予一般的保肝抗炎治疗或定期门诊随访。本研究纳入的105例患者中仅7例肝组织活检完全正常(G0S0),34.3%(36/105例)的患者炎症分级或纤维化分期≥G2/S2,13例肝组织病理已经提示为肝硬化,与临床诊断不一致。通过对基本特征比较,发现性别与肝脏炎症和纤维化均无关,但年龄与纤维化程度呈正相关。这与国内外研究结果相似,在ALT 正常的慢性HBV 感染者中有相当一部分患者肝组织病理学已经存在显著改变,且随着病程延长,肝脏炎症及纤维化程度加重,年龄是纤维化进展的独立预测因素[4~7]。这可能与我国慢性乙型肝炎(CHB)患者多系母婴垂直传播或儿童时期感染有关,故病史大多较长,而本文纳入的105例患者平均年龄偏大(约37岁)、平均病程长(约8年),很大一部分患者具有家族史(43例)。且在临床工作中发现,肝功能正常年龄偏大患者比年轻者较易接受肝穿检查,肝穿的有创性可能仍是限制部分年轻患者选择的主要原因。另外,本研究是一项回顾性研究,对于“转氨酶正常”的患者,我们无法得知其转氨酶是否为持续正常,或是处于波动时被检测到。但本文结果表明34.3%的患者虽然ALT 未达到2×ULN 以上,肝脏病理却已经出现显著改变,因此需要走出转氨酶正常即疾病稳定的误区,定期复查肝功能、及时的肝穿检查是及时抗病毒治疗的关键。
目前ALT 仍是反映肝脏炎症活动的最主要指标。ALT 水平受肝外因素影响较多,而此时肝脏炎症及纤维化已经启动且反复存在、逐步进展,因而病理损害与临床表现可能不一致[8]。目前一致认为,乙型肝炎的发病机制是免疫反应。HBV 本身为非致细胞病变性病毒,其在体内复制并不直接损伤肝细胞,若免疫反应尚未损伤肝细胞或是肝细胞破坏不明显时,血清ALT 可以正常或只是轻度升高,病情呈隐匿发展。通过对两组患者的肝组织炎症(G)及纤维化(S)进行单独比较后发现,血清ALT 水平与肝组织炎症分级差异无统计学意义,但与纤维化分期相关,ALT 水平较高组纤维化程度明显高于ALT 水平较低组。这与许多文献的研究结果不一致[9,10]。这与纳入的研究对象仅为ALT 正常的患者,ALT 水平差距并不大,且ALT 水平较高组样本量偏少,故ALT 正常的患者ALT 水平与肝组织学改变的相关性有待进一步研究证实。
国外有研究报道,低病毒载量时部分患者已经存在显著肝脏纤维化[11,12]。本研究将所有病例根据病毒载量高低分为3 组,结果显示不同病毒复制水平的肝组织均会出现一定的炎症纤维化改变,因此不能仅凭借血清HBV DNA 复制水平的活跃程度来判断肝组织病理损害的程度。进一步分析发现,HBV DNA 复制水平与肝组织炎症程度无关,但与纤维化程度有关,低、中病毒载量组肝纤维化程度明显高于高病毒载量组,且出现肝硬化比例亦明显高于高病毒载量组。同时发现,3 组间年龄分布差异亦有显著性意义,低、中病毒量组患者的年龄明显高于高病毒量组。从而进一步证实,年龄也是另一个参与肝脏纤维化进展的因素。这可能是由于:①纳入的低病毒载量组患者大多病程较长,大多已经经过了免疫清除期而进入非活动或低复制期,患者血清HBV 虽处于低水平复制,而炎症及纤维化损伤机制已经启动,但由于患者清除病毒能力不足而反复存在,导致肝脏炎症修复,纤维组织不断积累。②随着肝纤维化逐步进展,肝细胞所提供HBV 复制场所(肝实质细胞)减少,从而出现低、中病毒载量组肝纤维化程度明显高于高病毒载量组。因此,对于年龄偏大、病毒载量<107copies/ml 的患者,肝穿的意义就显得尤为重要,以免遗漏部分已经具有抗病毒指征的患者。
一般认为,血清HBeAg 是HBV 复制活动的可靠指标。然而B 和C 基因型的患者易发生HBeAg 阴性变异株(前C 和C 启动子变异),这些患者在HBeAg 阴性甚至ALT 正常时,HBV 仍可复制活跃[10]。HBeAg阴性的患者,其肝组织炎症活动度和纤维化程度往往比HBeAg 阳性者严重[13,14]。这与本研究的发现不一致,HBeAg 状态的肝脏炎症分级差异无统计学意义,但HBeAg 阳性组患者肝组织纤维化程度明显高于HBeAg阴性组,且其中轻度肝纤维化患者相对偏多。这就提示我们对于HBeAg 阴性和HBeAg 阳性患者结合肝脏穿刺病理检查判断抗病毒治疗和预后是非常必要的。
本研究认为,年龄>41岁、0.5×ULN<ALT≤1×ULN、中低病毒量水平(<107copies/ml)及HBeAg 阳性是慢性HBV 感染者肝组织纤维化进展的危险因素。年龄、ALT 水平、HBeAg 阳性、HBV DNA 水平等可以作为慢性HBV 感染者抗病毒治疗的参考指标。而肝组织学检查是判断慢性HBV 感染者肝脏病理改变的关键指标,也可以指导临床抗病毒治疗。因此,在临床上需要适时选择肝脏活组织检查并结合患者血清学指标,对于慢性HBV 感染者病理诊断和及时抗病毒治疗具有重要意义。
[1]Asselah T,Marcellin P.An update in the management of chronic hepatitis B[J].Clin Liver Dis,2013,17(3):ix-x.
[2]中华医学会肝病学分会、感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志,2011,19(1):13 -24.
[3]Mansour-Ghanaei F,Rafiei R,Joukar F,et al.Relationship between serum HBV DNA level and liver histology in HBV carriers with normal ALT in Guilan province,Iran[J].Med Sci Monit,2010,16(3):BR97 -101.
[4]苗雅娇,赵守松.40例慢性乙型肝炎轻度患者肝组织病理学变化研究[J].实用肝脏病杂志,2012,15(1):7 -9.
[5]Nabuco LC,Mello FC,Gomes SA,et al.Hepatitis B virus genotypes in Southeast Brazil and its relationship with histological features[J].Mem Inst Oswaldo Cruz,2012,107(6):785 -789.
[6]吴赤红,斯崇文,田庚善,等.慢性乙型肝炎病毒携带者的病理与临床及预后分析[J].中华肝脏病杂志,2007,15(8):577 -581.
[7]Andreani T,Serfaty L,Mohand D,et al.Chronic hepatitis B virus carriers in the immunotolerant phase of infection:histologic findings and outcome[J].Clin Gastroenterol Hepatol,2007,5(5):636 -641.
[8]Kim HC,Nam CM,Jee SH,et al.Normal serum aminotransferase concentration and risk of mortality from liver diseases:prospective cohort study[J].BMJ,2004,328(7446):983.
[9]Kumar M,Sarin SK,Hissar S,et al.Virologic and histologic features of chronic hepatitis B virus-infected asymptomatic patients with persistently normal ALT[J].Gastroenterology,2008,134(5):1376 -1384.
[10]Shi M,Zhang Y,Zhang J,et al.Hepatitis B virus genotypes,precore mutations,and basal core promoter mutations in HBV-infected Chinese patients with persistently normal alanine aminotransferase and low serum HBV-DNA levels[J].Braz J Infect Dis,2012,16(1):52-56.
[11]Abdo AA,Bzeizi KI,Babatin MA,et al.Predictors of significant fibrosis in chronic hepatitis B patients with low viremia[J].J Clin Gastroenterol,2014,48(6):e50 -e56.
[12]Ruezgar M,Cetin AS,Vahaboĝlu H.Comparison of quantitative hepatitis B virus DNA levels in serum and liver biopsy samples of chronic hepatitis B patients[J].Mikrobiyoloji bulteni,2008,42(2):283 -291.
[13]李璐,李曼,朱晓骏,等.HBeAg 阳性和阴性慢性乙型肝炎患者肝组织学与血清学关系的比较[J].临床肝胆病杂志,2012,28(12):919 -922.
[14]Ijaz B,Ahmad W,Javed FT,et al.Revised cutoff values of ALT and HBV DNA level can better differentiate HBeAg (-)chronic inactive HBV patients from active carriers[J].Virol J,2011,8:86.

