再次体外受精-胚胎移植获卵数的改变及其影响因素的分析
韩 丹,章志国,郝 燕,朱复希,田 婷,陈大蔚,曹云霞,周平
再次体外受精-胚胎移植获卵数的改变及其影响因素的分析
韩 丹,章志国,郝 燕,朱复希,田 婷,陈大蔚,曹云霞,周平
目的探讨首次体外受精(IVF)-胚胎移植(ET)/卵母细胞内单精子显微注射(ICSI)失败行再次IVF/ICSI-ET时获卵数的变化以及相关影响因素的分析。方法回顾性分析222例在12个月内行2次IVF/ICSI-ET周期的患者,根据基础窦卵泡数(bAFC)将患者分为A组(bAFC≥9)和B组(bAFC<9),分析每组前后两周期间患者的基本情况、临床方案、获卵数、进入减数分裂中期II(MII期)卵子数、正常受精率、优胚率、累积妊娠率的变化,探讨影响前后周期获卵数发生变化的相关因素。结果A组第二个IVF周期(cycle2)获卵数、MII期卵子数、受精率、优胚率、累积妊娠率明显高于第一个IVF周期(cycle1),前后周期中临床方案无大的变化,均以长方案为主,但cycle2每日的促性腺激素(Gn)使用剂量高于cycle1(P<0.05)。B组中相对于cycle1,cycle2获卵数、MII期卵子数差异无统计学意义,而优胚率及累积妊娠率均提高,并且cycle2中短方案明显多于cycle1(P<0.05)。其中B组中有14例患者在cycle1中为长方案,在cycle2中转变为短方案,后者的获卵数以及MII期卵子数均高于前者(P<0.05)。结论对于卵巢功能正常的患者,结合患者cycle1中获卵数以及Gn使用剂量,在控制卵巢过度刺激综合征发生的情况下,cycle2中可通过适当的提高每日Gn使用剂量来提高获卵数及MII期卵子数。相对于长方案,短方案可能更适合卵巢功能减退的患者。
再次体外受精-胚胎移植;获卵数;重复周期;促排卵方案
随着临床上超促排卵方案、胚胎培养技术和胚胎冷冻技术的快速发展,目前,世界范围内试管婴儿的成功率已达到40%~60%;但仍有50%的夫妇在首次体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)中无法成功获得妊娠[1]。虽然IVF的妊娠率与女方的年龄高度相关,但是所获得的卵母细胞数也与高的妊娠率有关,研究[2]显示,与拥有10~11枚减数分裂中期Ⅱ(MII期)卵母细胞的妇女相比,拥有6~10枚MII期卵母细胞的妇女的胎儿出生率降低4.3%,而拥有1~5枚MII期卵母细胞的妇女的胎儿出生率则降低16.4%。研究[3]表明,IVF的妊娠率与卵母细胞产生并不呈线性相关性,随着卵母细胞数增长到15枚,出生率也相应增长,并且在15~20枚时胎儿出生率达到高峰,当卵母细胞数高于20枚时出生率则下降,因而获得合适的卵母细胞数目有助于提高妊娠率。目前有许多针对单一周期中影响卵母细胞数的相关研究,却没有针对首次IVF失败行再次IVF获卵数变化相关影响因素的探究,然而这些信息对于再次IVF的患者后续治疗以及预后有重要意义。该研究回顾性分析了患者在1年内行2次IVF周期,比较前后周期间获卵数的变化,以及影响这种变化的相关因素,从而为再次行IVF的患者改善后续治疗及妊娠结局提供有效依据。
1 材料与方法
1.1 病例资料选择2011年1月~2014年10月因不孕症于12个月内在安徽医科大学第一附属医院生殖中心行2次IVF-ET/卵母细胞内单精子显微注射(intracytoplasmic sperm injection,ICSI)助孕的夫妇222例,共444个取卵周期。其中因输卵管因素不孕117例,子宫内膜异位症或子宫腺肌症5例,男方因素52例,不明原因不孕4例,混合因素44例。所有患者具有IVF/ICSI-ET治疗适应证,且符合国家计划生育政策,在接受辅助生殖助孕治疗前均签署知情同意书。按照基础窦卵泡数(baseline antral follicle count,bAFC)将患者分为A组(bAFC≥9个)和B组(bAFC<9个),前后两个取卵周期分别为cycle1和cycle2,A组患者137例,B组患者85例。入选的患者促排卵方案有长方案、短方案、超长方案,A组cycle1中3种方案分别占90.5%、3.6%、5.9%,A组cycle2中3种方案分别为86.9%、4.3%、8.8%,B组cycle1中3种方案比例为75%、14.1%、10.9%,cycle2中3种方案比例为63.5%、29.4%、7.1%。B组中有14例患者在cycle1中为长方案,在cycle2中换为短方案。
1.2 研究方法
1.2.1 促排卵方案 根据患者情况选择合适的促排卵方案:①长方案:在上一个周期的黄体中期予以长效促性腺激素释放激素激动剂(GnRHa)0.8~1.3 mg一次肌注或短效GnRHa 0.1 mg每天皮下注射降调节至人绒毛膜促性腺激素(human chorionic gonodotropin,HCG)日前1 d,在开始降调后14 d左右根据性激素水平[黄体生成素(luteinizing hormone,LH)<5 IU/L,雌二醇(Estradiol,E2)<50 pg/ml]及内膜情况判断是否完全降调。达到降调水平后,根据患者年龄、体重指数(body mass index,BMI)、bAFC,前一次促排卵情况及卵巢反应情况给予合适的Gn启动计量,促排卵过程中观察性激素水平结合阴道B超检测卵泡直径来调整Gn剂量;②短方案:月经第1~2天开始皮下注射短效Gn-RHa 0.1 mg,于月经第5天开始超排卵;③超长方案:主要适用于子宫内膜异位症,子宫腺肌症,多发性子宫肌瘤患者。在月经第1~3天皮下注射长效GnRHa 1.88 mg或3.75 mg,1次/28 d,连用1~3次,末次应用GnRHa第28~35天根据B超及性激素水平[糖类抗原125(CA125)、E2、LH、卵泡刺激素(follicle-stimulating hormone,FSH)]决定是否超促排卵。常用的Gn包括重组人促卵泡激素(r-FSH,果纳芬,默克雪兰诺有限公司)、尿卵泡刺激素(u-FSH,丽申宝,丽珠制药)、尿促性素(HMG,丽珠制药)。应用上述3种方案促排卵后,B超监测卵泡发育,有3个或3个以上主导卵泡直径达到18 mm时,于当日晚上9~10点肌内注射HCG 5 000~10 000 U,36 h后在B超引导下经阴道取卵。
1.2.2 受精及卵裂观察 根据患者情况选择合适的受精方式,取卵后4~6 h行IVF或ICSI,16~18 h观察原核形成情况。第3天通过观察胚胎卵裂细胞数、细胞形态和碎片情况来评估卵裂期胚胎质量,部分胚胎继续培养到第5天或第6天形成囊胚,根据患者情况进行新鲜周期或冷冻周期移植,胚胎移植后30~35 d行阴道B超检查,发现孕囊即为临床妊娠。
1.2.3 研究指标 优质胚胎:D3(7-12cf4s1,8cf4s0),D5(3-5AA、3-5AB、4-5BB),D6(4-5AA、4-5AB),其中c表示细胞,f表示碎片(f4:无碎片或<5%,f3:5%~10%,f2:11%~25%,f1:26%~50%,f0:>50%);s表示卵裂球的对称性(s1表示对称,s0表示不对称)。累积妊娠率(%)=获得临床妊娠的周期数(新鲜周期移植或解冻移植获得临床妊娠)/取卵周期数×100%。
1.3 统计学处理采用SPSS 13.0软件进行分析,结果以或率(%)表示。计量资料比较采用t检验,计数资料比较采用χ2检验。
2 结果
2.1 A组中cycle1与cycle2的比较cycle2中HCG日E2水平、Gn总量、获卵数、MII期卵子数、受精率、优胚率、累积妊娠率均高于cycle1(P<0.05)。从cycle1到cycle2中有12.5%的患者临床方案发生改变,但两周期中3种方案所占的比例差异无统计学意义,见表1。
2.2 B组中cycle1与cycle2的比较cycle2中HCG日E2水平、优胚率、累积妊娠率高于cycle1(P<0.05)。但Gn总量、获卵数、MII期卵子数及受精率的差异无统计学意义,cycle2中有22.4%的患者临床方案发生了改变,cycle2中短方案明显增多(P<0.05),见表1。
2.3 B组中由长方案转变为短方案的14例患者前后周期间的比较14例患者在cycle2中的Gn使用总量及Gn使用天数均少于cycle1(P<0.05),而获卵数及MII期卵子数均多于cycle1(P<0.05),见表2。
3 讨论
资料[4]显示女性生育力随年龄增长而下降,主要是因为随着年龄的增长,女性卵巢中的卵泡自发性的加速闭锁,卵母细胞的细胞核、细胞质异常,卵巢储备功能减退,卵泡数量减少;同时随着年龄增长卵母细胞ATP含量的降低也影响了胚胎的着床和发育。陈士岭等[5]提出女性35岁以后,随年龄增长妊娠率下降,主要与卵子数量和质量下降有关。而对于年轻患者,连续进行3次以内的IVF周期,不会影响卵巢储备功能、卵巢反应及获卵数[6]。本研究中A、B两组患者平均年龄均小于35岁,并且两组患者cycle2与cycle1之间相差不到1年时间,排除了年龄因素对再次试管周期获卵及胚胎质量的影响。但年龄在反应卵巢储备功能上具有个体差异,就个体而言,卵巢年龄与实际年龄并不总是一致,年龄只是预测获卵情况的初略指标,应结合其他影响因素综合评估。
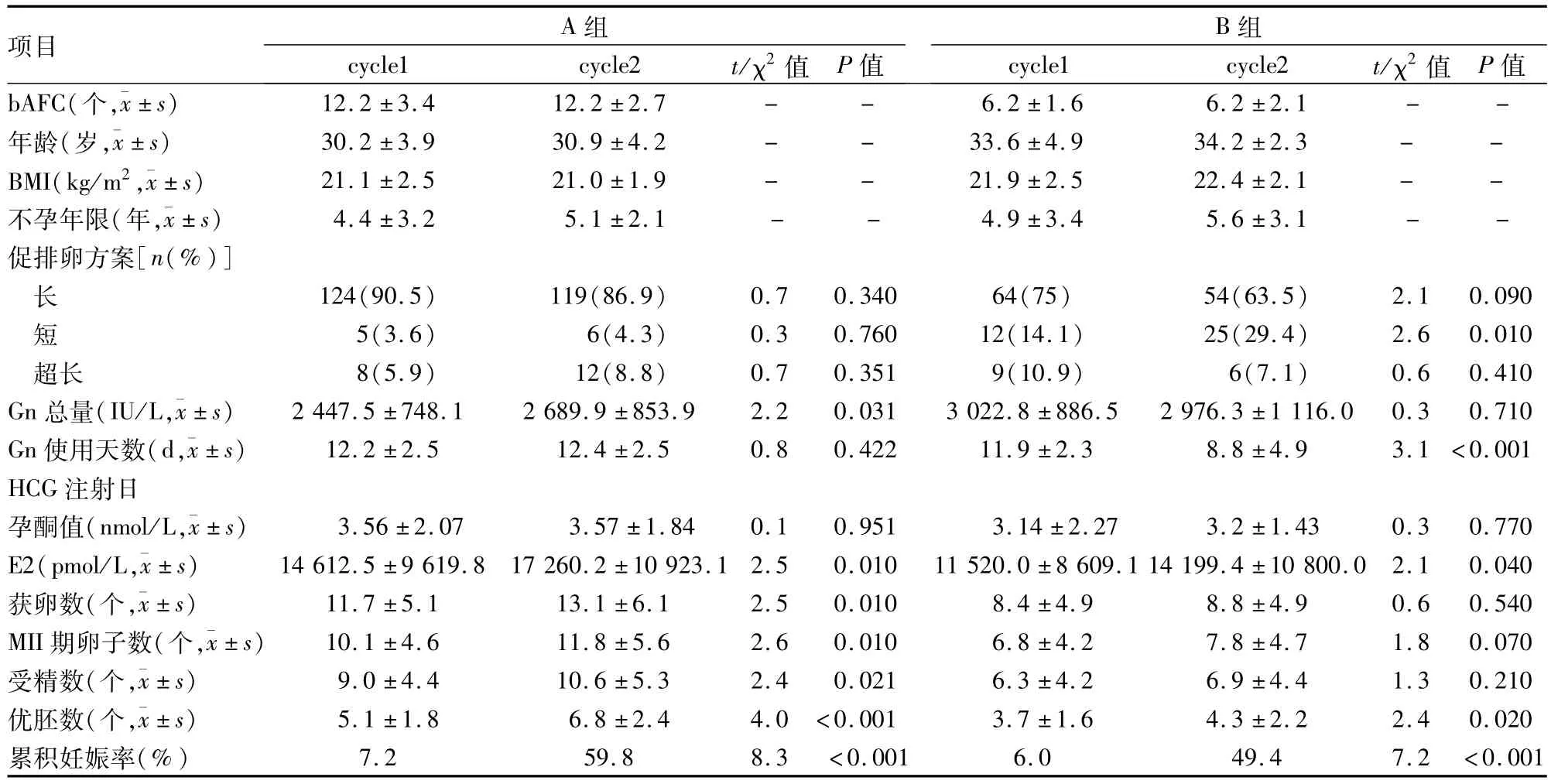
表1 A、B组前后两周期间相关因素分析
表2 B组中由长方案转为短方案对获卵数的影响()

表2 B组中由长方案转为短方案对获卵数的影响()
bAFC是指在月经周期的第3天经阴道超声检测直径在2~9 mm的卵泡数目,其反映了卵泡池中储备的卵泡数。研究[7]显示月经周期及生育力正常妇女的bAFC与实际年龄关系最紧密,Hendriks et al[8]也认为bAFC是评价卵巢储备的最佳单一指标,因此,在IVF-ET超促排卵时bAFC能对成熟卵泡总数进行很好的预测。在我国,卵巢储备功能低下的患者占辅助生殖人群的10%左右。这类患者在IVF治疗中,常因无足够数量的卵泡发育导致未能获得可移植的胚胎而取消周期。然而,bAFC降到多少才是卵巢储备功能减退,目前国内外文献报道的结论不一,AFC的范围在3~10不等[9-10]。本研究显示A组患者cycle1与cycle2的获卵数均高于B组患者。并且在A组中相对于cycle1中的获卵数,cycle2中平均每位患者约增加2枚卵子,这在一定程度上可以提高妊娠率。但是在B组中,cycle2中的获卵数并未增加,这一结果与Eppsteiner et al[11]的结果相符,即对于卵巢功能较差的患者再次IVF周期的获卵数、MII期卵子数没有改善。
本研究A组前后两周期间所使用的方案并无大的变化,其中cycle2 HCG日E2水平、获卵数以及MII期卵子数明显高于cycle1,并且cycle2中所用的Gn总量也高于cycle1,从研究结果来看,A组中cycle2获卵数以及MII期卵子数的增加很可能与Gn量的增加有关。由于前后两周期的促排卵天数并无差异,所以Gn使用总量的增加主要体现在每日Gn使用量的增加,Eppsteiner et al[11]也提出对于卵巢功能正常的患者在再次IVF中适当的增加促排卵药物可以提高获卵率。另外有研究[12]显示,对于年龄小于39岁卵巢储备功能正常的患者来说,每日使用的Gn的量大于200 IU与每日使用100~150 IU相比,可以增加获卵数,但是妊娠率并没有提高,同时有提高发生卵巢过度刺激综合征的风险。因而对于卵巢储备功能正常的患者,再次IVF中为获得更多的成熟卵泡数,并不能单纯的增加Gn的剂量,需要根据前次IVF中Gn使用情况,以及卵巢反应等因素综合考虑。
目前,临床上的促排卵方案有很多种,其中长方案最为多见。针对不同的患者选择合适的促排卵方案是整个试管周期的重要环节。本研究中A组前后两周期促排卵方案无大的变化,以长方案为主。B组cycle2中的短方案明显增多,相对cycle1增加了一倍。将B组中由cycle1中长方案转变为cycle2中短方案的14例患者前后周期进行比较,显示cycle2中Gn使用总量,促排卵天数明显减少,另外获卵数及MII期卵子数显著增高。短方案早期利用了GnRHa的骤发作用使体内FSH上升,加上外源性FSH的应用,对卵泡的刺激作用强,增强卵泡的募集,大大缩短了Gn用药时间,所以相对于长方案,短方案在Gn用药时间及用药量上均较少,本研究结果与之一致。因此,对于卵巢功能减退的患者,首次IVF为长方案且获卵数较低,在再次IVF中换为短方案,很有可能改善获卵数,这与相关研究[13-14]结果一致。
对于卵巢功能正常,首次试管周期获卵数较低的患者在再次试管周期中,可根据前次Gn使用的剂量,结合患者BMI,适当增加Gn的每日使用量来提高获卵数;而对于卵巢功能减退的患者,cycle1为长方案未能获得可观的卵泡数,在cycle2中可改为短方案。临床妊娠率的提高受多方面因素的影响,除了卵子质量及数量影响外,胚胎质量也至关重要。近年来,我中心胚胎培养技术的优化,辅助孵化技术的应用大大改善了胚胎质量,本研究中尽管B组cycle2中获卵数及MII期卵子数并未增加,但cycle2中优胚率、临床妊娠率均比cycle1显著提高。因而,对于首次IVF失败,行再次IVF的患者,应根据患者具体情况,特别是结合卵巢储备功能状况,合理调整患者的治疗方案,同时致力于胚胎实验室技术的优化,临床妊娠率将有望进一步改善。
[1] Moragianni V A,Penzias A S.Cumulative live-birth rates after assisted reproductive technology[J].Curr Opin Obstet Gynecol,2010,22(3):189-92.
[2] Stoop D,Ermini B,Polyzos N P,et al.Reproductive potential of a metaphase II oocyte retrieved after ovarian stimulation:an analysis of 23 354 ICSI cycle[J].Hum Reprod,2012,27(7):2030-5.
[3] Sunkara S K,Rittenberg V,RainevFenning N,et al.Association between the number of eggs and live birth in IVF treatment:an analysis of 400 135 treatment cycles[J].Hum Reprod,2011,26(7):1768-74.
[4] Committee on Gynecologic Practice of American College of Obstetricians and Gynecologists,Practice Committee of American Society for Reproductive Medicine.Age-related fertility decline:a committee opinion[J].Fertil Steril,2008,90(5 Suppl):S154-5.
[5] 陈士岭,罗燕群,夏 容,等.女性年龄与不孕及生育力减退[J].国际生殖健康/计划生育杂志,2011,30(4):265-71.
[6] Luk J,Arici A.Does the ovarian reserve decrease from repeated ovulation stimulations?[J].Curr Opin Obstet Gynecol,2010,22(3):177-82.
[7] Scheffer G J,Broekmans F J,Looman C W,et al.The number of antral follicles in normal womenwith proven fertility is the bestreflection of reproductive age[J].Hum Peprod,2003,18(4):700-6.
[8] Hendriks D J,Kwee J,Mol B W,et al.Ultrasonography as a tool for the prediction of outcome in IVF patients:a comparative meta-analysis of ovrian volume and antral follicle count[J].Fertil Stefil,2007,87(4):764-75.
[9] 陈士岭.卵巢储备功能的评价[J].国际生殖健康/计划生育杂志,2009,28(5):281-6.
[10]Broelanans F J,Kwee J,Hendriks D J,et al.A systematic review of tests predicting ovarian reserve and IVF outcome[J].Hum Reprod Update,2006,12(6):685-718.
[11]Eppsteiner E E,Sparks A E,Liu D,et al.Change in oocyte yield in repeated in vitro fertilization cycles:effect of ovarian reserve[J].Fertil Steril,2014,101(2):399-402.
[12]Sterrenberg M D,Veltman-Verhulst S M,Eijkemans M J,et al.Clinical outcomes in relation to the daily dose of recombinant follicle-stimulating hormone for ovarian stimulationin in vitro fertilization in presumed normal responders younger than 39 years:a metaanalysis[J].Hum Reprod Update,2011,17(2):184-96.
[13]Malmusi S,La Marca A,Giulini S,et al.Comparison of a gonadotropin-releasing hormone(GnRH)antagonist and GnRH agonist flare-up regimen in poor responders undergoing ovarian stimulation[J].Fertil Steril,2005,84(2):402-6.
[14]徐千花,曹云霞,魏兆莲,等.不同促排卵方法在卵巢储备功能下降患者中的应用[J].生殖与避孕,2009,29(1):51-4.
Change in ocyte yield in repeated in vitro fertilization cycles and analysis of related factors
Han Dan,Zhang Zhiguo,Hao Yan,et al
(Reproductive Medical Center,The First Affiliated Hospital of Anhui Medical University,Institute of Reproductive Genetics,Anhui Medical University,Anhui Provincial Engineering Technology Research Center for Biopreservation and Artificial Organs,Hefei 230022)
ObjectiveTo examine the change in total and mature oocyte yield between consecutive IVF cycles and disscuss the factors that predict this change.MethodsA retrospective analysis of the clinical data and outcomeswas conducted among 222 women starting two IVF/ICSI cycles within 12 months.According to the bAFC,patients were divided into group A(AFC≥9)and group B(AFC<9).The basic condition of the patients,the change in total and mature oocyte yield,fertilition rate,high quality embryo rate,the cumulative pregnancy rate were compared between the consecutive IVF cycles in each group.ResultsIn group A,the number of eggs,MII,fertilization rate,high quality embryo rate,the cumulative pregnancy rate in the second IVF cycle were significantly higher than that of the first cycle(P<0.05).The clinical scheme had no big changes between the cycles,all with long program was given priority to.But in the second cycle,the Gn usage was higher than the previous period(P<0.05).In group B,there was no significant difference in both total and mature oocytes between the cycles.Howerer,the optimal embryo rate,cumulative pregnancy rate and the number of short program significantly increased in the second cycle(P<0.05).Among group B,14 patients used long program in the first cycle,and converted into a short program in the second cycle,which attained more eggs and MII than the former(P<0.05).ConclusionAn increase in total and mature oocyte yield between cycles is found in women with normal ovarian reserve and is associated with an appropriately increased in daily Gn used dose in the second cycle.Compared with the long program,the short program may be more suitable in patients with diminished ovarian reserve.
repeated in vitro fertilization and embryo transfer;the number of oocytes;repeated cycle;ovulation induction
R 321.2
A
1000-1492(2015)12-1781-05
时间:2015-11-18 10:12:34
http://www.cnki.net/KCMS/detail/34.1065.R.20151118.1012.034.html
2015-07-07接收
国家重大科学研究计划(编号:2012CB944704);安徽医科大学第一附属医院2015年度国家自然科学基金青年科学基金培养计划(编号:2015KJ03)
安徽医科大学第一附属医院生殖医学中心、安徽医科大
学生殖与遗传研究所、安徽省生命资源保存与人工器官工程技术研究中心,合肥 230022
韩丹,女,硕士研究生;
曹云霞,女,教授,主任医师,博士生导师,责任作者,E-mail:caoyunxia6@126.com;
周 平,女,副教授,主任医师,硕士生导师,责任作者,E-mail:zhoup_325@aliyun.com

