利用生物信息学研究Tgfβ信号通路在人类结直肠癌发生发展中的作用*
胡海星,张仕超,朱 旋,范雄伟*
(1.长沙环境保护职业技术学院,湖南 长沙410004;2.湖南师范大学 蛋白质化学及鱼类发育生物学教育部重点实验室 心脏发育研究中心,湖南 长沙410081)
我国结直肠癌死亡率位于恶性肿瘤死亡率的第四位,且发病率一直呈上升趋势,严重危害人类健康。结直肠癌的发生与饮食、环境、遗传等因素密切相关,其发病机理一直以来是肿瘤研究领域的研究热点之一,Tgfβ信号通路在结直肠癌中发生发展中发挥重要作用以被人所熟知,但在人类结直肠癌发生中具体分子机制和贡献大小还远未阐明。
转化生长因子β(Transforming growth factor)超家族是一类包含了相似结构、功能的多肽生长因子,其中包括TGF-βs、生长分化因子(Growth and differentiation factor,GDFs)、骨形态发生蛋白(Bone morphogenetic proteins,BMPs)等30多个成员[1,2]。这些配体分子总是先结合并激活膜上的二型受体(TgfβRⅡ,BmpRⅡ),二型受体招募一型受体(TgfβRI,BmpRI)二聚化而磷酸化下游的R-Smads(Smad1,2,3,5,8),进而与co-Smad(Smad4)结合,以异源多聚体的形式,共同入核调节下游如P27、P21、BIM等靶基因,对细胞的增殖、凋亡、迁移、免疫和炎症发挥重要作用。而I-Smads(Smad6、Smad7)通过竞争结合一型受体而抑制R-Smads的活化,由于多数CKI与抑癌基因均为Tgfβ下游靶点。所以Tgfβ信号被广泛的认为是抗癌信号。诚然,体内外实验证明,肠的组织或者细胞中 缺 失Smad4[3-6]、Smad3[7]、BMPR1[8]、TgfβRI[9]由于逃避了Tgfβ信号的控制,均能发展为癌,而TgfβRII[10-12]与GDF15[13,14]缺失的小鼠,虽然不能直接发展成癌,但对结直肠癌的肝转移与耐药方面产生重要贡献。在以往的报道中,几乎所有的经典Tgfβ信号超家族的成员均无一例外的呈现出其抑癌作用,并且,具有抑制经典信号的Smad7在结直肠癌发生恰好表现为促癌作用。尽管这样,这并不能证明在人类结直肠癌发生就是源自于Tgfβ信号丧失。Abadie C[15]等表明,TgfβRI与直肠癌发生风险并无关系,Fukushima T[16]等在人类直肠癌突变分析中也没有发现Smad2,Smad3,Smad6,Smad7的改变。此外,在肠癌的发生当中Tgfβ信号成员也并不是表现为一致性的下调,比如Tgfβ1、Tgfβ2在肠癌中就呈现上调趋势,且表达水平与恶性程度相关。显而易见,基于基因敲除或者转基因技术,虽然可以逐一的分拣出Tgfβ信号通路各个成员对肿瘤发生的功能。但是反向遗传学的手段却人为的改变的发病的始动因素,无法真实吻合发病的分子事件。所以并不能解决肿瘤的发病机制从而也很难寻找到干预疾病的真实方法。除此以外,同一信号通路中的各个成员,在发挥功能的同时存在上下游的相互依存关系。当某些下游的分子发生改变时,上游的信号转导将极有可能重新建立新的传导通路。在Tgfβ信号通路中,有报道经典的信号通道在受体环节受阻将激活非经典信号通道,其间涉及到RAS、MAPK、AKT等,而这些信号恰好与经典的Tgfβ信号通路相反,他们经常作为癌基因和促癌因子被报道。所以真实病理情况下,Tgfβ信号在肠癌的发生发展中作用比人想象的要复杂的多。为了了解Tgfβ信号在肠癌的发生中的真实作用,需要有一种系统的方法,首先在肠癌的发生早期病理标本中,全面检测所有Tgfβ信号成员的变化,然后依据各自不同功能,才可能推测Tgfβ信号通路在肠癌的发生中真实的作用机制。
本文通过生物信息学的方法,获取已经报道的肠癌早期芯片结果,在转录水平上检测了27个Tgfβ经典信号成员的表达变化关系。发现在肠癌的发生早期,Smad2 Smad4的下调阻断经典的Tgfβ信号的抗肿瘤作用,同时配体分子GDF2 GDF3和受体分子Tgfbr2、Tgfbr3的广泛上调可能刺激旁路分子的激活导致肿瘤的发生。
1 材料与方法
1.1 材料
所有结直肠癌有关的全基因组表达芯片数据均来源于GEO数据库(http://www.ncbi.nlm.gov/geo/)。本研究中设定搜索关键词为“colorectal cancer”,限制研究类型为“expression profiling by array”
1.2 方法
1.2.1 文献纳入标准 符合以下标准的数据集将纳入研究对象①数据集必须是有文献支持的全基因组mRNA表达芯片数据;②每套数据均有肠癌疾病组织和正常组织对照;③本次均考虑原始或者经标准化数据集;④每套数据集必须包括3个以上样本;⑤数据集采用的样本必须是人体活检肠癌组织。根据筛选标准,总共筛选到12组符合标准的基因芯片数据。
1.2.2 数据处理 在GEO的supplementary file中下载基因芯片的CEL数据压缩包,并解压至一个文件夹中待用,同时下载TXT格式的样本原始数据;若下载数据处没有显示CEL数据压缩包,则在scope、format、amount中分别选择samples、soft、full下载该样本TXT格式的原始数据,通过UltralEdit软件处理的soft文件显示基因的名称,每套样本数据的基本信息记录在提供的excel里。采用每一个数据组跟正常组平均值进行比较对样本进行标准化处理。
1.2.3 数据分析 根据KEGG中Tgfβ信号通路成员的信息,在24组基因芯片结果中筛选出共同研究基因,使用T-TEST函数计算每一个基因表达差异的显著性,P<0.05,则表示差异具有显著性意义。最后根据标准化后的平均数值统计其上下调基因。
2 结果
2.1 利用生物信息学在芯片中获取待测Tgfβ信号通路成员的表达数据
根据纳入标准,最终筛选出12组基因芯片结果。利用KEGG选择Tgfβ信号通路共27经典通路的成员,在12组钓取所有成员基因芯片结果数据,与12个正常组芯片的平均值,获得每一组芯片该成员分子相对表达量信息,罗列于表1。
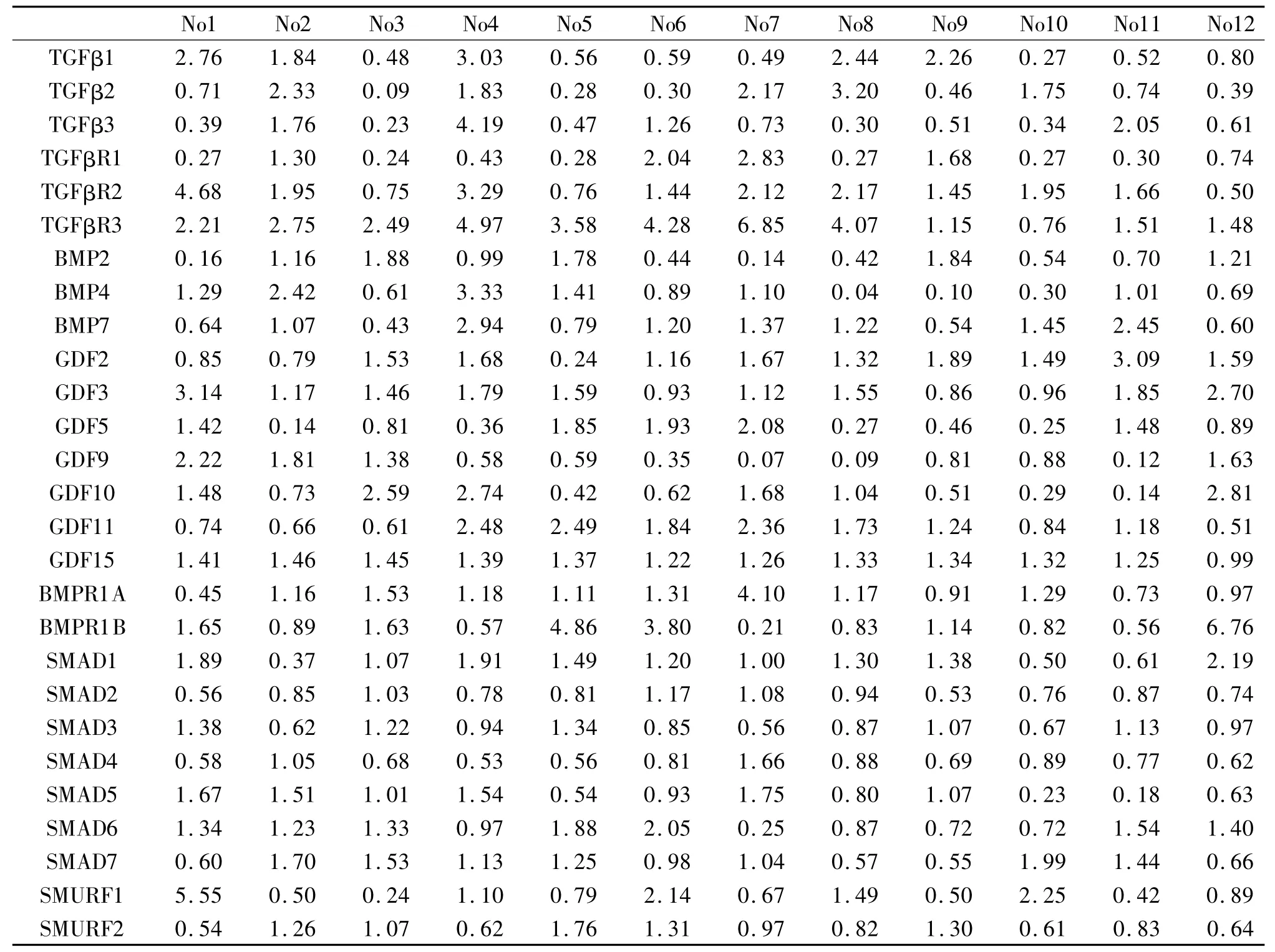
表1 Tgfβ信号通路分子在早期结直肠癌芯片中表达变化Tab.1 The changes of Tgfβsignaling pathway factor in the microarray of early colorectal cancer
2.2 Tgfβ信号通路中成员在人类早期结直肠癌的表达差异分析
对筛选27个基因进行差异性分析,发现与对照组相比在心脏疾病中,显著性上调基因包括TGFβR2、TGFβR3、GDF3(P<0.05),GDF2也有上调的趋势(P=0.051)显著性下调基因有Smad2、GDF15(P<0.05),Smad4也有下调的趋势(P=0.057),其他成员均有下调或者上调现象但均未达到显著性意义,(图1)
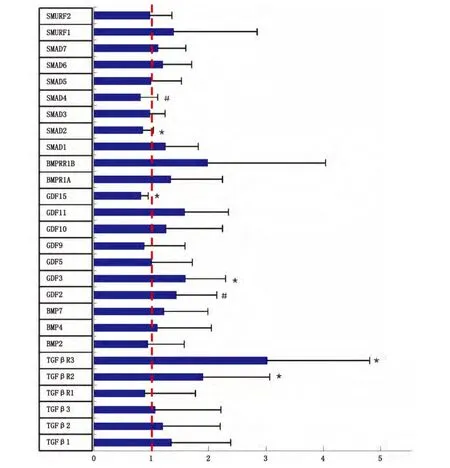
图1 统计分析基因的表达水平(*P<0.05#P<0.06)Fig.1 Statistical Analysis determined the levels of gene expression
3 讨论
Tgfβ信号通路的经典成员具有抑制结肠癌的功能,但在人类结肠癌的发生过程当中Tgfβ信号通路是否真正参与其中,这需要系统性对整个信号通路成员在结肠癌的发生早期病理标本中,检测所有各成员的表达变化关系,才能找到Tgfβ信号通路调节结肠癌发生的线索为临床早期诊断、干预带来积极效应。广泛的收集人类早期结肠癌标本,并通过常规的分子生物学检测所有成员的表达变化并不是一件容易的事。但是生物信息学的发展,使我们能在数据库中直接看到一个标本在全转录本中的表达变化,而这些已发表的芯片数据结果其一致性和可靠性已经过了同行的审验与认可,但是提供芯片数据的作者往往只关注其自身的科学问题,而芯片内含的其他方面数据价值却被搁置。所以从以往的数据中提出新问题,得到新结论,是一种值得去做的工作。且从别人的数据中得到支持自己的证据,由于排除了主观的倾向性,二度利用的数据比首次利用更为客观。基于此,我们找到12组符合纳入标准的早期结肠癌芯片,并发现结肠癌早期Tgfβ信号通路的经典成员的Smad2 Smad4表达下降,而Tgfbr 2 Tgfbr 3 GDF3 GDF2上调。研究表明,Smad4存在明显的抗癌作用[3],缺失了Smad4的小鼠,导致严重的肠癌[4],结肠癌细胞中丧失了Smad4将容易发生肝脏转移[5]。当Smad4表达下降时,有可能导致经典的Tgfβ信号丧失效应,而与此同时Tgfbr 2 Tgfbr 3 GDF3 GDF2上调也有可能不再转导经典的信号,而激活旁路。研究发现,当Smad4缺失时,BMP信号将会激活Rho AKT信号[17-19],而促进肿瘤形成。由此根据我们结果,我们推测在结肠癌早期,一方面,Smad2 Smad4的下调阻断经典的Tgfβ信号的抗肿瘤作用,另一方面,配体分子GDF2 GDF3和受体分子Tgfbr2、Tgfbr3的广泛上调可能刺激旁路分子的激活从在肿瘤的发生中发挥重要作用(图2)。提示旁路的抑制与经典通路的重新激活的联合策略有可能在干预早期结肠癌带来贡献。
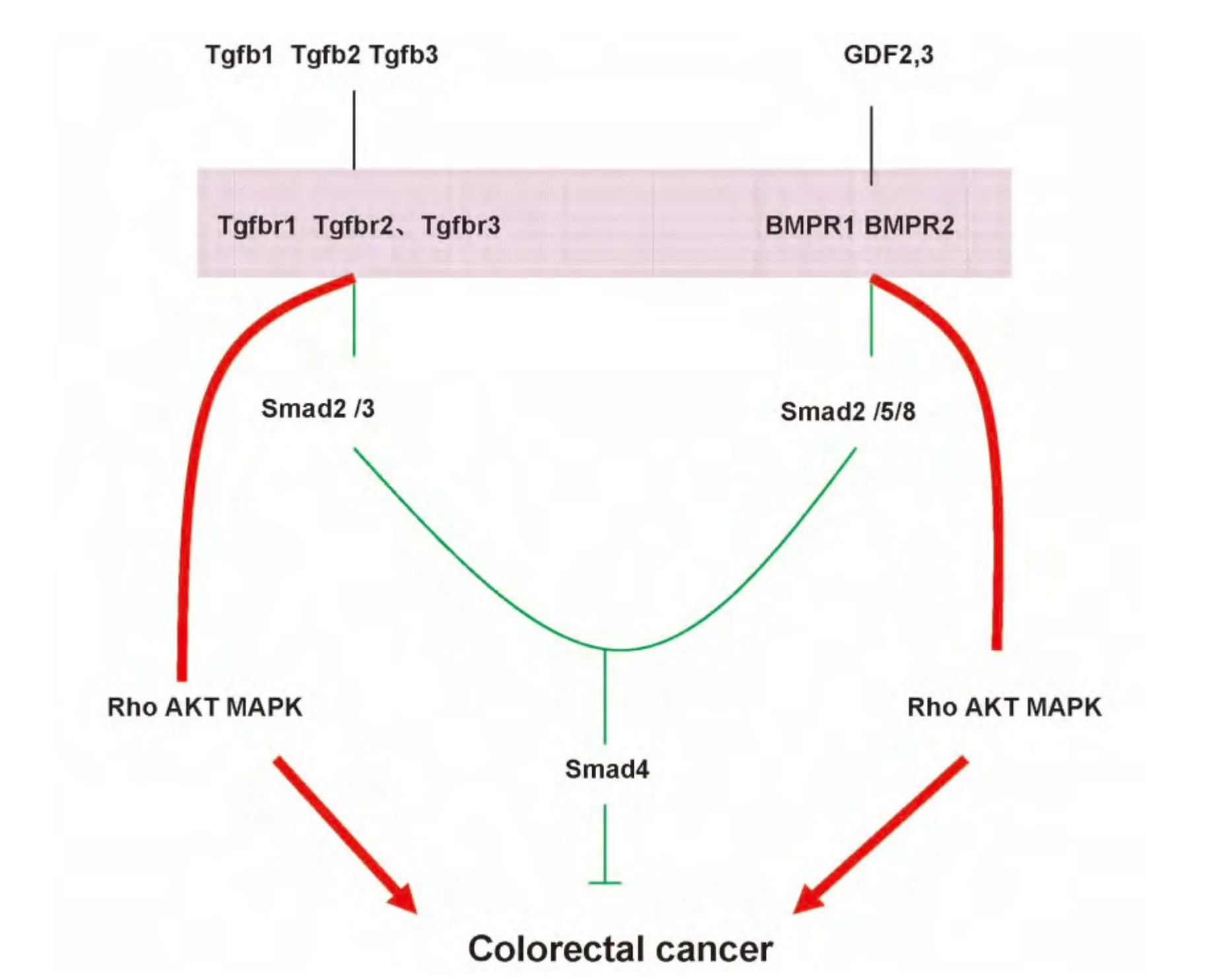
图2 Tgfβ信号通路在结肠癌发生中的作用机制Fig.2 The roles of Tgfβsignaling pathway in the occurrence of colorectal cancer
[1] MASSAGUÉJ.Tgf-beta signal transduction[J].Annu Rev Biochem,1998,67:753-791.
[2] LAMPROPOULOS P,ZIZI-SERMPETZOGLOU A,RIZOS S,et al.Tgf-beta signaling in colon carcinogenesis[J].Cancer Lett,2012,314(1):1-7.
[3] ITATANI Y,KAWADA K,FUJISHITA T,et al.Loss of SMAD4 from colorectal cancer cells promotes CCL15 expression to recruit CCR1+ myeloid cells and facilitate liver metastasis[J].Gastroenterology,2013,145(5):1064-1075.
[4] ZHANG B,HALDER SK,KASHIKAR N D,et al.Antimetastatic role of Smad4 signaling in colorectal cancer[J].Gastroenterology,2010,138(3):969-980.
[5] HALDER SK,RACHAKONDA G,DEANE N G,et al.Smad7 induces hepatic metastasis in colorectal cancer[J].Br J Cancer,2008,99(6):957-965.
[6] TAKAKU K,OSHIMA M,MIYOSHI H,et al.Intestinal tumorigenesis in compound mutant mice of both Dpc4(Smad4)and Apc genes[J].Cell,1998,92(5):645-656.
[7] ZHU Y,RICHARDSON JA,PARADA L F,et al.Smad3 mutant mice develop metastatic colorectal cancer[J].Cell,1998,94(6):703-714.
[8] LORENTE-TRIGOSA,VARNAT F,MELOTTIA,et al.BMP signaling promotes the growth of primary human colon carcinomasin vivo[J].JMol Cell Biol,2010,2(6):318-332.
[9] WANG J,HAN W,ZBOROWSKA E,et al.Reduced expression of transforming growth factor beta type Ireceptor contributes to the malignancy of human colon carcinoma cells[J].J Biol Chem,1996,271(29):17366-17371.
[10] MORRISSM,CARTERK T,BAEK JY,et al.TGF-βsignaling alters the pattern of liver tumorigenesis induced by Pten inactivation[J].Oncogene,2014 Aug 18,[Epub ahead of print].
[11] SIMMS N A,RAJPUT A,SHARRATT E A,et al.Transforming growth factor-βsuppresses metastasis in a subset of human colon carcinoma cells[J].BMC Cancer,2012,12:221.
[12] FU Y,LIU X,ZHOU N,et al.MicroRNA-200b stimulates tumour growth in TGFBR2-null colorectal cancers by negatively regulating p27/kip1[J].JCell Physiol,2014,229(6):772-782.
[13] ZIMMERS T A,GUTIERREZ J C,KONIARIS L G.Loss of GDF-15 abolishes sulindac chemoprevention in the ApcMin/+mouse model of intestinal cancer[J].J Cancer Res Clin Oncol,2010,136(4):571-576.
[14] ZIMMERST A,GUTIERREZ J C,KONIARIS L G.NAG-1/GDF-15:no evidence for an inhibitory role in colon cancer[J].Gastroenterology,2007,132(3):1204-1205.
[15] ABADIE C,KILLIAN A,TINAT J,et al.Allelic imbalance of the TGFβR1 is not a major contributor to the genetic predisposition to colorectal cancer[J].Br J Cancer,2011,104(9):1517-1518,author reply 1519-1520.
[16] BEVAN S,WOODFORD-RICHENS K,ROZEN P,et al.Screening SMAD1,SMAD2,SMAD3,and SMAD5 for germline mutations in juvenile polyposis syndrome[J].Gut,1999,45(3):406-408.
[17] VOORNEVELD P W,KODACH L L,JACOBS R J,et al.Loss of SMAD4 alters BMPsignaling to promote colorectal cancer cell metastasis via activation of Rho and ROCK[J].Gastroenterology,2014,147(1):196-208.
[18] KANG M H,KANGH N,KIM JL,et al.Inhibition of PI3 kinase/Akt pathway isrequired for BMP2-induced EMTand invasion[J].Oncol Rep,2009,22(3):525-534.
[19] KODACH L L,WIERCINSKA E,DE MIRANDA N F,et al.The bone morphogenetic protein pathway is inactivated in the majority of sporadic colorectal cancers[J].Gastroenterology,2008,134(5):1332-1341.

