TRAF4调控人结直肠癌细胞增殖的机制研究*
李 伟,罗 霞,马小倩*
(1.中南大学湘雅三医院细胞移植与基因治疗中心,湖南 长沙410013;2.湖南省肿瘤医院/中南大学湘雅医学院附属肿瘤医院中心实验室,湖南 长沙410013)
结直肠癌是我国最常见的恶性肿瘤之一,其发病率和死亡率分居恶性肿瘤的第六位和第五位,发病人数呈逐年上升趋势[1]。结直肠癌的发病与人的生活方式、饮食结构及遗传背景密切相关。早期结直肠癌以外科手术治疗为主,然而由于结直肠癌早期发病隐匿,近1/3的患者在初诊时已是晚期,失去了根治性手术治疗的机会。虽然目前研究证实APC,EGFR和k-ras等基因的突变直接参与了结直肠癌的发生发展[2],而且针对EGFR等蛋白的靶向性药物如西妥昔单抗也已成功用于临床[3],但由于结直肠癌患者本身对靶向性药物的不敏感,或者是对靶向药物和化疗药物的继发耐药,晚期结直肠癌患者的预后并不乐观[4]。深入研究结直肠癌发病的分子机制,寻找新的药物作用靶点和开发新的预防与治疗手段已成为亟待解决的医学难题。
TRAF4(Tumor necrosis factor receptor associated factor 4)因在人乳腺癌转移的淋巴结组织中基因扩增和蛋白高表达而被首次发现[5]。与其他TRAF家族成员不同的是,TRAF4最重要的生理功能似乎并不是调控体内的免疫及炎症反应,而是参与调节胚胎及中枢神经系统发育[6]。近年来,越来越多的研究发现,TRAF4在多种肿瘤细胞及肿瘤组织中存在异常的高表达,包括乳腺癌、肺癌和结直肠癌等[7],但TRAF4高表达的分子机制及其介导的生物学功能还不清楚,关于TRAF4与结直肠癌发病的相关研究还少有文献报道。TRAF4高表达是否促进了结直肠癌的恶性表型?本研究将以结直肠癌为研究模型,以糖代谢为切入点,从细胞增殖及凋亡等角度研究TRAF4对结直肠癌细胞恶性表现及糖代谢的调控。
1 材料与方法
1.1 细胞系
人结直肠癌细胞系HCT116和SW620细胞购自美国ATCC。细胞用含有10%FBS和1%双抗生素的Dulbecco's Modified Eagle Medium(DMEM)培基常规培养,每1-2天换液,细胞融合度达到80%时传代。
1.2 主要试剂/试剂盒和主要抗体和仪器
常用化学试剂均购自Sigma公司。DMEM培基,胎牛血清(Fetal Bovine Serum,FBS)和双抗生素(青霉素 和 链 霉 素,P&S)购 自invitrogen公 司;p-Akt-Ser473(#4060),HK2(#2867),VDAC(#4661),cleaved-caspase3(#9664)和cleaved-PARP(#5625)抗体购自Cell Signaling Technology公司;TRAF4(sc-10776),α-tubulin(sc-8035)和β-actin(sc-47778)抗体购自Santa Cruz公司。CellTiter 96®AQueous One Solution Cell Proliferation Assay Kit购自promega,BCA蛋白定量试剂盒购自Pierce,Polybrene和puromycin购 自 Millipore 公 司。pLKO.1-shTRAF4 (#1,TRCN0000034242;#2,TRCN0000034243)质粒购自Thermo(open biosystem)。
1.3 主要方法
1.3.1 慢病毒感染介导的基因沉默
A.慢病毒的包装及收集:取对数生长期293T细胞,按照2×106/皿接种于10 cm细胞培养皿中。次日,将含有TRAF4 shRNA序列的慢病毒质粒与包装质粒PSPAX2和PMD2G按照质量比4∶3∶1(总质量8μg)的比例共转染293T细胞。次日,弃培基,更换新的DMEM完全培基。48 h后,收集细胞培养液上清(含病毒),4 000 r/min离心5 min去除细胞残渣,并经0.45μmol/L滤器过滤,上清中即含有包装成功的慢病毒颗粒。
B.慢病毒感染:将适量处于对数生长期的细胞接种于10 cm培养皿中。次日,取7 mL新鲜培基与3 mL病毒悬液,加入终浓度为10μg/mL的polybrane,混匀后加入待感染的细胞中,5%CO2培养箱,37℃培养24小时。第三天,弃培基,加入含有1μg/mL puromycin的新鲜培基,进行稳定细胞系的筛选培养。待puromycin将对照组细胞(未感染病毒组)全部杀死(通常为2~3天全部死亡),而存活的病毒感染组细胞即为基因沉默的稳定细胞系。收集细胞裂解液,western blot鉴定细胞系及基因沉默效率。
1.3.2 停泊非依赖生长(软琼脂集落形成)实验
A.准备1.25%琼脂凝胶和2×BME并46℃保温备用。
B.准备下层琼脂凝胶(180 mL体系):其中含有2×BME(70 mL),L-Glutamine(2 mL),Gentamicin(100μL),1×PBS(18 mL),FBS(18 mL)。预热后加入1.25%agar(72 mL)。
将准备好的下层琼脂凝胶迅速加入六孔板中,每孔3 mL,超净台中静置1 h,使其充分凝固。
C.制备细胞悬液。取对数生长期细胞,消化后计数,用含10%FBS的1×BME稀释成24 000/mL细胞悬液备用。
D.制备含有细胞悬液的上层凝胶。取下层凝胶2.4 mL(含不同浓度的辣椒素),加入1.2 mL细胞悬液,轻轻吹打混匀,迅速加入含有下层凝胶的六孔板中,每孔1 mL。
待上层琼脂凝固后,置于37℃,5%CO2培养箱中培养,静置1-3周。用显微镜进行克隆统计。
1.3.3 细胞线粒体抽提及蛋白质浓度测定和Western blotting分析
将细胞(不少于1×107)消化后,800 r/min离心5 min,弃上清,1×PBS洗1次,弃PBS,加入线粒体抽提液(MSHE+BSA:70 mmol/L sucrose,210 mmol/L mannitol,5.0 mmol/L HEPES,1.0 mmmol/L EGTA,0.5%(W/V)fatty acid free-BSA和蛋白酶Cocktail抑制剂,调PH值至7.2)1 mL,冰上放置3 min后,将上述溶液转移至玻璃匀浆器,冰上匀浆40-60次。转移研磨后的悬液至EP管中,漩涡震荡15 s,2 000 r/min,4℃离心10 min。转移上清至新的EP管,13 000 r/min,4℃离心30 min。弃上清,向沉淀中加入0.2 mL线粒体抽提液,漩涡震荡15 s,将沉淀重悬,13 000 r/min,4℃离心10 min。弃上清,所得沉淀即为线粒体。向沉淀中加入0.1 mL含蛋白酶抑制剂cocktail的RIPA(25 mmol/Ltris·HCl PH7.6,150 mmol/L NaCl,1% NP-40,1% sodium deoxycholate,0.1%SDS)裂解液,冰上放置30 min,适当超声破碎,13 000 r/min,4℃离心15 min。上清即为线粒体蛋白。蛋白浓度用BCA蛋白定量试剂盒测定。取30μg蛋白在变性不连续SDS-PAGE电泳中分离并电转移至硝酸纤维膜。含蛋白的硝酸纤维膜置于5%脱脂牛奶中室温封闭2 h,再与特异性单克隆抗体4℃孵育过夜,1×PBST洗涤三次,每次10 min。二抗室温孵育1 h,1×PBST洗涤三次,每次10 min,加入ECL化学发光底物,X光片曝光、显影、定影。
1.3.4 细胞葡萄糖摄取及乳酸生成速率测定
取5×105个处于对数生长期的细胞接种于6孔板,待细胞贴壁后(4 h左右),更换新鲜培养基,继续培养8 h后收集细胞培养上清。在湘雅医院检验科生化实验室用全自动临床生化检测仪(Automatic biochemical analyzer,7170A,HITACHI,Japan)检测培养上清中葡萄糖及乳酸含量。全自动临床生化检测仪在每次使用时均用标准品进行校正。
1.3.5 统计学分析
实验数据利用SPSS 13.0统计软件包进行统计学分析,统计不同时间、不同组别间的比较采用多因素的方差分析,实验组与对照组间的比较采用t检验。*代表P<0.05,说明两组之间具有显著性差异。
2 实验结果
2.1 基因沉默TRAF4抑制结直肠癌细胞生长
首先,我们采用MTS的实验方法检测基因沉默TRAF4对结直肠癌细胞系停泊依赖增殖的影响。结果如图1所示,TRAF4表达抑制后,明显抑制了SW620(图1,左)和HCT116(图1,右)细胞的增殖。
进一步,利用克隆形成实验,我们检测了基因沉默TRAF4对结直肠癌细胞系软琼脂集落形成能力这一恶性表型的影响。结果显示,下调TRAF4明显抑制了SW620(图2,左)和HCT116(图2,右)的停泊非依赖生长。
2.2 基因沉默TRAF4抑制EGF诱导的Akt活化
结直肠癌细胞的快速增殖常Akt信号通路的异常激活有关,基因沉默TRAF4抑制了结直肠癌细胞的停泊依赖和非依赖生长,这是否与Akt的活性改变有关?我们检测了HCT116细胞,基因沉默TRAF4后对EGF(50μg/mL)诱导的Akt活化的影响,结果显示,TRAF4表达下调抑制了EGF诱导的Akt磷酸化活化(图3,左),但不影响IGF1(50μg/mL)诱导的Akt磷酸化活化(图3,右)。
2.3 基因沉默TRAF4下调结直肠癌细胞糖酵解
Akt磷酸化活化对肿瘤细胞糖代谢至关重要。我们发现,基因沉默TRAF4在下调Akt磷酸化的同时明显抑制了结直肠癌细胞SW620(图4,上)和HCT116(图4,下)己糖激酶的表达(图4,左上;图4,左下)。进一步实验发现,己糖激酶表达的下调伴随着细胞有氧糖酵解的抑制。基因沉默TRAF4明显抑制了结直肠癌细胞葡萄糖的摄取速率(图4,上中;图4,上中)和乳酸的生成效率(图4,右上;图5,右下)。
2.4 基因沉默TRAF4下调HK2的线粒体表达并上调结直肠癌细胞对5-Fu的敏感性
己糖激酶HK2定位于线粒体外膜不仅可以增加细胞糖酵解的效率,而且可以促进肿瘤细胞对化疗药物的耐受增强其抗凋亡能力。抽提线粒体蛋白,我们研究发现,基因沉默TRAF4明显抑制了HK2在线粒体的表达水平(图5,左)。而且,我们给予HCT116细胞5μmol/L 5-Fu处理24 h,TRAF4基因沉默组出现细胞死亡,免疫印迹检测可发现caspase3和PARP出现明显的剪切体(图5,右)。
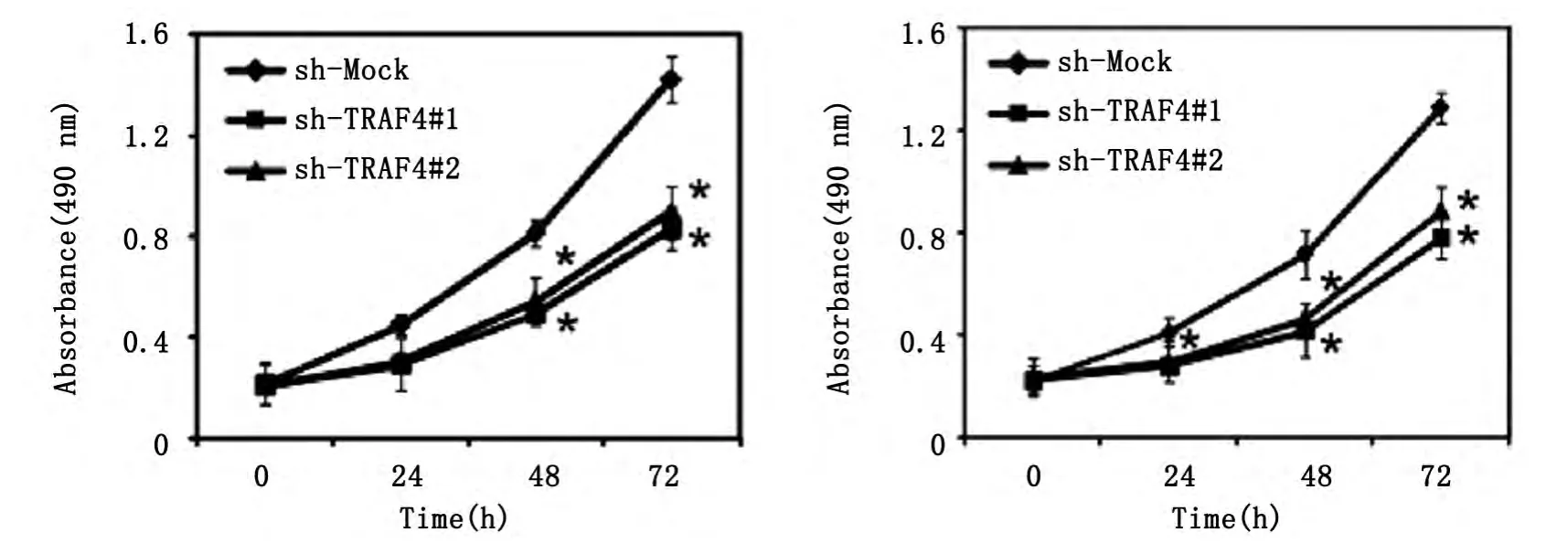
图1 基因沉默TRAF4抑制SW620(左)和HCT116(右)细胞停泊依赖生长(P<0.05)Fig.1 Knockdown TRAF4 attenuates SW620(left)and HCT116(right)cells anchorage-dependent growth(P<0.05)

图2 基因沉默TRAF4抑制SW620(上)和HCT116(下)细胞停泊非依赖生长生长(P<0.05)Fig.2 Knockdown TRAF4 attenuates SW620(top)and HCT116(bottom)cells anchorage-independent growth(P<0.05)

图3 基因沉默TRAF4下调EGF诱导的Akt活化(左),但不影响IGF1诱导的Akt活化(右)Fig.3 Knockdown TRAF4 decreases EGF-induced Akt activation(left),but have no obvious effect on IGF1-induced Akt phosphorylation(right)
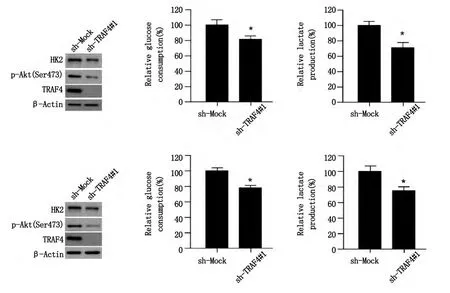
图4 基因沉默TRAF4抑制结直肠癌细胞SW620(上)和HCT116(下)糖代谢(P<0.05)Fig.4 Knockdown TRAF4 inhibits glycolysis in SW620(top)and HCT116(bottom)colon cancer cells(P<0.05)
3 讨论
越来越多的研究表明,TRAF4过表达与肿瘤发生发展密切相关。在已有的多种上皮来源的恶性肿瘤,淋巴瘤及其他类型肿瘤如恶性胸膜间皮瘤中都已检测到TRAF4的过表达。虽然在免疫系统相关疾病研究中证实TRAF4参与调控多条信号通路的活化,如TRAF4通过与NOD2相互作用而抑制先天性免疫反应[8],TRAF4介导了GITR诱导的NF-κB激活[9],但TRAF4在多种肿瘤中高表达的生物学功能还不清楚。最新研究发现,在乳腺癌中,TRAF4通过上调TGF-β受体信号通路,诱导乳腺癌细胞的上皮间质转化从而促进乳腺癌细胞的侵袭转移[10]。我们的研究发现,TRAF4与结直肠癌细胞的快速增殖及克隆形成能力等恶性表型密切相关。基因沉默TRAF4表达不仅可明显抑制SW620和HCT116细胞的增殖(图1),而且显著下调这两种肿瘤细胞的软琼脂克隆形成能力(图2)。研究表明,在结直肠癌中,由于EGFR或k-ras基因突变导致的下游信号异常活化是结直肠癌细胞快速增殖的主要原因之一。而且,文献报道业已证实,在肺癌中,TRAF4过表达直接参与了Akt磷酸化活化[11]。我们研究发现在结直肠癌细胞HCT116中,基因沉默TRAF4同样能明显抑制EGF诱导的Akt磷酸化活化(图3),这提示在结直肠癌中,Akt的活化与该类肿瘤的快速增殖密切相关。
为了维持持续快速的增殖,多种肿瘤细胞即使在有氧情况下仍然采用糖酵解的方式来快速产生ATP作为其主要的供能方式,这一现象被称为Warburg效应[12]。有氧糖酵解不仅为肿瘤细胞提供有效的能量供给,其产生的中间代谢产物也为肿瘤细胞快速增殖过程中的生物合成提供足够的中间分子。以肿瘤细胞异常活化的糖酵解为原理开发的PET-CT技术已成为目前肿瘤影像诊断的重要手段之一。我们发现,在HCT116和SW620细胞内基因沉默TRAF4抑制了这两种肿瘤细胞的糖酵解,其葡萄糖摄取和乳酸生成能力显著下调(图4)。作为糖酵解的第一个限速酶,HK2在多种肿瘤中异常高表达。而且,多种肿瘤中HK2的表达上调受到Akt激酶的调控[13]。我们前期研究已证实在结直肠癌中,TRAF4直接参与了Akt的磷酸化活化。在TRAF4基因沉默的HCT116和SW620细胞内,糖酵解下调是否与Akt的活化抑制和HK2的表达下调有关?结果表明,基因沉默TRAF4在抑制Akt活化的同时,确实导致了HK2的总蛋白表达水平下调(图4)。
作为线粒体膜组成型表达蛋白,HK2的线粒体外膜定位不仅可以提高细胞对葡萄糖的摄取效率,而且,HK2可以通过与VDAC形成复合物,共同维持线粒体的电势平衡,促进细胞的凋亡抵抗,这一结构特征也是多种肿瘤细胞内HK2过表达导致肿瘤细胞放化疗抵抗的机制之一[14-17]。通过抽提线粒体蛋白,我们进一步证实了在TRAF4基因沉默的HCT116细胞内,HK2的线粒体表达水平被下调(图5),这一结果提示,TRAF4表达抑制后,或许能提高结直肠癌细胞对化疗药物的敏感性。因此,我们采用结直肠癌最常见的化疗药物5-Fu处理细胞,并通过western blot检测TRAF4表达抑制后结直肠癌细胞内凋亡相关分子的表达情况。我们发现,5μmol/L 5-Fu在处理TRAF4基因沉默的HCT116 24 h后,即能明显促进caspase3和PARP剪切体的形成,诱导细胞发生凋亡。我们的研究从TRAF4调控Akt活化影响HK2的表达及糖酵解的角度初步证明了TRAF4对结直肠癌快速增殖这一恶性表型的影响,当然,在结直肠癌中,TRAF4是否参与了其他信号通路的调控而促进结直肠癌的发生发展还有待进一步研究。本研究为靶向TRAF4或结直肠癌细胞糖酵解的新的治疗手段的开发提供了一种潜在的可能。
[1] CHEN W,ZHENG R,ZHANG S,et al.The incidences and mortalities of major cancers in China,2009[J].Chin J Cancer,2013,32(3):106-112.
[2] NÄTHKE I.Cytoskeleton out of the cupboard:colon cancer and cytoskeletal changes induced by loss of APC[J].Nat Rev Cancer,2006,6(12):967-974.
[3] TAIEB J,TABERNEROJ,MINIE,et al.Oxaliplatin,fluorouracil,and leucovorin with or without cetuximab in patients with resected stage III colon cancer(PETACC-8):an open-label,randomised phase 3 trial[J].Lancet Oncol,2014,15(8):862-873.
[4] WILLAERT W,CEELEN W.Extent of surgery in cancer of the colon:Is more better?[J].World J Gastroenterol,2015,21(1):132-138.
[5] BIÈCHE I,TOMASETTO C,RÉGNIER C H,et al.Two distinct amplified regions at 17q11-q21 involved in human primary breast cancer[J].Cancer Research,1996,56(17):3886-3890.
[6] RÉGNIER C H,MASSON R,KEDINGER V,et al.Impaired neural tube closure,axial skeleton malformations,and tracheal ring disruption in TRAF4-deficient mice[J].Proc Natl Acad Sci U SA,2002,99(8):5585-5590.
[7] CAMILLERI-BROËT S,CREMER I,MARMEY B,et al.TRAF4 overexpression is a common characteristic of human carcinomas[J].Oncogene,2007,26(1):142-147.
[8] MARINISJM,HUTTI JE,HOMER C R,et al.IκB kinase alpha phosphorylation of TRAF4 downregulates innate immune signaling[J].Mol Cell Biol,2012,32(13):2479-2489.
[9] ESPARZA E M,ARCH RH.TRAF4 functions as an intermediate of GITR-induced NF-kappaB activation[J].Cell Mol Life Sci,2004,61(24):3087-3092.
[10] ZHANGL,ZHOU F,GARCIÁDEVINUESA A,et al.TRAF4 promotes TGF-beta receptor signaling and drives breast cancer metastasis[J].Mol Cell,2013,51(5):559-572.
[11] LI W,PENG C,LEE M H,et al.TRAF4 is a critical molecule for Akt activation in lung cancer[J].Cancer Res,2013,73(23):6938-6950.
[12] TENNANT D A,DURÁN R V,GOTTLIEB E.Targeting metabolic transformation for cancer therapy[J].Nat Rev Cancer,2010,10(4):267-277.
[13] KOPPENOL W H,BOUNDSP L,DANG C V.Otto Warburg's contributions to current concepts of cancer metabolism[J].Nat Rev Cancer,2011,11(5):325-337.
[14] KRASNOV G S,DMITRIEV A A,LAKUNINA V A,et al.Targeting VDAC-bound hexokinase II:a promising approach for concomitant anti-cancer therapy[J].Expert Opin Ther Targets,2013,17(10):1221-1233.
[15] XIAOL,HU Z Y,DONGX,et al.Targeting Epstein-Barr virus oncoprotein LMP1-mediated glycolysis sensitizes nasopharyngeal carcinoma to radiation therapy[J].Oncogene,2014,33(37):4568-4578.
[16] PASTORINO J G,SHULGA N,HOEK J B.Mitochondrial binding of hexokinase II inhibits Bax-induced cytochrome c release and apoptosis[J].JBiol Chem,2002,277(9):7610-7618.
[17] MAJEWSKIN,NOGUEIRA V,BHASKAR P,et al.Hexokinase-mitochondria interaction mediated by Akt is required to inhibit apoptosis in the presence or absence of Bax and Bak[J].Mol Cell,2004,16(5):819-830.

