光周期对蛋鸡GnRH-I,GnRH-Ra mRNA表达和卵巢发育的影响*
吕锦芳,饶开晴,姜锦鹏,倪迎冬,顾有方,宁康健,应如海,周玉刚,许百年
(1.安徽科技学院,安徽 凤阳233100;2.西南民族大学,四川 成都610041;3.南京农业大学农业部动物生理生化重点开放实验室,江苏 南京210095;4.安徽省蚌埠市畜牧兽医技术推广站,安徽 蚌埠233000)
至今的研究普遍认为,动物生殖能力的获得和维持称为性成熟,而性成熟的启动有赖于下丘脑-垂体-性腺轴的成熟。家禽的性成熟主要受基因型、营养和光照等因素的影响,并且育成鸡性成熟的速度受光照、营养等因素单独影响或协同影响而加快。早期研究已证实家鸡性成熟日龄与育成期光照长度呈负相关关系[1]。促性腺激素释放激素(GnRH)是下丘脑分泌的重要信息分子,系生殖轴的上游激素,性成熟的限速因子[2],脉冲形式分泌引起黄体生成激素(LH)和卵泡刺激素(FSH)释放作用于性腺。促性腺激素释放激素受体(GnRH-R)是介导GnRH功能必不可少的物质,主要分布于垂体,20世纪70年代后下丘脑-垂体轴外GnRH及GnRH-R也相继被发现[3]。至今有关光周期对蛋鸡生殖轴GnRH mRNA与GnRH-RmRNA的表达与卵巢发育变化的关系报道还较少,本文通过光控观察了育成蛋鸡下丘脑-垂体GnRH-I及GnRH-RamRNA表达的变化以及对卵巢发育的调控功能,为进一步探讨蛋鸡生殖轴的发育和成熟的影响因素,提高蛋鸡的生产性能提供理论依据。
1 材料与方法
1.1 试验鸡
75日龄ISA褐蛋鸡60只,随机均分成长光和短光两组,正式试验期70天(75~145日龄)。短光组(简称SL),恒定光/暗:8 h/16 h;长光组(简称LL),起始光/暗:8 h/16 h,以后每周增加0.5h,最长光/暗达到13 h/11 h,以短光组鸡群见蛋日(145日龄)结束试验。地面平养,自由采食饮水,常规免疫。记录每组试验始重,经统计学分析差异不显著。分别于105 d和136 d(长光组约10%开产)每组随机各取蛋鸡6羽称重并断颈处死,迅速无菌取出下丘脑、垂体置液氮速冻,-70℃冻存,并仔细分离卵巢称重。

表1 引物参数Tab.1 Primer parameters
1.2 主要仪器和试剂
生物分光光度计(德国eppendorf),普通PCR仪(美国BIO RAD公司),凝胶电泳成像分析系统(Kodak 1D Electrophoresis Documentation and Analysis System 120)。TRIzol总RNA提取试剂盒(北京TIANGEN),M-MLV、RNAase抑 制 剂(美 国Promega公司),Taq DNA聚合酶及PCR试剂(大连TaKaRa公司)等。
1.3 引物合成
由GenBank检索鸡的GnRH-I DNA序列,GnRHRaDNA序列,Beta-actinDNA序列,使用Primer premier 5.0软件跨内含子设计引物序列,GnRH-Ra引物序列参考[4],委托皓嘉生物技术有限公司合成,见表1。
1.4 检测指标及分析方法
测定育成蛋鸡105 d和136 d的体重、卵巢重和卵巢指数。下丘脑组织GnRH-ⅠmRNA和垂体组织GnRH-RamRNA的表达,采用RT-PCR方法,以常用管家基因β-肌动蛋白(Beta-actin)为内源性内标,对GnRH-I和GnRH-Ra的表达产物mRNA进行相对定量。
卵巢指数(mg/g)=卵巢鲜重(mg)/蛋鸡空腹活重(g)
1.5 RNA提取和反转录
利用Trizol试剂提取下丘脑及垂体组织的总RNA,生物分光光度计测定总RNA浓度和纯度(OD260/OD280=1.8~2.0)。采用甲醛凝胶变性电泳方法,检查所提取的总RNA的完整性;PCR试剂检查有无外源污染。使用随机引物对总RNA进行反转录(RT),建立样品的cDNA第一链。反应体系为25μL:MixⅠ包括RNA 2μg,随机引物1μg,10 mmol/L dNTP 2μL,DEPC水补足12μL,70℃预变性5 min,立即冰浴,继而加入反转录Mix II,包括M-MLV反转录酶100 U,RNAase抑制剂8 U,5×RT Buffer 5 μL(含 250 mmol/L Tris-HCl pH8.3,15 mmol/L MgCl2,375 mmol/L KCl,50 mmol/L DTT),DEPC水补足25μL,混匀后37℃反应60 min,95℃灭活5 min,4℃取样。并将所有样品的总RNA重复反转录,建立样品的两套cDNA。
1.6 PCR反应及产物
下丘脑目的基因GnRH-Ⅰ的PCR的优化条件:反应体系25μL,其中RT产物2μL,加入PCR混合液23μL(10 pmol/μL GnRH-I上、下游引物各0.5 μL,10 pmol/μL Beta-actin上、下游引物各0.5μL,各2.5 mmol/L dNTP 0.5μL,25 mmol/L MgCl22.0μL,5 U/μL TaqE 0.1μL,10×PCR Buffer 2.5μL,ddH2O 15.9μL)。PCR扩增条件为:94℃预变性5 min;94℃30 s,55℃30 s,72℃30 s,共28个循环;72℃延伸10 min,4℃取样。垂体目的基因GnRH-Ra的PCR的优化条件:反应体系25μL,其中RT产物2μL,加入PCR混合液23μL(10 pmol/μLGnRH-Ra上、下游引物各1μL,10 pmol/μL Beta-actin上、下游引物各0.85μL,10×PCR Buffer 2.5μL,25 mmol/L MgCl21.5μL,各2.5 mmol/L dNTP 2.0μL,5 U/μL TaqE 0.15μL,ddH2O 13.15μL)。PCR扩增条件为:94℃预变性5 min;94℃10 s,65℃20 s,74℃30 s,31个循环;74℃延伸10 min。以上目的基因的两套RT产物cDNA分别进行PCR扩增,以比较两套RT产物扩增趋势的一致性。
PCR产物加入Loading buffer 2μL混匀,取18μL在EB染色的2.0%琼脂糖凝胶上进行电泳。电泳结果的图像处理及灰度分析在Kodak 1D Electrophoresis Documentation and Analysis System 120(日本)上进行。用GnRH-I mRNA(GnRH-Ra)灰 度/Beta-actinmRNA灰度表示蛋鸡生殖轴目的基因的表达水平,并用两套灰度比的均值用于统计分析。
1.7 测序
鸡下丘脑GnRH-I(Genbank:X69491,跨内含子)设计的引物特异性已测序鉴定[5],GnRH-RaPCR产物的序列分析由大连TaKaRa公司完成。使用Blast程序将测序结果与登录的鸡垂体GnRH-Ra(Genbank:AJ304414,跨内含子)序列进行同源性比较。
1.8 数据分析
2 结果与分析
2.1 卵巢发育
由表2可见,试验至105 d,短光组的体重、卵巢重以及卵巢指数与长光组均没有差异(P>0.05)。136 d时短光组的体重低于长光组,但差异不显著(P>0.05),而卵巢重、卵巢指数极显著低于长光组(P<0.01)。
2.2 下丘脑GnRH-I mRNA的表达
105 d长光组下丘脑GnRH-I mRNA的表达丰度高于短光组,但差异不显著(P>0.05)。136 d长光组GnRH-I mRNA的表达丰度显著高于短光组(P<0.05),且极显著高于105 d长光组和短光组的表达(P<0.01)。该结果提示育成蛋鸡在开产(长光组)或开产前(短光组),下丘脑的GnRH-I mRNA表达均处于升势,且长光组开产时达到相对较高水平,见图1。
表2 育成蛋鸡卵巢发育的比较±SE)Tab.2 Comparison of ovary development in growing layers
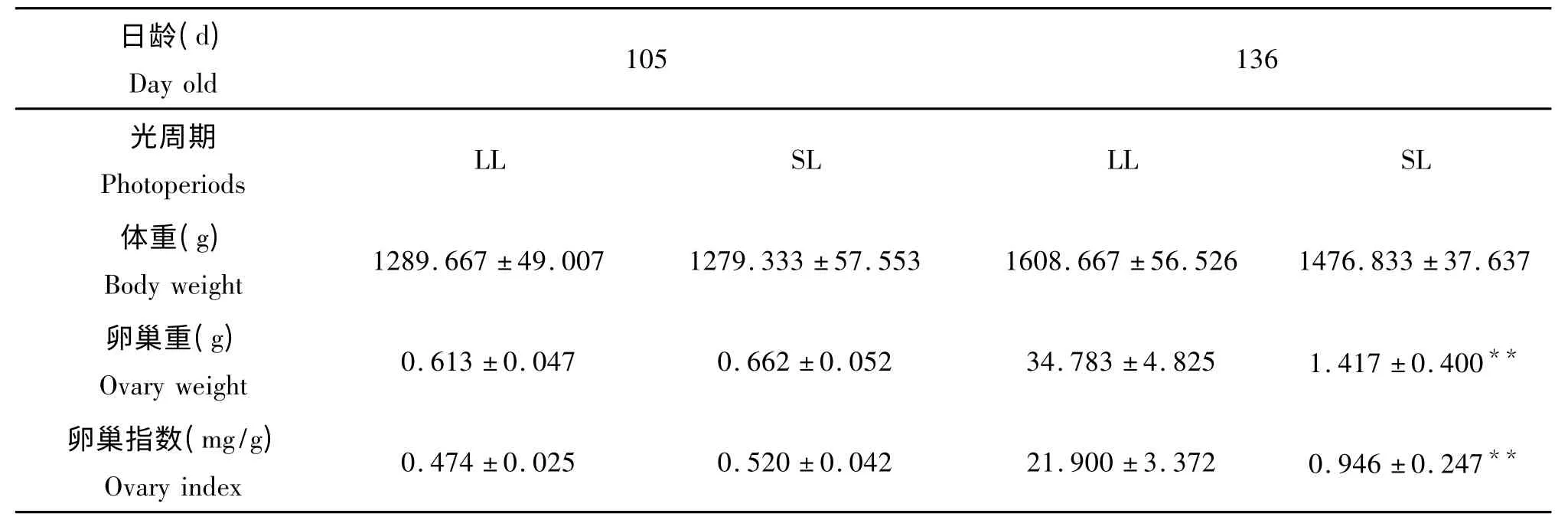
表2 育成蛋鸡卵巢发育的比较±SE)Tab.2 Comparison of ovary development in growing layers
日龄(d)Day old 105 136光周期Photoperiods LL SL LL SL体重(g)Body weight 1289.667±49.007 1279.333±57.553 1608.667±56.526 1476.833±37.637卵巢重(g)Ovary weight 0.613±0.047 0.662±0.052 34.783±4.825 1.417±0.400**卵巢指数(mg/g)Ovary index 0.474±0.025 0.520±0.042 21.900±3.372 0.946±0.247**
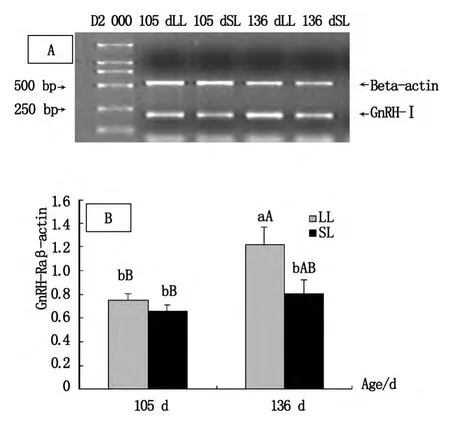
图1 下丘脑GnRH-I mRNA表达分析Fig.1 Analysis of GnRH-I mRNA expression in hypothalarmus
2.3 垂体GnRH-Ra mRNA的表达
105 d,长光组垂体GnRH-RamRNA的表达丰度与短光组没有差异(P>0.05)。136 d短光组GnRHRamRNA表达较105 d显著下降(P<0.05),长光组GnRH-RamRNA表达的丰度显著高于短光组(P<0.05),并且与105 d的长光组和短光组的表达均没有差异(P>0.05)。该结果提示长光处理,蛋鸡在开产前垂体GnRH-RamRNA的表达始终处于微弱的升势,但136 d时短光明显下调了GnRH-RamRNA的表达,见图2。
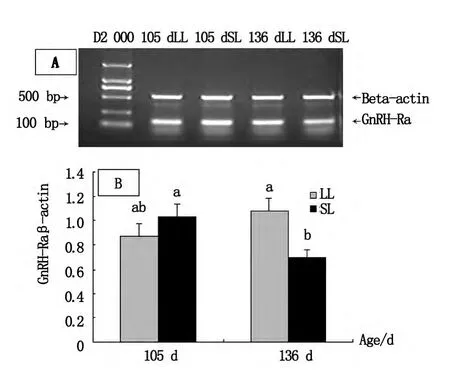
图2 垂体GnRH-Ra mRNA表达分析Fig.2 Analysis of GnRH-Ra a mRNA expression in pituitary
2.4 垂体GnRH-Ra核苷酸序列分析
蛋鸡垂体GnRH-RacDNA基因扩增片断的序列(简称Sbjct)与GenBank检索鸡的GnRH-RacDNA(AJ304414,简称Query)部分序列比对吻合率达到98%,见图3。
3 讨论
禽类GnRH均为十肽激素存在两种类型:cGn-RH-I和cGnRH-II。cGnRH-II与cGnRH-I有3个氨基酸差异。哺乳动物体内也存在两种或两种以上类型GnRH(mammalian GnRH,mGnRH),其下丘脑脉冲式分泌的mGnRH为十肽激素,与禽类的cGnRH-I仅第八位氨基酸差异。Dunn等[6]认为,cGnRH-II不可能促进鸟类促性腺激素的释放,原因包括:cGnRHII不存在于正中隆起,其胞体存在于下丘脑的动眼区域,而cGnRH-I胞体主要位于下丘脑视前区[7,8]。因此,cGnRH-I通过垂体门脉与垂体前叶促性腺细胞表面的特异性高亲和力GnRH-R结合,促进FSH、LH的合成与分泌。研究显示,小公鸡青春期启动过程中,下丘脑cGnRH-I的含量增加[9],并且6周龄小公鸡下丘脑前叶GnRH的阳性细胞数量显著多于3周龄小公鸡[10]。肉用蛋鸡产蛋启动前3周下丘脑的正中隆起GnRH-I含量明显升高,且16周龄后垂体LH和FSH含量与下丘脑正中隆起cGnRH-I水平呈正相关[11]。证实禽类在性成熟过程中下丘脑GnRH神经元经历了成熟性变化的过程,而cGnRH-II可能通过调控cGnRH-I的功能而间接影响促性腺激素的释放和功能。促性腺激素抑制激素(GnIH)通过一种新的G蛋白偶联受体(GPR147)作用于垂体和下丘脑GnRH神经元,GnIH能够减少促性腺激素的合成和释放,抑制性腺发育和维持[12]。本试验测得,105 d和136 d长光、短光组下丘脑GnRH-I mRNA的表达均处于上升趋势,且136 d长光组GnRH-I mRNA表达丰度显著高于短光组,也极显著高于105 d长光组和短光组的表达。提示开产前夕长光大幅度上调了GnRH-I mRNA表达水平,与以上肉用蛋鸡产蛋启动前3周下丘脑的正中隆起GnRH-I含量明显升高是基本一致的。

图3 垂体GnRH-Ra cDNA的同源性比对结果Fig.3 Comparison of GnRH-Ra cDNA homology in pituitary
动物的GnRH-R基因和人的基本相同,哺乳动物GnRH-R序列具有80%以上的同源性,都被归类为GnRH-I型受体。由于I型受体可以高亲和力结合GnRH-II,所以可取代GnRH-II型受体的作用,反过来就不行,因为GnRH-II型受体对GnRH-II具有高度选择性,但鸟类的繁殖状况与垂体GnRH-II全长的mRNA水平相关,而它的剪接变异体mRNA的表达在大多数脑组织检测到[13]。研究表明,除动物的垂体存在GnRH-RmRNA表达外,在鸡的下丘脑[4]、大鼠的卵巢[14],以及人的非生殖器官等也存在Gn-RH-RmRNA的表达[3]。GnRH结合GnRH-R,引起受体构象的改变,向细胞内转导信号,但持续给予GnRH或GnRH类似物,可造成垂体GnRH-R的下调和脱敏,导致垂体-性腺轴功能抑制[15]。然而调节卵巢发育的内分泌机制较为复杂,研究显示小卵泡颗粒细胞中瘦素(LEP)的表达远高于大卵泡,而大卵泡分离的颗粒细胞中瘦素受体(LEP-Rb)的表达高于小卵泡的颗粒细胞,提示卵巢瘦素信号系统的存在对卵泡发育和卵母细胞成熟发挥潜在的调节作用[16]。同样生长激素受体(GH-R)等也广泛地分布在大部分鸡的生殖系统,调节生殖组织的生长发育和功能的变化[17],从而影响卵巢的发育。试验测得,长光组在开产前四周垂体的GnRH-RamRNA表达仍然处于微弱的升势,这与下丘脑GnRH-I mRNA的表达上调并保持升势是完全一致的,但短光组开产前40天垂体GnRH-RamRNA的表达已进入下调通道,136 d其GnRH-RamRNA的表达丰度显著低于长光组,提示短光下调了开产前蛋鸡垂GnRH-RamRNA的表达。105 d光处理蛋鸡的体重、卵巢重以及卵巢指数均没有差异,136 d时长光组的卵巢重、卵巢指数极显著高于短光组。卵巢发育的差异同时伴随出现见蛋日的差异(LL131 d/SL145 d)。综上所述,长光明显上调开产前蛋鸡下丘脑GnRH-I mRNA的表达,其GnRH-RamRNA的表达也保持较高的水平促进卵巢的发育,而短光则明显下调垂体GnRHRamRNA的表达,这也可能是其卵巢发育延缓的主要原因之一。
[1] LEWIS P D,MORRIS T R,PERRY G C.A model for the effects of constant photoperiods on the rate of sexual maturation in pullets[J].Br Poult Sci,1998,39(1):147-151.
[2] URBANSKI H F,OJEDA S R.Activation of luteinizing hormone-releasing hormone release advances the onset of female puberty[J].Neuroendocrinology,1987,46(3):273-276.
[3] EMONS G,GRÜNDKER C,GÜNTHERT A R,et al.GnRH antagonists in the treatment of gynecological and breast cancers[J].Endocr Relat Cancer,2003,10(2):291-299.
[4] SUN Y M,DUNN I C,BAINESE,et al.Distribution and regulation by oestrogen of fully processed and variant transcripts of gonadotropin releasinghormone I and gonadotropin releasing hormone receptor mRNAs in the male chicken[J].J Neuroendocrinol,2001,13(1):37-49.
[5] 吕锦芳,倪迎冬,宁康健,等.不同光周期下ISA褐蛋鸡松果腺GnRH-I mRNA表达的变化[J].中国兽医学报,2009,29(3):334-338.LV Jinfang,NI Yingdong,NING Kangjian,et al.Change ofGnRH-I mRNA expression in pineal gland for ISA Brown layers at different photoperiods[J].Chin J Vet Sci,2009,29(3):334-338.
[6] DUNN I C,CHEN Y,HOOK C,et al.Characterization of the chicken preprogonadotropin-releasing hormone-I gene[J].J Mol Endocrinol,1993,11(1):19-29.
[7] SHARP P J,TALBOT R T,MAIN G M,et al.Physiological roles of chicken LHRH-I and-II in the control of gonadotropin release in the domestic chicken[J].JEndocrinol,1990,124(2):291-299.
[8] KUENZEL WJ,BLÄHSER S.The distribution of gonadotropinreleasing hormone(GnRH)neurons and fibers throughout the chick brain(Gallus domesticus)[J].Cell Tissue Res,1991,264(3):481-495.
[9] DUNNIC,SHARPPJ.Photo-induction of hypothalamic Gonadotropin Releasing Hormone-I mRNA in the domestic chicken:a role for oestrogen?[J].J Neuroendocrinol,1999,11(5):371-375.
[10] WALSH K M,KUENZEL WJ.Effect of sulfamethazine on sexual precocity and neuropeptide Y neurons within the tuberoinfundibular region of the chick brain[J].Brain Res Bull,1997,44(6):707-713.
[11] BRUGGEMAN V,D'HONDT E,BERGHMAN L,et al.The effect of food intake from 2 to 24 weeks of age on LHRH-1 content in the median eminence and gonadotrophin levels in pituitary and plasma in female broiler breeder chickens[J].Gen Comp Endocrinol,1998,112(2):200-209.
[12] TSUTSUI K,UBUKA T,BENTLEY G E,et al.Gonadotropininhibitory hormone(GnIH):discovery,progress and prospect[J].Gen Comp Endocrinol,2012,177(3):305-314.
[13] SHIMIZU M,BÉDÉCARRATS G Y.Identification of a novel pituitary-specific chicken Gonadotropin-releasing hormone receptor and its splice variants[J].Biol Reprod,2006,75(5):800-808.
[14] KOGO H,FUJIMOTO T,PARK M K,et al.Gonadotropin-releasing hormone receptor mRNA expression in the ovaries of neonatal and adult rats[J].Cells Tissues Organs,1999,164(1):14-22.
[15] GRUNDKER C,GUNTHERT A R,WESTPHALEN S,et al.Biology of the gonadotropin-releasing hormone system in gynecological cancers[J].Eur JEndocrinol,2002,146(1):1-14.
[16] BATISTA A M,SILVA D M,RÊGO M J,et al.The expression and localization of leptin and its receptor in goat ovarian follicles[J].Anim Reprod Sci,2013,141(3-4):142-147.
[17] LUNA M,MARTINEZ-MORENO C G,AHUMADASOLÓRZANO M S,et al.Extrapituitary growth hormone in the chicken reproductive system[J].Gen Comp Endocrinol,2014,203:60-68.

