新疆地区少数民族留置双J管患者尿路感染的细菌学研究*
黄俊兰,李九智,文 彬,△
(1.安徽医科大学新疆临床学院,乌鲁木齐830001;2.新疆维吾尔自治区人民医院泌尿一科,乌鲁木齐830001)
我国新疆是一个多民族聚集区,当地经济卫生条件落后, 是尿路感染高发人群。目前,尚无对新疆地区少数民族患者留置双J管导致的尿路感染相关方面的研究。为进一步了解新疆地区少数民族患者留置双J管后尿路感染的病原学特点,本研究对新疆维吾尔自治区人民医院2012年1月至2014年12月980例留置双J管的少数民族患者的双J管及尿液进行了细菌学研究,旨在进一步了解新疆地区少数民族患者留置双J管后导致尿路感染的细菌分布及药敏特点,为临床治疗提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料 收集2012年1月至2014年12月在新疆维吾尔自治区人民医院留置双J管患者980例,其中男569例,女411例。将所有患者根据年龄进行分组:≤20岁组患者190例,>20~40岁组患者181例,>40~60岁组患者234例,>60~80岁组患者375例。维吾尔族685例,哈萨克族112例,回族56例,其他民族127例。双J管留置时间7d至3个月。
1.2 方法
1.2.1 标本采集与细菌培养 撤除双J管前留取中段晨尿3 mL于无菌接种瓶中,使用抗菌药物者停用3d后留取。患者撤除双J管后,采用无菌操作原则将双J管剪断,反复使用无菌生理盐水冲洗后置于留有30mL无菌生理盐水的接种瓶中,漩涡震荡器洗脱1min。将尿液及双J管洗脱液离心沉淀,取沉淀物分别接种于血琼脂平板培养基和麦康凯琼脂培养基,置于37℃恒温孵育箱16~24h后,观察有无菌落生成,应用全自动细菌仪,得出细菌种类。
1.2.2 生物被膜细菌筛选 根据尿路感染诊断最新标准,确定尿路感染患者,将培养菌株提纯后分别接种于刚果红平板培养基,置于37℃恒温孵育箱培养48h后观察结果。菌落着色变为黑色且有干燥结晶,则为生物被膜阳性菌,菌落不变色为普通浮游菌。
1.2.3 药敏试验 根据美国临床实验室标准化协会(CLSI)推荐的纸片扩散法(KB)对培养细菌药物敏感性进行检测,操作结果和结果判断按照CLSI 2013版标准,质控标准菌株为大肠埃希菌ATCC25922、大肠埃希菌ATCC35218、金黄色葡萄球菌ATCC25923、铜绿假单胞菌ATCC27853。
1.3 统计学处理 采用SPSS13.0软件对数据进行处理分析,计数资料以率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同年龄段留置双J管患者的感染情况 各组双J管及尿液细菌培养结果显示,≤20岁组(29.11%、31.35%)及大于60~80岁组(36.7%、35.14%)留置双J管患者中细菌培养阳性率远高于大于20~40岁组(12.66%、14.05%)患者,但与大于40~60岁组(21.52%、19.46%)比较差异无统计学意义。
2.2 感染率及病原菌分布构成 共收集双J管及尿液标本各980例,双J管细菌培养阳性237例(24.2%),中段尿培养阳性185例(18.9%)。对阳性标本进行菌株分离,共得到病原菌434株,其中来自双J管245株(56.5%),尿液 189株(43.5%)。所有菌株中革兰阴性菌254株(58.5%),革兰阳性菌179株(41.5%),真菌1株(0.2%)。对各菌株进行生物被膜菌鉴定后总共得到239株(55.1)生物被膜菌株,其中来自双J管174株(72.8%),尿液65株(27.2%),生物被膜阳性菌在双J管和尿液组分布差异有统计学意义(P<0.05)。生物被膜菌中革兰阴性菌167株(69.9%),革兰阳性菌72株(30.1%),见表1。
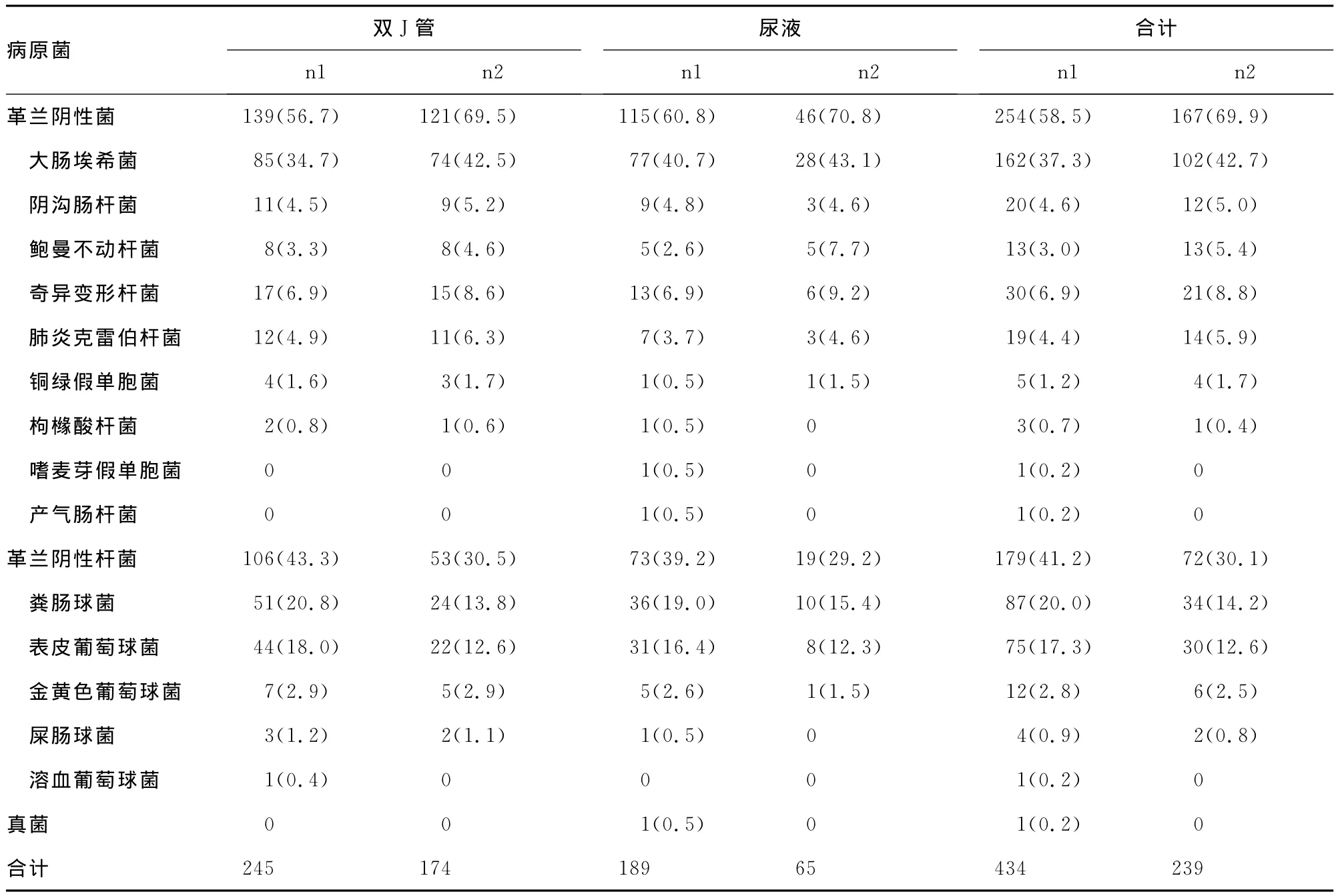
表1 病原菌分布及构成比[n(%)]

表3 不同来源的革兰阴性菌耐药情况[n(%)]
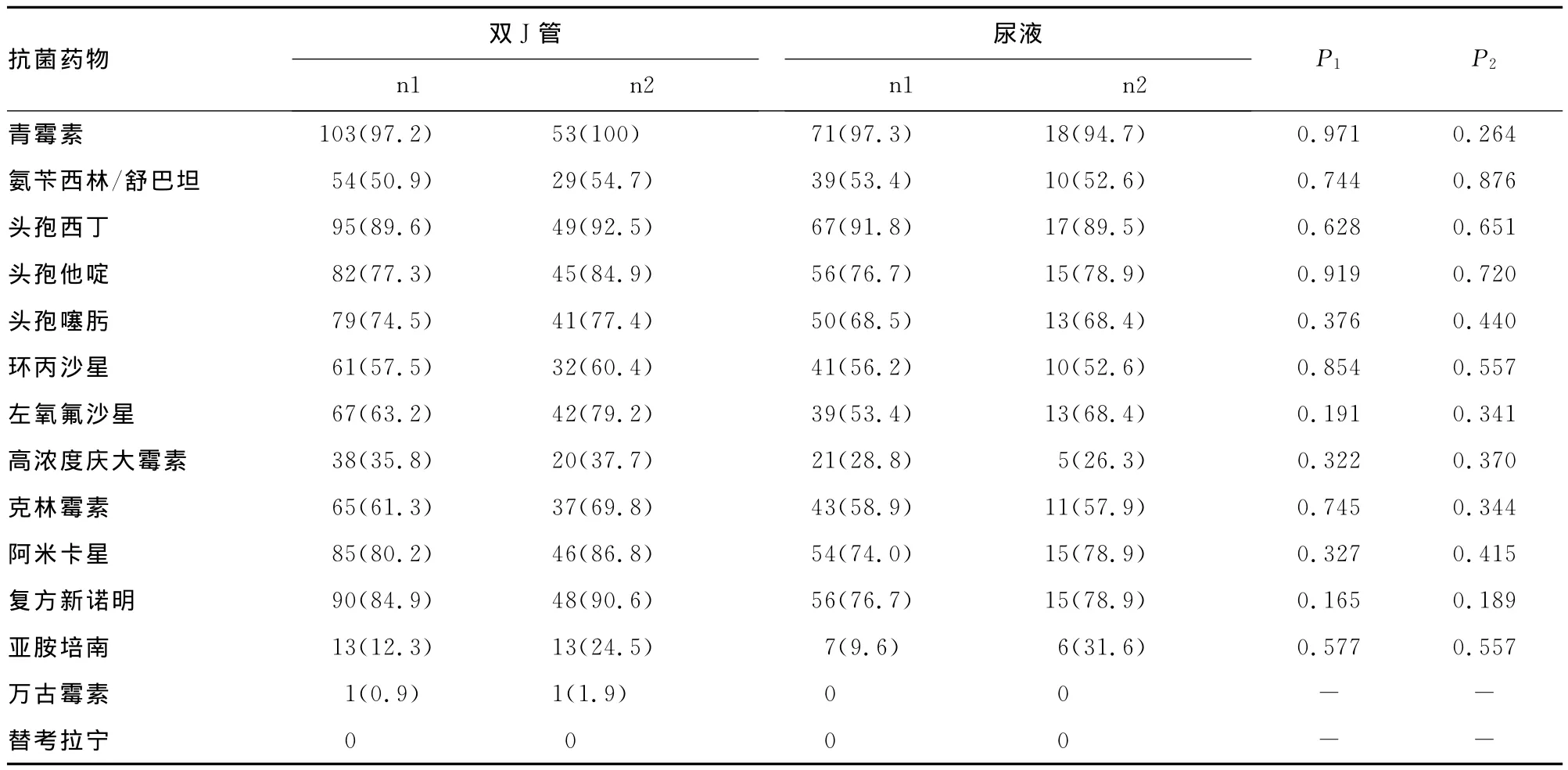
表3 不同来源的革兰阳性菌耐药情况[n(%)]
2.3 药敏试验结果 常见的革兰阴性菌及阳性菌对临床常用抗菌药物的耐药率见表3、4。对比发现,双J管来源的菌株耐药性普遍高于尿液来源,对两组数据进行逐一对比分析,差异无统计学意义(P>0.05)。尿培养培养结果显示在非生物被膜菌中革兰阴性菌对半合成青霉素类如氨苄西林耐药率达79.1%,二代三代头孢菌素如头孢呋辛、头孢他啶耐药率分别为50.4%及62.6%,喹诺酮类抗菌药物如左氧氟沙星耐药率是41.7%,但对加入β-内酰胺酶抑制剂的抗菌药物如头孢哌酮舒巴坦的耐药率为2.6%,氨基糖苷类抗菌药物阿米卡星耐药率有39.1%,碳青霉烯类抗菌药物对革兰阴性菌极为敏感,如美罗培南仅为0。尿培养培养结果显示非生物被膜菌中革兰阳性菌对常用抗菌药物耐药情况严重,部分细菌对碳青霉烯类抗菌药物亚胺培南存在一定的耐药性,耐药率高达9.6%,目前尚未培养出对万古霉素和替考拉宁耐药菌株。
3 讨 论
双J管即输尿管支架管,1978年Finney首次应用于临床,其置入输尿管后具有引流尿液、防止输尿管狭窄和粘连堵塞等重要作用,目前被广泛应用于泌尿外科手术中。然而双J管作为一种医用植入物并较长时间留置在体内,使得尿路感染风险增加,进而加重临床不适症状,给患者带来巨大痛苦[1]。而在新疆少数民族聚集区,医疗卫生条件落后,少数民族群众文化教育水平普遍低下,未经咨询滥用抗菌药物情况极为普遍,本组研究发现当地留置双J管的少数民族患者尿路感染率高达20%以上,这不仅给当地少数民族患者增加了原发疾病的治疗难度,而且带来沉重的经济负担和巨大的身心痛苦。
本组研究在双J管和尿液中共检出病原菌434株,主要为革兰阴性菌(58.5%,254/434),以大肠埃希菌(37.3%,162/434)最多见,变形杆菌、肺炎克雷伯杆菌、阴沟肠杆菌及假单胞菌次之,并占有重要地位,异于国内其他地区监测结果[2-3,5];革兰阳性菌(41.5%,179/434)比例较中国其他地区高[4],以肠球菌属和葡萄球菌属为主,在肠球菌属中,以粪肠球菌多见,而葡萄球菌属中以表皮葡萄球菌为主,这与近年来国内其他地区研究机构报道[5]大致相同。尿液培养检出真菌1株,所占比例极低,与既往国内报道[2,5-6]相符,但与国外报道[7]有一定差异。
有研究表明,双J管在体内留置较长时间后会在其表面形成一层细菌生物薄膜(BF),它能增强细菌的耐药性,其主要作用机理是细菌在附着物表面形成一层特殊被膜,可逃逸机体免疫及抗菌药物杀伤作用,进而导致感染反复发作及迁延不愈,故对留置双J管后导致尿路感染的患者进行生物被膜菌检测尤为重要[8]。本研究对双J管及尿液分离出的菌株进行生物被膜菌鉴定,分别得到生物被膜菌174株和65株,其阳性检出率差异有统计学意义(P<0.05),由此可见,双J管表面更易导致细菌形成生物被膜。此外,本组研究发现,在双J管与尿液中生物被膜菌株分布差异无统计学意义(P>0.05),二者均以革兰阴性菌为主,以大肠埃希菌常见;革兰阳性菌以肠球菌属和葡萄球菌属居多,其菌株分布跟总体菌株分布构成情况相近。
除此之外,本研究根据菌株来源将生物被膜菌株分为两组,并对两组生物被膜菌株的耐药性进行比较发现两组菌株耐药性,差异无统计学意义(P>0.05)。但是被膜菌株在形态结构、生理生化特性、致病性以及对环境的敏感性等都与浮游细菌有显著的不同,尤其对抗菌药物和宿主免疫系统具有很强的抵抗力,从而导致许多慢性和难治性感染疾病的反复发作[10-12]。有文献报道,在不同的培养基上生长的生物被膜菌株耐药性具有明显差异,但是其产生不同耐药性的机制尚需进一步研究[13]。
在新疆少数民族聚集区,广谱抗菌药物使用极不合理,多数患者仅依据经验选择抗菌药物,无尿细菌培养及药敏试验,由此导致少数民族群体病原菌耐药率逐年增加,并以低龄及高龄尿路感染患者多见;而新疆汉族人群通常居住在医疗卫生条件较完善地区,加之文化教育水平程度较高,对抗菌药物的使用尤为重视,能较及时的咨询病情及合理使用抗菌药物。在临床工作中,尿路感染多见于老年及低龄患者,中青年患者少见,同时相关细菌培养结果显示细菌耐药率与内地情况大致相同,并无较大差异。在本组研究中,革兰阴性菌对半合成青霉素类、二代三代头孢菌素及喹诺酮类抗菌药物的耐药率较高,但对加入β-内酰胺酶抑制剂的抗菌药物敏感性较高,与国内其他地区报道[2]相近,而碳青霉烯类抗菌药物对本地区革兰阴性菌具有高度敏感性。显然,针对新疆地区少数民族尿路感染患者群体,半合成青霉素类、二三代头孢菌素以及喹诺酮药物已不再适合作为尿路感染的首选经验用药,应引起高度重视。本研究发现革兰阳性菌耐药情况在新疆少数民族尿路感染群体中尤为严重,对常用的半合成青霉素类、2代3代头孢菌素及喹诺酮类抗菌药物具有较强的耐药率,但对万古霉素、替考拉宁及亚胺培南敏感性较高,这种情况可能与革兰阳性菌自身具有极强的天然耐药性有关,同时,革兰阳性菌耐药机制异常复杂,不合理使用抗菌药物也会进一步促使其耐药性发生改变[9]。
针对新疆地区少数民族置双J管后尿路感染患者的细菌分布及药敏试验特点,临床医师治疗此类患者时应合理使用敏感抗菌药物,及时根据细菌培养和药敏试验结果调整用药方案,同时应对少数民族患者进行适当的健康宣教,避免院外滥用抗菌药物。
[1]Ho CH,Tai HC,Chang HC,et al.Predictive factors for ureteral double-J-stent-related symptoms:aprospective,multivariate analysis[J].J Formos Med Assoc,2010,109(11):848-856.
[2]王昊泉,陈轼,陈松.尿路感染病原菌分布与耐药性监测[J].中华医院感染学杂志,2015,25(1):68-69,72.
[3]韦泽光,姜月霞,吴慧君.2011年医院感染病原体分布与耐药性分析[J].中华医院感染学杂志,2015,25(2):305-307.
[4]张士勇,叶云,韩一萱,等.2011-2013年某院革兰阳性菌耐药率与抗菌药物应用相关分析[J].中国医院药学杂志,2014,34(24):2154-2157.
[5]张传领,韩立中,倪语星,等.泌尿系统感染病原菌分布及耐药性分析[J].中华医院感染学杂志,2009,19(11):1447-1449.
[6]刘丽,吴皖,陈丹,等.导尿管相关性尿路感染的病原菌分布及耐药性[J].中华医院感染学杂志,2012,22(7):1347-1348.
[7]Rosenthal VD,Todi SK,lvarez-Moreno C,et al.Impact of a multidimensional infection control strategy on catheterassociated urinary tract infection rates in the adult intensive care units of 15developing countries:findings of the International Nosocomial Infection Control Consortium(INICC)[J].Infection,2012,40(5):517-526.
[8]Lonn-Stensrud J,Landin MA,Benneche T,et al.Furanones,potential agents for preventing Staphylococcus epidermidis biofilm infections[J].J Antimicrob Chemother,2009,63(2):309-316.
[9]胡静仪.常见革兰阳性菌的耐药机制研究进展[J].临床合理用药杂志,2009,2(24):117-119.
[10]Amer LS,Bishop BM,Van Hoek ML.Antimicrobial and antibiofilm activity of cathelicidins and short,synthetic peptides against Francisella[J].Biochem Biophys Res Commun,2010,396(2):246-251.
[11]Zijnge V,Van Leeuwen MB,Degener JE,et al.Oral biofilm architecture on natural teeth[J].PLoS One,2010,5(2):e9321.
[12]Wu RP,Xi HJ,Qi K,et al.Correlation between the growth of bacterial biofilm in flexible endoscopes and endoscope reprocessing methods[J].Am J Infect Control,2014,42(11):1203-1206.
[13]董妍.双J管生物被膜菌相关感染特点及耐药性分析[J].检验医学与临床,2012,9(7):783-785.

