降钙素原、内毒素检测及G试验在ICU恶性肿瘤患者感染监测中的临床应用
郭 凡,吴会丽,黄艳春,刘诚明,徐 怡
(新疆医科大学附属肿瘤医院检验科,乌鲁木齐830011)
尽管现代ICU为危重患者提供了特殊的生命支持,但ICU恶性肿瘤患者由于病情严重和长期反复接受化疗、放疗、广谱抗生素及免疫抑制剂等治疗,免疫力明显降低,出现感染的概率大大增加。目前,感染菌株中较为常见的是革兰阴性菌感染和侵袭性真菌感染(invasive fungal infections,IFI)。降钙素原(procalcitonin,PCT)是一个具有潜在价值的感染诊断指标,在细菌或真菌感染时,PCT选择性诱导升高,并与疾病的严重程度呈正相关,在病毒感染、肿瘤疾病及手术创伤时则保持低水平[1];内毒素(endotoxin,ET)是革兰阴性菌的细胞壁成分之一,在细菌死亡溶解后释放入血引起的ET血症及脓毒血症,因而可用于监测细菌感染;G试验通过定量检测患者血浆中(1-3)-β-D葡聚糖的水平,是检测真菌感染的辅助指标。因此,本研究通过对ICU的恶性肿瘤患者血清中PCT、ET、G试验血浆中(1-3)-β-D葡聚糖的定量检测,并与患者同期临床体液标本的真菌、细菌、血培养的结果进行比较分析,从而探讨OCT、ET检测及G试验在ICU恶性肿瘤患者感染监测中的临床意义。
1 资料与方法
1.1 一般资料 收集2012年10月至2013年3月,入住本院ICU的112例恶性肿瘤患者作为感染组研究对象,其中男49例,女63例,年龄32~78岁,平均(55.6±12.1)岁。其中非小细胞肺癌27例,食管癌16例,胃癌18例,肠癌13例,肝癌10例,乳腺癌9例,胰腺癌8例,卵巢癌6例,淋巴瘤5例。感染的诊断标准参照卫生部颁布的医院感染诊断标准。对照组46例,为同期入住ICU的恶性肿瘤患者,该组患者均无临床及实验室感染证据,其中男26例,女20例,年龄31~70岁,平均年龄(57.6±14.1)岁,非小细胞肺癌12例,食管癌8例,乳腺癌6例,胃癌5例,肠癌5例,胰腺癌4例,卵巢癌3例,肝癌2例,淋巴瘤1例。排除标准:(1)ICU住院时间小于24h;(2)诊断为甲状腺髓样细胞癌、小细胞肺癌的患者。根据感染组研究对象的微生物培养结果分为细菌感染组(86例)和真菌感染组(55例)。在细菌感染组中,将体液、分泌物细菌培养结果为阳性的分为局部感染组(63例),血培养阳性分为全身感染组(22例),在真菌感染组中,根据真菌培养部位结果分为深部真菌感染组(23例)即血培养真菌阳性和浅部真菌感染组(33例)即体液、分泌物真菌培养阳性。
1.2 方法
1.2.1 标本收集 入选患者在进入ICU后,存在感染的恶性肿瘤患者按无菌要求在拟诊感染的第1天,均使用经特殊处理的无热原抗凝管和促凝管采集静脉血标本,各3 000r/min离心1min、3 000r/min离心5min,取富含血小板血浆进行G试验和ET检测,取促凝血清进行PCT检测。同时抽取患者的血液进行血培养和采集易感部位相关的体液、分泌物标本进行真菌培养、细菌培养。
1.2.2 实验仪器 采用 Roche cobas e 411 全自动电化学发光免疫分析仪;Goldstream MB-80微生物快速动态检测系统,T01智能恒温仪;法国生物梅里埃全自动细菌鉴定仪(VITEK-2Compact);法国生物梅里埃全自动血培养仪(Bact/Alert3D120)。
1.2.3 实验试剂 采用Roche PCT进口原装试剂盒;北京金山川科技发展有限公司的 Goldstream GKT-1MSet真菌(1-3)-β-D葡聚糖检测试剂盒、EKT-1MSet革兰阴性菌脂多糖检测试剂盒;法国生物梅里埃公司生产的细菌鉴定卡和血培养瓶。
1.2.4 检测方法 根据Roche PCT进口原装试剂盒说明书的要求进行PCT的测定;根据北京金山川科技发展有限公司提供的革兰阴性菌脂多糖、真菌(1-3)-β-D葡聚糖检测试剂盒检测试剂盒说明书的要求进行内毒素和血浆(1-3)-β-D葡聚糖的测定。(1)正常参考值为PCT<0.1ng/mL。因本研究对象为ICU恶性肿瘤患者,按文献报道本文研究以大于或等于0.5 ng/mL为PCT阳性[2]。(2)ET的参考值:ET≤10pg/mL,为阴性;ET>10pg/mL,为阳性。(3)G试验的参考值:G试验定量小于或等于60pg/mL,为阴性;G试验定量大于60pg/mL,为阳性。
1.3 统计学处理 采用SPSS18.0统计软件进行分析,计量资料用±s表示,组间比较采用t检验,多组间比较采用方差分析;计数资料百分比表示,组间比较采用χ2检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 细菌感染组中PCT和ET的测定结果 细菌培养阳性标本为86例,其中血培养阳性标本23例,分离鉴定包括:大肠埃希菌3株、肺炎克雷伯7株、铜绿假单鲍菌4株、鲍曼不动杆菌4株、产酸克雷伯菌1株、洋葱假单胞菌2株、艾格森埃希菌2株。体液、分泌物细菌培养标本阳性63例,感染部位包括呼吸道、泌尿道和静脉插管感染,分离鉴定革兰阴性菌53株,包括:大肠埃希菌7株、肺炎克雷伯菌15株、阴沟肠杆菌4株、铜绿假单鲍菌8株、鲍曼不动杆菌6株、奇异变形杆菌2株、嗜麦芽窄食单胞菌6株、产酸克雷伯菌2株、洋葱假单胞菌2株、木糖氧化产碱杆菌1株;革兰阳性菌10株,包括:金黄色葡萄球菌4株、屎肠球菌2株、粪肠球菌、草绿色链球菌、溶血葡萄球菌、表皮葡萄球菌各1株。
细菌感染组与对照组的PCT、ET结果见表1。其中,3组的PCT、ET检测值差异均有统计学意义(F=31.661,P<0.01;F=69.066,P<0.01)。全身感染组、局部感染组与对照组相比,PCT、ET检测值明显升高,差异有统计学意义(P<0.01);全身感染组与局部感染组相比,PCT、ET检测值明显升高,差异有统计学意义(P<0.01)。
2.2 真菌感染组中PCT和G试验的测定结果 真菌培养阳性标本为55例,其中血培养真菌阳性22例,分离鉴定包括:白色念珠菌11株、光滑念珠菌4株、热带念珠菌3株、克柔念珠菌4株;体液、分泌物真菌培养阳性33例,感染部位包括呼吸道、泌尿道和静脉插管感染,分离鉴定包括:白色念珠菌20株、光滑念珠菌3株、热带念珠菌3株、克柔念珠菌4株、曲霉菌2株、毛霉菌1株。
真菌感染组与对照组的PCT、G试验结果见表2。其中,3组的PCT、G试验检测值差异均有统计学意义(F=9.008,P<0.01;F=83.245,P<0.01)。浅部感染组、深部感染组与对照组相比,PCT、G试验检测值明显升高,差异有统计学意义(P<0.01);与浅部感染组相比,深部感染组的G试验检测值明显升高,差异有统计学意义(P<0.01),但深部感染组与浅部感染组的PCT值差异无统计学意义(P>0.05)。

表1 细菌感染组与对照组的PCT、ET检测结果比较
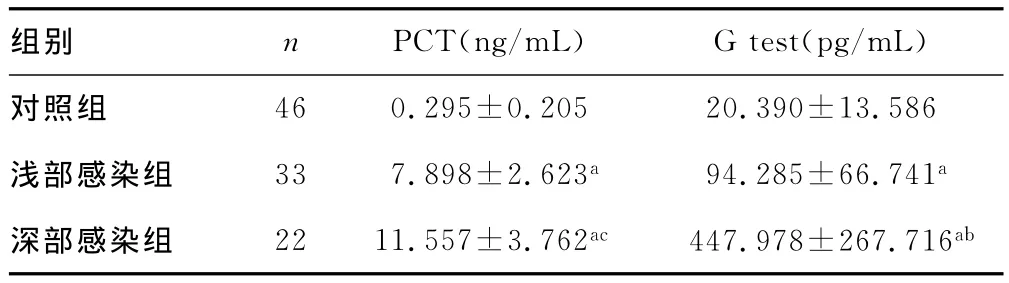
表2 真菌感染组与对照组的PCT、G试验检测结果比较
2.3 细菌感染组PCT/ET单独检测与联合检测结果的比较 PCT以0.5ng/mL为诊断界值,ET以10pg/mL为诊断界值,PCT、ET试验及其联合检测(平行试验)的灵敏度(Sen)、特异度(Spe)、阳性预测值(PPV)、阴性预测值(NPV)、诊断指数(DI)的比较见表3。
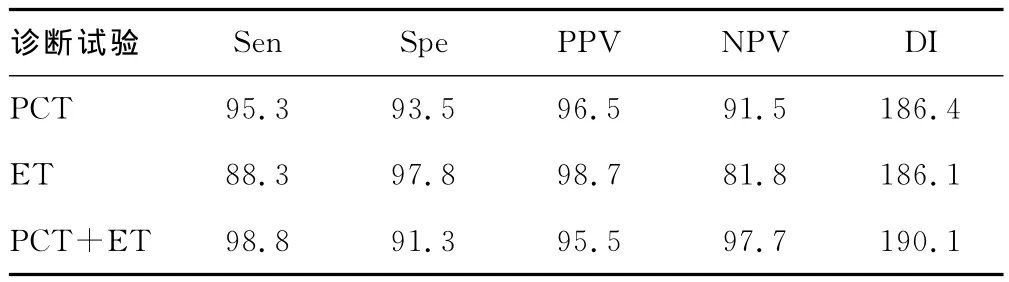
表3 PCT/ET单独检测与联合检测细菌感染的结果比较(%)
2.4 真菌感染组PCT/G试验单独检测与联合检测结果的比较 PCT以0.5ng/mL为诊断界值,G试验以60pg/mL为诊断界值;PCT、G试验及其联合检测(平行试验)的Sen、Spe、PPV、NPV、DI的比较见表4。
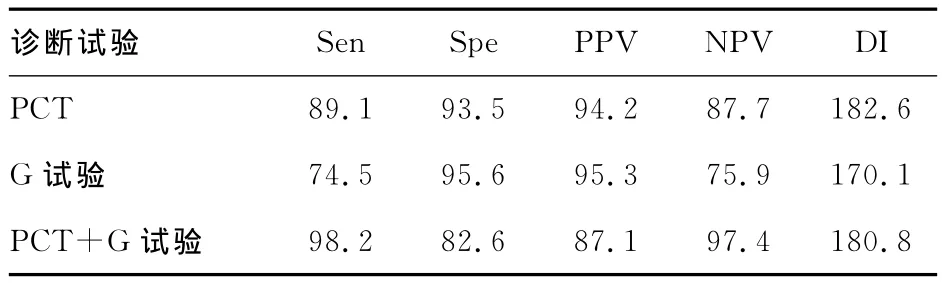
表4 PCT/G试验单独检测与联合检测真菌感染的结果比较(%)
3 讨 论
ICU恶性肿瘤患者的感染诊断和监测一直是肿瘤专科医院ICU的工作核心。目前,感染诱发的脓毒性休克和多器官功能障碍综合征(MODS)已对恶性肿瘤患者的生命预后构成了严重的威胁。WHO统计的官方数据显示:感染引起人类死亡的概率约占每年总死亡率的25.5%[3]。在感染的诊断和治疗中,临床工作者需对感染菌株进行快速诊断,以便对患者用药治疗,缩短患者的住院时间,减少住院费用。因此,临床工作者迫切需要“理想”的生物联合标志物能很好地帮助评估感染的严重程度和预后,而PCT、ET、G试验检测时间短(1h),联合检测对细菌感染和真菌感染的监测有很大的帮助。
PCT是降钙素(CT)的前体[4],由 PCT 前体裂解生成[5]。当严重细菌、真菌、寄生虫感染及脓毒症和多脏器功能衰竭时,PCT在血浆中的水平显著升高[6]。有研究认为其水平升高可能与神经内分泌细胞以外的其他细胞大量分泌有关[7]。近期的研究表明PCT检测对重症感染性疾病患者早期的诊断和治疗有更重要的临床意义[8]。Charles等[9]的研究显示,PCT可以准确鉴别细菌菌血症和真菌菌血症,低的PCT值(0.96ng/mL)是诊断真菌菌血症的独立预测因素,本研究因感染组中有29例细菌和真菌混合感染,所以还有待进一步发现细菌感染和真菌感染的PCT值差异。
有研究表明,细菌ET是诱导生成PCT的刺激因子[10]。本研究在诊断细菌感染中,PCT和ET比较,PCT灵敏度较高,而ET主要针对革兰阴性菌感染,在革兰阴性菌感染的诊断中具有较高的特异度,因此PCT+ET联合检测进一步提高了细菌感染,特别是革兰阴性菌感染检测的灵敏度,且NPV和DI明显升高。因此在恶性肿瘤患者感染的监测中联合PCT、ET检测可以减少误诊或漏诊的产生。同时PCT和ET的检测也存在一定的假阴性和假阳性,如当大面积外伤早期、外科手术时血清PCT检测会出现假阳性结果,所以需要紧密结合临床充分发挥其自身优势。
G试验可直接检测真菌细胞壁上(1-3)-β-D葡聚糖水平,而(1-3)-β-D葡聚糖是酵母菌和丝状真菌细胞壁的特有成分,占真菌细胞壁成分的50%以上,在原核生物、病毒和人体细胞中不存在,是具有较高特异性的真菌抗原[11]。De Pauw等[12]认为,在恶性肿瘤患者的血液及无菌体液中检测出(1-3)-β-D葡聚糖就可认为这是真菌感染的征兆。当真菌入血后,G试验呈阳性,其检测水平与真菌的水平有相关性[13]。因此,血液及无菌体液中G试验阳性在很大程度上可以视为侵袭性真菌感染(IFI)的标志,如念珠菌、曲霉、酵母菌感染等。而接合菌(毛霉)、隐球菌属的感染由于其细胞壁不能释放这种多聚糖往往G试验的结果为阴性[14]。本次研究真菌感染组55例中,有1例毛霉菌株,其G试验的结果为阴性但PCT的检测值为阳性。本研究PCT、G试验比较,G试验特异度较高,PCT则灵敏度更高,而PCT+G试验联合检测进一步提高了侵袭性真菌感染检测的灵敏度。因此,血浆(1-3)-β-D葡聚糖检测(G试验)对侵袭性真菌感染的早期诊断具有重要的参考价值[15],两者联合检测也有助于诊断并早期经验性使用抗真菌药物的治疗。
[1]Andrejaitiene J,Sirvinskas E,Zebrauskiene I.Procalcito-nin:a new infection marker.Its use in intensive care[J].Medince,2002,38(5):491-498.
[2]Casado FJ,Blanco QA.Procalcitonin,a new marker for bacterial infection[J].A Esp Pcdiatr,2001,54(1):69-73.
[3]陆一鸣.降钙素原PCT感染诊治新技术[J].国际检验医学志,2013,34(20):2641-2642.
[4]梁明.降钙素原定量检测在临床中的意义[J].内蒙古中医药,2012,31(2):131-132.
[5]代江波.降钙素原在危重症患者呼吸机相关性肺炎早期诊断中的价值[J].重庆医学,2012,41(15):1511-1512.
[6]Schuetz P,Albrich WC,Mueller B.Procalcitonin for diagnosis of infection and guide to antibiotic decisions:past,present and future[J].BMC Med,2011,22(9):107.
[7]熊明洁,范红,郭靓.80例脓毒血症患者血清降钙素原监测和预后评估的临床研究[J].重庆医学,2011,40(30):3076-3078.
[8]朱景丽,郑宏图,黄玉平.血清降钙素原(PCT)及C-反应蛋白(CRP)血液中白细胞(WBC)测定对感染性疾病诊治的临床意义[J].医药与保健,2014,22(9):46-47.
[9]Charles PE,Dalle F,Aho S,et al.Serum procalcitonin measurement contribution t0the early diagnosis of candid emia in critically ill patients[J].Intensive Care Med,2006,32(10):1577-1583.
[10]Ammori BJ,Becker KL,Kite P,et al.Calcitonin precursors:early markers of gut barrier dysfunction in patients with acute pancreatitis[J].Pancreas,2003,27(3):239-243.
[11]Ychiyama M,Ohno N,Miura NN.Solubilized cellwallβ-D-glucan,CSBG,is an epitope of Candida immune mice[J].Biol Pharm Bull,2000,23(5):672-676.
[12]De Pauw B,Walsh TJ,Donnelly JP,et al.Revised definitions of invasive fungal disease from the European organization for research and treatment of cancer/invasive fungal infections cooperative group and the national institute of allergy and infectious diseases mycoses study group(EORTC/MSG)consensus group[J].Clin Infect Dis,2008,46(12):1813-1821.
[13]Reiss E,Obayashi T,Orle K,et al.Non-culture based diagnostic tests for mycotic infections[J].Med Mycol,2003,38Suppl 1:S147-159.
[14]Pickering JW,Sant HW,Bowles CAP,et al.Evaluation of a(1-3)β-D-glucan assay for diagnosis of invasive fungal infections[J].J Clin Micobiol,2005,43(12):5957-5962.
[15]Persat F,Ranque S,Demuin F,et al.Contribution of the(1-3)-β-D-glucan assay for diagnosis of invasive fungal infections[J].J Clin Microbiol,2008,46(3):1009-1013.

